
|
|
HISTORIA DE LA TECNOLOGÍA, TECNOLOGÍA, OBJETOS ALREDEDOR DE NOSOTROS
Dinamita. Historia de la invención y la producción.
Directorio / La historia de la tecnología, la tecnología, los objetos que nos rodean. La dinamita es una mezcla explosiva, un absorbente (por ejemplo, tierra de diatomeas) impregnado de nitroglicerina. También puede contener otros componentes (salitre, etc.). La masa entera generalmente se presiona en forma cilíndrica y se coloca en un empaque de papel o plástico. El socavamiento de la carga se lleva a cabo utilizando una tapa detonadora. La dinamita fue patentada por Alfred Nobel el 25 de noviembre de 1867.
Durante varios siglos, la gente conocía solo un explosivo: la pólvora negra, que se usaba ampliamente tanto en la guerra como en las voladuras pacíficas. Pero la segunda mitad del siglo XIX estuvo marcada por la invención de toda una familia de nuevos explosivos, cuyo poder destructivo era cientos y miles de veces mayor que el de la pólvora. Su creación fue precedida por varios descubrimientos. Ya en 1838, Peluz realizó los primeros experimentos sobre la nitración de sustancias orgánicas. La esencia de esta reacción radica en el hecho de que muchas sustancias carbonosas, cuando se tratan con una mezcla de ácidos nítrico y sulfúrico concentrados, ceden su hidrógeno, toman a cambio el grupo nitro NO2 y convertirse en poderosos explosivos. Otros químicos han investigado este interesante fenómeno. En particular, Shenbein, algodón de nitruración, recibió piroxilina en 1846. En 1847, actuando de manera similar sobre la glicerina, Sobrero descubrió la nitroglicerina, un explosivo que tenía un poder destructivo colosal. Al principio, la nitroglicerina no interesaba a nadie. El propio Sobrero volvió a sus experimentos solo 13 años después y describió el método exacto de nitración del glicerol. Después de eso, la nueva sustancia encontró algún uso en la minería. Inicialmente, se vertía en el pozo, se taponaba con arcilla y se volaba mediante un cartucho sumergido en él. Sin embargo, el mejor efecto se logró al encender una cápsula de percusión con fulminato de mercurio. ¿Qué explica el excepcional poder explosivo de la nitroglicerina? Se descubrió que durante la explosión, se descompone, como resultado de lo cual se forman primero los gases de CO.2, CO, H2, CH4, N2 y NO, que nuevamente interactúan entre sí con la liberación de una gran cantidad de calor. La reacción final se puede expresar mediante la fórmula: 2C3H5(NO3)3 = 6CO2 + 5H2O+3N+0,5O2. Calentados a una temperatura enorme, estos gases se expanden rápidamente, ejerciendo una enorme presión sobre el medio ambiente. Los productos finales de la explosión son completamente inofensivos. Todo esto parecía hacer que la nitroglicerina fuera indispensable para las voladuras subterráneas, pero pronto resultó que la fabricación, el almacenamiento y el transporte de este explosivo líquido estaban plagados de muchos peligros. En general, la nitroglicerina pura es bastante difícil de encender con una llama abierta. Una cerilla encendida se pudrió en él sin ninguna consecuencia. Pero por otro lado, su sensibilidad a los golpes y conmociones cerebrales (detonación) era muchas veces mayor que la de la pólvora negra. Tras el impacto, a menudo bastante insignificante, en las capas sometidas a sacudidas, se producía un rápido aumento de la temperatura hasta que se iniciaba la reacción explosiva. La mini-explosión de las primeras capas produjo un nuevo impacto en las capas más profundas, y esto continuó hasta que se produjo la explosión de toda la masa de materia. A veces, sin ninguna influencia externa, la nitroglicerina de repente comenzaba a descomponerse en ácidos orgánicos, se oscurecía rápidamente y luego la más insignificante sacudida de la botella era suficiente para causar una terrible explosión. Después de una serie de accidentes, el uso de nitroglicerina se prohibió casi universalmente. A los industriales que establecieron la producción de este explosivo les quedaban dos opciones: encontrar una condición en la que la nitroglicerina fuera menos sensible a la detonación o reducir su producción. Uno de los primeros que se interesó por la nitroglicerina fue el ingeniero sueco Alfred Nobel, quien fundó una planta para su producción. En 1864, su fábrica despegó con los trabajadores. Cinco personas murieron, incluido el hermano de Alfred, Emil, que apenas tenía 20 años. Después de este desastre, Nobel se vio amenazado con pérdidas significativas: no fue fácil convencer a la gente de que invirtiera en una empresa tan peligrosa. Durante varios años estudió las propiedades de la nitroglicerina y finalmente logró establecer una producción completamente segura de la misma. Pero el problema del transporte permaneció. Después de muchos experimentos, Nobel descubrió que la nitroglicerina disuelta en alcohol es menos sensible a la detonación. Sin embargo, este método no proporcionó una fiabilidad completa. La búsqueda continuó, y luego un incidente inesperado ayudó a resolver el problema de manera brillante. Al transportar botellas de nitroglicerina, para suavizar el temblor, se colocaban en tierra de diatomeas, una tierra de diatomeas especial extraída en Hannover. Kieselguhr consistía en conchas de pedernal de algas con muchas cavidades y túbulos. Y una vez, durante el envío, una botella de nitroglicerina se rompió y su contenido se derramó por el suelo. Nobel tuvo la idea de hacer algunos experimentos con esta tierra de diatomeas impregnada de nitroglicerina. Resultó que las propiedades explosivas de la nitroglicerina no disminuyeron en absoluto por el hecho de que fue absorbida por la tierra porosa, pero su sensibilidad a la detonación disminuyó varias veces. En este estado, no explotó ni por fricción, ni por golpe débil, ni por quemadura. Pero por otro lado, cuando se encendía una pequeña cantidad de fulminato de mercurio en una cápsula de metal, se producía una explosión de la misma fuerza que daba nitroglicerina pura en el mismo volumen. En otras palabras, era exactamente lo que se necesitaba, e incluso mucho más de lo que Nobel esperaba obtener. En 1867, obtuvo una patente para un compuesto que descubrió, al que llamó dinamita. El poder explosivo de la dinamita es tan grande como el de la nitroglicerina: 1 kg de dinamita en 1/50000 de segundo desarrolla una fuerza de 1000000 kgm, es decir, suficiente para levantar 1000000 kg por 1 m. el polvo se convirtió en gas durante 1 segundos, luego 0 kg de dinamita en 01 segundos. Pero con todo esto, la dinamita bien hecha explotó solo de un golpe muy fuerte. Encendida por el toque del fuego, ardió gradualmente sin explosión, con una llama azulada. La explosión ocurrió solo cuando se encendió una gran masa de dinamita (más de 1 kg). La mejor manera de socavar la dinamita, como la nitroglicerina, era mediante la detonación. Para este propósito, Nobel en el mismo año 1867 inventó un detonador de cebador traqueteante. La dinamita encontró inmediatamente la aplicación más amplia en la construcción de carreteras, túneles, canales, vías férreas y otros objetos, lo que predeterminó en gran medida el rápido crecimiento de la fortuna de su inventor. Nobel fundó la primera fábrica para la producción de dinamita en Francia, luego instaló su producción en Alemania e Inglaterra. Durante treinta años, el comercio de dinamita trajo a Nobel una enorme riqueza: alrededor de 35 millones de coronas.
El proceso de elaboración de la dinamita se reducía a varias operaciones. En primer lugar, era necesario obtener nitroglicerina. Este fue el momento más difícil y peligroso de toda la producción. La reacción de nitración ocurrió cuando 1 parte de glicerol se trató con 6 partes de ácido nítrico concentrado en presencia de XNUMX partes de ácido sulfúrico concentrado. La ecuación quedó así: C3H5(OH)3 +3HNO3 = C3H5(Yo no tengo3)3 + 3H2O. El ácido sulfúrico no participaba en el compuesto, pero su presencia era necesaria, en primer lugar, para absorber el agua liberada como consecuencia de la reacción, que de lo contrario, diluyendo el ácido nítrico, impediría que la reacción fuera completa, y, en segundo lugar, para aislar la nitroglicerina resultante de una disolución en ácido nítrico, ya que, siendo muy soluble en este ácido, no se disolvía en su mezcla con ácido sulfúrico. La nitración fue acompañada por una fuerte liberación de calor. Además, si, debido al calentamiento, la temperatura de la mezcla aumentara por encima de los 50 grados, entonces el curso de la reacción iría en la otra dirección: comenzaría la oxidación de la nitroglicerina, acompañada de una liberación rápida de óxidos de nitrógeno y un calentamiento aún mayor. , lo que provocaría una explosión. Por lo tanto, la nitración se tuvo que realizar con enfriamiento constante de la mezcla de ácidos y glicerol, agregando este último poco a poco y removiendo constantemente cada porción. La nitroglicerina formada directamente en contacto con ácidos, que tiene una densidad más baja en comparación con la mezcla ácida, flotó hacia la superficie y se pudo recolectar fácilmente una vez que se completó la reacción. La preparación de la mezcla ácida en las fábricas de Nobel se realizaba en grandes recipientes cilíndricos de hierro fundido, desde donde la mezcla ingresaba al llamado aparato de nitración.
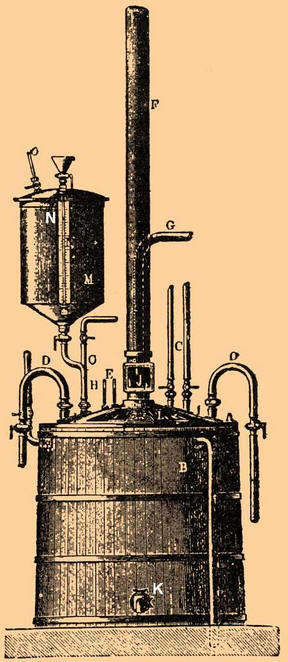
El aparato constaba de un recipiente de plomo A, que se colocaba en una tina de madera B y se cerraba con una tapa de plomo L, que se untaba con cemento durante el funcionamiento. Los extremos de dos bobinas de plomo D, ubicadas dentro del aparato, pasaban a través de la cubierta (a través de ellas se suministraba constantemente agua fría). También se suministró aire frío al aparato a través del tubo C para agitar la mezcla. El tubo F eliminó los vapores de ácido nítrico del aparato; el tubo G sirvió para verter una cantidad medida de la mezcla ácida; Se vertió glicerol a través del tubo H. En el recipiente M se midió la cantidad requerida de esta sustancia, que luego se inyectó en la mezcla de nitrógeno mediante aire comprimido admitido a través del tubo O. En una instalación de este tipo, se podrían procesar alrededor de 150 kg de glicerol a la vez. Habiendo dejado entrar la cantidad requerida de la mezcla de ácido y enfriándola (haciendo pasar aire comprimido frío y agua fría a través de las bobinas) a 15-20 grados, comenzaron a rociar la glicerina enfriada. Al mismo tiempo, se aseguraron de que la temperatura en el aparato no superara los 30 grados. Si la temperatura de la mezcla comenzaba a subir rápidamente y se acercaba al punto crítico, el contenido de la tina podía verterse rápidamente en un recipiente grande de agua fría. La operación de formación de nitroglicerina duró aproximadamente una hora y media. Después de eso, la mezcla ingresaba al separador: una caja rectangular de plomo con un fondo cónico y dos grifos, uno de los cuales estaba ubicado en la parte inferior y el otro en el costado. Una vez que la mezcla se hubo sedimentado y separado, la nitroglicerina se liberó por el grifo superior y la mezcla ácida por el fondo. La nitroglicerina resultante se lavó varias veces para eliminar el exceso de ácidos, ya que el ácido podía reaccionar con ella y provocar su descomposición, lo que inevitablemente provocaba una explosión. Para evitar esto, se suministró agua a la tina hermética con nitroglicerina y la mezcla se mezcló con aire comprimido. El ácido se disolvió en agua y, dado que las densidades del agua y la nitroglicerina diferían mucho, no fue difícil separarlas. Para eliminar el agua residual, se pasó nitroglicerina a través de varias capas de fieltro y sal de mesa. Como resultado de todas estas acciones se obtuvo un líquido aceitoso amarillento, inodoro y muy venenoso (la intoxicación podía ocurrir tanto por inhalación de vapores como por contacto de gotas de nitroglicerina en la piel). Cuando se calentó por encima de los 180 grados, explotó con una terrible fuerza destructiva. La nitroglicerina preparada se mezcló con tierra de diatomeas. Antes de esto, la tierra de diatomeas se lavó y se trituró completamente. La impregnación con nitroglicerina se llevó a cabo en cajas de madera revestidas con plomo en el interior. Después de mezclarla con nitroglicerina, la dinamita se frotaba a través de un tamiz y se metía en cartuchos de pergamino. En la dinamita de tierra de diatomeas, solo la nitroglicerina estaba involucrada en la reacción explosiva. Más tarde, a Nobel se le ocurrió la idea de impregnar varios grados de pólvora con nitroglicerina. En este caso, la pólvora también participó en la reacción y aumentó significativamente la fuerza de la explosión. Autor: Ryzhov K.V.
▪ Компас
Una nueva forma de controlar y manipular señales ópticas
05.05.2024 Teclado Primium Séneca
05.05.2024 Inaugurado el observatorio astronómico más alto del mundo
04.05.2024
▪ Las llamas ayudan a combatir la gripe ▪ Nuevos acelerómetros de baja potencia y alta precisión ▪ Pilas domésticas recargables ecológicas
▪ sección del sitio Relojes, temporizadores, relés, interruptores de carga. Selección de artículos ▪ artículo de Johann Gottfried Herder. Aforismos famosos ▪ ¿Cuál es el océano más profundo? Respuesta detallada ▪ artículo Frecuencímetro multifuncional. Enciclopedia de radioelectrónica e ingeniería eléctrica. ▪ articulo Pulpo, chicle escolar y mosca. experimento fisico
Hogar | Biblioteca | Artículos | Mapa del sitio | Revisiones del sitio www.diagrama.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese



 Ver otros artículos sección
Ver otros artículos sección 