
|
|
Notas de clase, hojas de trucos
Química Inorgánica. Hoja de trucos: brevemente, lo más importante
Directorio / Notas de clase, hojas de trucos tabla de contenidos
1. La relación entre los procesos del metabolismo y la energía en el cuerpo. Sistema termodinámico Los procesos de vida en la Tierra se deben en gran parte a la acumulación de energía solar en sustancias biogénicas (proteínas, grasas, carbohidratos) y las transformaciones posteriores de estas sustancias en organismos vivos con liberación de energía. Los trabajos de A. M. Lavoisier (1743-1794) y P. S. Laplace (1749-1827) demostraron mediante mediciones calorimétricas directas que la energía liberada durante la vida está determinada por la oxidación de los productos alimenticios por el oxígeno del aire inhalado por los animales. Con el desarrollo en los siglos XIX-XX. termodinámica, se hizo posible calcular cuantitativamente la conversión de energía en reacciones bioquímicas y predecir su dirección. El método termodinámico se basa en una serie de conceptos estrictos: "sistema", "estado del sistema", "energía interna del sistema", "función del estado del sistema". sistema termodinámico se llama cualquier objeto de la naturaleza, que consiste en un número suficientemente grande de moléculas (unidades estructurales) y separado de otros objetos de la naturaleza por una superficie límite real o imaginaria (interfaz). Los objetos de la naturaleza que no están incluidos en el sistema se denominan medio ambiente. Las características más comunes de los sistemas son m, la masa de la sustancia contenida en el sistema, y E, la energía interna del sistema. La masa de la sustancia del sistema está determinada por la masa total de las moléculas que la componen. La energía interna del sistema es la suma de las energías del movimiento térmico de las moléculas y la energía de interacción entre ellas. Los sistemas según la naturaleza del intercambio de materia y energía con el medio ambiente se dividen en tres tipos: aislados, cerrados y abiertos. sistema aislado se llama sistema al que no intercambia materia ni energía con el medio (Δm = 0, ΔE = 0). Un sistema cerrado es un sistema que no intercambia materia con el medio ambiente, pero puede intercambiar energía (Δm = 0, ΔE^ 0). El intercambio de energía se puede realizar transfiriendo calor o realizando trabajo. sistema abierto se llama tal sistema que puede intercambiar tanto materia como energía con el medio (Δm ≠ 0, ΔE ≠ 0). Un ejemplo importante de un sistema abierto es la célula viva. Los sistemas, según el estado de agregación de la sustancia que los compone, se dividen en homogéneos y heterogéneos. En un sistema homogéneo, no hay cambios bruscos en las propiedades físicas y químicas al pasar de un área del sistema a otra. Un ejemplo de tal sistema es el plasma sanguíneo, que es una solución de varias sustancias biogénicas. Un sistema heterogéneo consta de dos o más partes homogéneas. Un ejemplo de un sistema heterogéneo es la sangre entera, es decir, plasma con células: eritrocitos y leucocitos. 2. La primera ley de la termodinámica. Conceptos que caracterizan el sistema La primera ley de la termodinámica proporciona un marco cuantitativo riguroso para analizar la energía de varios sistemas. Para formularlo es necesario introducir una serie de conceptos nuevos que caracterizan al sistema. Uno de los conceptos más importantes es el estado del sistema. Un estado se entiende como un conjunto de propiedades del sistema que permiten definir un sistema desde el punto de vista de la termodinámica. Como característica generalizada del estado del sistema se utilizan los siguientes conceptos: "equilibrio", "estacionario", "estado de transición". El estado del sistema se llama equilibrio si todas las propiedades permanecen constantes durante un largo período de tiempo y no hay flujos de materia y energía en el sistema. Si las propiedades del sistema son constantes en el tiempo, pero existen flujos de materia y energía, el estado se denomina estacionario. Cuantitativamente, los estados se distinguen con la ayuda de variables termodinámicas. Las variables termodinámicas son aquellas cantidades que caracterizan el estado del sistema como un todo. También se denominan parámetros termodinámicos del sistema. Las variables termodinámicas más importantes son la presión p, la temperatura T, el volumen del sistema V o la masa total del sistema m, las masas de los productos químicos (componentes) mk que componen el sistema, o la concentración de estas sustancias m. Cabe señalar que el médico utiliza características similares (temperatura, peso, composición de fluidos biológicos, presión arterial) para determinar la condición del paciente. La transición de un sistema de un estado a otro se llama por proceso. Como resultado del proceso, el estado del sistema y las variables termodinámicas cambian. Si denotamos el valor de la variable termodinámica en el estado inicial como Х1 , y finalmente - X2 , entonces el cambio en esta variable es respectivamente igual a ΔX = X2 - X1 y se denomina incremento de la variable termodinámica X. El incremento, tomado con el signo contrario, se denomina disminución de la variable X. La energía interna del sistema E es una de las funciones de estado termodinámicas. Una característica importante de las funciones estatales es su independencia del método para lograr un estado dado del sistema. El cambio en la energía interna del sistema ΔE se debe al trabajo W, que se realiza durante la interacción del sistema con el medio ambiente, y el intercambio de calor Q entre el medio ambiente y el sistema, la relación entre estas cantidades es la contenido de la primera ley de la termodinámica. El aumento de la energía interna del sistema ΔE en algún proceso es igual al calor Q recibido por el sistema, más el trabajo W realizado sobre el sistema en este proceso: ∆E=Q+W. En los sistemas biológicos, el sistema generalmente emite calor al entorno externo, y el sistema realiza trabajo debido a la pérdida de energía interna. Es conveniente representar el registro matemático de la primera ley de la termodinámica en la forma: ∆E = Q - W. Todas las cantidades en las fórmulas anteriores se miden en julios (J). 3. Primera ley de la termodinámica La primera ley de la termodinámica es una de las leyes fundamentales de la naturaleza que no puede derivarse de ninguna otra ley. Su validez está demostrada por numerosos experimentos, en particular, intentos fallidos de construir una máquina de movimiento perpetuo del primer tipo, es decir, una máquina que podría trabajar durante un tiempo arbitrariamente largo sin suministrar energía desde el exterior. Dependiendo de las condiciones del proceso en el sistema, se utilizan varias funciones de estado, que se derivan de la primera ley de la termodinámica. Al mismo tiempo, en lugar de sistemas biológicos complejos, se utilizan modelos simplificados para obtener conclusiones sobre las transformaciones de masa y energía. La presión en el sistema se mantiene constante, es igual a la presión externa. Tales procesos que ocurren en p = const se llaman isobáricos. Se sabe que el trabajo de expansión realizado en un proceso isobárico es: W = ρΔV, donde ΔV es el incremento de volumen del sistema, igual a la diferencia entre los volúmenes en los estados 2 y 1. Sustituyendo el trabajo de la expansión en la expresión matemática de la primera ley y realizando transformaciones simples, obtenemos: Qρ = ΔE + pΔV = (E2 + ρV2)-(MI1 +ρΔV1) donde Qρ es el calor del proceso isobárico; 1, 2 - índices relacionados con el inicio y el final del proceso. El valor (E + pV) es función del estado del sistema, denotado por H y llamado entalpía: H = mi + ρV. En consecuencia, la expresión se puede escribir como: Qp = H2 -H1 = ∆H. De esta expresión se sigue que entalpía - función de estado, cuyo incremento es igual al calor recibido por el sistema en el proceso isobárico. La medida del incremento de entalpía en un determinado proceso se puede realizar realizando dicho proceso en un calorímetro a presión constante. Así es como A. M. Lavoisier y P. S. Laplace llevaron a cabo sus experimentos, estudiando la energía del metabolismo en un organismo vivo. En los casos en que el cambio de estado del sistema se produce a volumen constante, el proceso se denomina isocórico. En este caso, el cambio de volumen AV es igual a cero, y de acuerdo con la fórmula, el trabajo de expansión W = 0. Luego, de la expresión matemática de la primera ley de la termodinámica se sigue: Qv = ∆E. La definición termodinámica se deriva de la relación anterior: energía interna - función de estado, cuyo incremento es igual al calor QV obtenido por el sistema en el proceso isocórico. Por tanto, el cambio de energía interna en un determinado proceso se puede medir realizando este proceso en un calorímetro a volumen constante. Se sigue que en ρ = const los incrementos de energía interna y entalpía están relacionados por la relación: ∆H = ∆E + ρ∆V. 4. Ley de Hess La sección de la termodinámica que estudia la transformación de la energía en las reacciones químicas se denomina termodinámica química. La ecuación de reacción para la cual se indican los cambios de energía interna ΔE, entalpía ΔH o alguna otra función de estado correspondiente a esta reacción se denomina termoquímica. Las reacciones químicas, durante las cuales la entalpía del sistema disminuye (ΔH < 0) y se libera calor al ambiente externo, se denominan exotérmico. Reacciones en las que la entalpía aumenta (ΔH > 0) y el sistema absorbe calor Qp afuera se llaman endotérmico. La oxidación de la glucosa con oxígeno se produce con la liberación de una gran cantidad de calor (Qp \u2800d XNUMX kJ // mol), es decir, este proceso es exotérmico. La ecuación termoquímica correspondiente se puede escribir como С6 Н12 О6 + 602 = 6С02 + 6Н2Ah, ΔH = 2800 kJ. Las reacciones que ocurren en solución suelen ir acompañadas de un ligero cambio en el volumen del sistema, es decir, ΔV ≈ 0. En este sentido, en muchos casos, en cálculos biológicos, podemos suponer que ΔH = ΔE. En consecuencia, la liberación de calor en tales sistemas se debe principalmente a una disminución de la energía interna como resultado de la reacción, y viceversa. La entalpía de formación del compuesto A es el cambio en la entalpía del sistema ΔHA acompañando la formación de 1 mol del compuesto A a partir de sustancias simples. Se supone que las entalpías de formación de oxígeno, carbono, hidrógeno y todas las demás sustancias elementales (simples) son cero. En igualdad de condiciones, la energía interna y la entalpía son proporcionales a la cantidad de materia en el sistema. Estas funciones termodinámicas se denominan extensivas. Desde el punto de vista de la termodinámica, la reacción de la forma general nAA + pВ = norteС + norteD , Δh es la transición del sistema desde el estado inicial con la entalpía H1 al estado 2 con entalpía H2. El cambio en la entalpía del sistema como resultado de esta transición, llamado entalpía de esta reacción, es igual a la diferencia: ΔHpia = H2 -H1 = (sincHc + norteDHD) - (nАНА + norteBHB). La ley de la constancia de las sumas de calor fue descubierta por el químico ruso G. I. Hess en 1840. Es el descubridor de la aplicabilidad de la primera ley de la termodinámica en las transformaciones químicas y el fundador de la termodinámica química. Actualmente, la ley de Hess se considera como una consecuencia de la primera ley de la termodinámica y se formula de la siguiente manera: el incremento de entalpía en la formación de productos dados a partir de reactivos dados a presión constante no depende del número y tipo de reacciones que dan como resultado la formación de estos productos En los cálculos termoquímicos, no es la ley de Hess en sí misma la que se usa con más frecuencia, sino su consecuencia, derivada anteriormente para el caso particular de oxidación de la glucosa en forma de igualdad (2). Para una reacción presentada en forma general pАA + pвsegundo = = norteсdo + norteDD, una consecuencia de la ley de Hess se escribe usando la igualdad ΔHpia = (sinCΔHC + norteDΔHD) - (nAΔHA ++nBΔHB ) y se formula de la siguiente manera: la entalpía de reacción es igual a la suma algebraica de las entalpías de formación de una cantidad estequiométrica de productos menos la suma algebraica de las entalpías de formación de una cantidad estequiométrica de reactivos. 5. La segunda ley de la termodinámica. energía libre de gibbs El cuerpo realiza trabajo gastando energía interna almacenada en forma de energía de interacción química de los átomos de sus sustancias constituyentes. La expresión matemática ΔE \uXNUMXd Q - W de la primera ley de la termodinámica determina la relación exacta entre el consumo de energía interna del sistema ΔЕ, el trabajo W realizado por el sistema y la energía Q, que se pierde en forma de calor. Sin embargo, a partir de la primera ley de la termodinámica es imposible determinar la parte de la energía interna gastada que se puede convertir en trabajo. Las estimaciones de costos teóricos se basan en la segunda ley de la termodinámica. Esta ley impone estrictas restricciones a la eficiencia de convertir la energía en trabajo y, además, permite introducir criterios sobre la posibilidad de un flujo espontáneo de un proceso. El proceso se llama espontáneosi se lleva a cabo sin influencias, cuando el sistema se deja solo. Hay procesos en los que la energía interna del sistema no cambia (ΔE = 0). Dichos procesos incluyen, por ejemplo, la ionización de ácido acético en agua. Varios procesos espontáneos proceden con un aumento de la energía interna (ΔE > 0). Esto incluye, en particular, reacciones típicas de la formación de compuestos bioinorgánicos de albúmina (proteína del plasma sanguíneo) con iones metálicos, como Cu2+. El cambio de energía interna AE para sistemas cerrados no puede servir como criterio para procesos espontáneos. En consecuencia, la primera ley de la termodinámica, de la que se deriva este criterio, no es suficiente para resolver la cuestión de la espontaneidad, así como la eficiencia de los procesos. La solución de estas preguntas se logra con la ayuda de la segunda ley de la termodinámica. Para formular la segunda ley de la termodinámica es necesario introducir los conceptos de procesos reversibles e irreversibles en el sentido termodinámico. Si el sistema está en equilibrio, este estado se mantiene indefinidamente bajo las mismas condiciones externas. Cuando las condiciones externas cambian, el estado del sistema puede cambiar, es decir, puede tener lugar un proceso en el sistema. Se dice que un proceso es termodinámicamente reversible si, durante la transición del estado inicial 1 al estado final 2, todos los estados intermedios están en equilibrio. El proceso se llama termodinámicamente irreversible si al menos uno de los estados intermedios no está en equilibrio. Un proceso reversible puede llevarse a cabo solo con un cambio lo suficientemente lento en los parámetros del sistema: temperatura, presión, concentración de sustancias, etc. La tasa de cambio en los parámetros debe ser tal que las desviaciones del equilibrio que ocurren durante el proceso son insignificantes. Cabe señalar que un problema importante en medicina está asociado con la reversibilidad: la conservación de tejidos a bajas temperaturas. Los procesos reversibles son el caso límite de los procesos reales que ocurren en la naturaleza y se llevan a cabo en la industria o en los laboratorios. 6. La segunda ley de la termodinámica. entropía Trabajo máximo Wмакс, que se puede obtener con una pérdida dada de energía interna ΔE en el proceso de transición del estado 1 al estado 2, se logra solo si este proceso es reversible. De acuerdo con la expresión de la primera ley de la termodinámica, el calor mínimo Qmin Qmin \uXNUMXd ΔE - Oмакс . El factor de eficiencia máxima alcanzable, que caracteriza la rentabilidad de la energía interna del sistema, es respectivamente igual a ηмакс=Wмакс / ΔE. En un proceso irreversible de transición del estado 1 al estado 2, el trabajo realizado por el sistema es menor que W. Para calcular el factor máximo hмакс con un valor conocido de ΔE, es necesario conocer el valor de Wмакс o Qmin Wмакс = ΔE - Qmin , por lo tanto, ηмакс \u1d XNUMX - ΔE / Qmin . valor Qmin se puede calcular a partir de la segunda ley de la termodinámica usando una función de estado termodinámica llamada entropía. El concepto de entropía fue introducido (1865) por el físico alemán R. Yu. Clausius (1822-1888), uno de los fundadores de la termodinámica y la teoría cinética molecular de los procesos térmicos. Definición termodinámica de entropía según Clausius: la entropía es una función de estado cuyo incremento ΔS es igual al calor Qmin llevado al sistema en un proceso isotérmico reversible, dividido por la temperatura absoluta T a la que se lleva a cabo el proceso: ∆S = Qmin / t De la fórmula se deduce que la unidad de entropía es J/K. Un ejemplo de proceso isotérmico reversible es el derretimiento lento del hielo en un termo lleno de agua a 273°K. Se ha establecido experimentalmente que para la fusión de 1 mol de hielo (18 g) es necesario suministrar al menos 6000 J de calor. En este caso, la entropía del sistema "hielo - agua" en el termo aumenta en ΔS = 6000 J: 273°K = 22 J/K. Cuando un termo con agua se enfría a 273°K, se pueden eliminar lentamente 6000 J de calor y se forma 1 mol de hielo durante la cristalización del agua. Para este proceso, Qmin en la fórmula es negativo. En consecuencia, la entropía del sistema "hielo - agua" durante la formación de 1 mol de hielo disminuye en ΔS = 22 J/K. De manera similar, es posible calcular el cambio de entropía para cualquier proceso físico y químico isotérmico, si se conoce el calor suministrado al sistema o extraído de él durante estos procesos. Como se sabe por la física, este calor se puede determinar usando medidas calorimétricas. Por lo tanto, el cambio en la entropía, así como en otras dos funciones del estado del sistema, la energía interna y la entalpía, es una cantidad determinada experimentalmente. El significado físico de la entropía, así como de la energía interna, se revela claramente cuando se consideran los procesos que ocurren en sistemas aislados desde el punto de vista cinético-molecular. 7. Fórmula de Boltzmann Los sistemas aislados, por definición, no intercambian ni materia ni energía con el medio ambiente. Por supuesto, tales sistemas no existen realmente en la naturaleza. Sin embargo, se puede lograr un muy buen aislamiento colocando el sistema en un termo sellado con un corcho. Resulta que cualquier proceso espontáneo puede tener lugar en un sistema aislado solo si se caracteriza por un aumento de la entropía; en equilibrio, la entropía del sistema es constante: ∆S ≥ 0. Esta afirmación, basada en observaciones experimentales, es una de las posibles formulaciones de la segunda ley de la termodinámica. Un proceso inverso al espontáneo, según la segunda ley de la termodinámica, no puede proceder en un sistema aislado, ya que dicho proceso se caracteriza por una disminución de la entropía. Un examen de varios sistemas aislados muestra que los procesos espontáneos siempre están asociados con un aumento en el número de microestados w del sistema. En los mismos procesos, la entropía S del sistema aumenta, es decir, la entropía aumenta con un aumento en el número de microestados. Por primera vez, el físico austriaco L. Boltzmann notó la existencia de tal dependencia, quien en 1872 propuso la relación: КБ =R/NA = 1,38 - 1023 J/K, donde KБ - Constante de Boltzmann, igual a la relación entre la constante de los gases R y la constante de Avogadro NA . Esta relación se llama fórmula de Boltzmann. La fórmula de Boltzmann permite calcular teóricamente la entropía de un sistema a partir del número de sus posibles microestados. Dichos cálculos concuerdan bien con los valores determinados experimentalmente. En particular, se sabe que el número de microestados de sustancias cristalinas a 0°K es cercano a w0 "1. Por lo tanto, se pueden determinar los valores absolutos de la entropía de las sustancias que cristalizan, en contraste con la energía interna E y la entalpía H, para las cuales solo se pueden determinar los valores relativos. Un aumento en el número de microestados de un sistema en muchos casos puede estar asociado con un aumento del desorden en este sistema, con una transición a distribuciones más probables de la energía del sistema. Con base en la relación de Boltzmann, se puede dar una definición cinética molecular de entropía. La entropía es una medida de la probabilidad de que un sistema se encuentre en un estado dado o una medida del desorden del sistema. La importancia del concepto de entropía se debe a que a partir de este valor es posible predecir la dirección de los procesos espontáneos. Sin embargo, la aplicabilidad de medir la entropía como criterio para la dirección de los procesos se limita a sistemas aislados de acuerdo con la formulación de la segunda ley de la termodinámica. 8. Energía de Gibbs Como criterio para la espontaneidad de los procesos en sistemas abiertos y cerrados, se introduce una nueva función de estado: la energía de Gibbs. Esta función recibió su nombre del gran físico estadounidense DW Gibbs (1839-1903), quien derivó esta función y luego la utilizó en el trabajo termodinámico. La energía de Gibbs se determina en términos de la entalpía H y la entropía S usando las relaciones: GRAMO = H - S, ∆G = ∆H - ∆S. Con base en la energía de Gibbs, la segunda ley de la termodinámica se puede formular de la siguiente manera: en condiciones isobáricas isotérmicas (p, T = const), solo tales procesos pueden ocurrir espontáneamente en el sistema, como resultado de lo cual la energía de Gibbs del sistema disminuye (ΔG < 0).En el estado de equilibrio, la energía de Gibbs de el sistema no cambia (G = const, AG = 0). ΔG < 0, p, T = const. De lo anterior se desprende que la energía de Gibbs juega un papel importante en el estudio de los procesos bioenergéticos. Con esta función de estado, puede predecir la dirección de los procesos espontáneos en los sistemas biológicos y calcular la eficiencia máxima alcanzable. La energía de Gibbs G, como la entalpía H, es una función del estado del sistema. Por lo tanto, el cambio en la energía de Gibbs ΔG se puede usar para caracterizar las transformaciones químicas de manera similar al cambio en la entalpía ΔН. Las ecuaciones de reacción para las que se indica el cambio en la energía de Gibbs correspondiente a estas reacciones también se denominan termoquímicas. Las reacciones químicas, durante las cuales la energía de Gibbs del sistema disminuye (ΔG < 0) y se realiza trabajo, se denominan exergónicas. Las reacciones en las que la energía de Gibbs aumenta (ΔG > 0) y se realiza trabajo en el sistema se denominan endergónicas. Derivada de la segunda ley de la termodinámica, la energía de Gibbs es una función de estado. Por tanto, al igual que para la entalpía, la ley de Hess para la energía de Gibbs se puede formular de la siguiente forma: el cambio en la energía de Gibbs durante la formación de productos dados a partir de reactivos dados a presión y temperatura constantes no depende del número y tipo de reacciones que dan como resultado la formación de estos productos. Un ejemplo importante de la aplicación de la ley de Hess es el cálculo de la energía de Gibbs de la reacción de oxidación de glucosa con dioxígeno. El cambio en la energía de Gibbs en esta reacción en p = 101 kPa y T = 298°K, determinado fuera del cuerpo, es ΔG° = 2880 kJ/mol. La ecuación termoquímica correspondiente se escribe como: С6Н12О6 + 6O2 = 6CO2 + 6Н2Oh, ΔGpia° = 2880 kJ/mol. En las células del cuerpo, esta reacción se lleva a cabo a través de una serie de etapas sucesivas estudiadas por los bioquímicos. Se puede predecir a partir de la ley de Hess que la suma de los cambios de energía de Gibbs en todas las reacciones intermedias es ΔGpia: ΔG1 +ΔG2 +ΔG3 + … + ∆Gn = ∆Gpia 🇧🇷. La energía de Gibbs de una reacción es igual a la suma algebraica de las energías de Gibbs de formación de una cantidad estequiométrica de productos menos la suma algebraica de las energías de Gibbs de formación de una cantidad estequiométrica de reactivos: ΔGpia = (sincΔGc + norteDΔGD)(norteAΔGA + norteBΔGB). 9. Soluciones. Clasificación de soluciones Según el estado de agregación, las soluciones pueden ser gaseosas, líquidas y sólidas. Cualquier solución consta de solutos y un solvente, aunque estos conceptos son algo arbitrarios. Por ejemplo, dependiendo de la proporción de la cantidad de alcohol y agua, este sistema puede ser una solución de alcohol en agua o agua en alcohol. Por lo general, se considera que el solvente es el componente que está en la solución en el mismo estado de agregación que antes de la disolución. La doctrina de las soluciones es de particular interés para los médicos porque los fluidos biológicos más importantes (sangre, linfa, orina, saliva, sudor) son soluciones de sales, proteínas, carbohidratos y lípidos en agua. Los fluidos biológicos intervienen en el transporte de nutrientes (grasas, aminoácidos, oxígeno), fármacos a órganos y tejidos, así como en la excreción de metabolitos (urea, bilirrubina, dióxido de carbono, etc.) del organismo. El plasma sanguíneo es un medio para las células: linfocitos, eritrocitos, plaquetas. En los medios líquidos del cuerpo se mantiene la constancia de la acidez, la concentración de sales y sustancias orgánicas. Esta constancia se denomina homeostasis de concentración. Clasificación de soluciones Las soluciones de sustancias con una masa molar inferior a 5000 g/mol se denominan soluciones de compuestos de bajo peso molecular (NMS), y las soluciones de sustancias con una masa molar superior a 5000 g/mol se denominan soluciones de compuestos de alto peso molecular ( HMC). Según la presencia o ausencia de disociación electrolítica, las soluciones de NMS se dividen en dos clases: soluciones de electrolitos y no electrolitos. Soluciones de electrolitos: soluciones de sales, ácidos, bases, anfolitos que se disocian en iones. Por ejemplo, las soluciones KNO3, HCl, KOH, Al(OH)3 , glicina. La conductividad eléctrica de las soluciones de electrolitos es mayor que la del solvente. Soluciones de no electrolitos: soluciones de sustancias que prácticamente no se disocian en agua. Por ejemplo, soluciones de sacarosa, glucosa, urea. La conductividad eléctrica de las soluciones sin electrolitos difiere poco de la de un solvente. Las soluciones de NMS (electrolitos y no electrolitos) se denominan verdaderas, en contraste con las soluciones coloidales. Las soluciones verdaderas se caracterizan por la homogeneidad de la composición y la ausencia de una interfase entre el soluto y el solvente. El tamaño de las partículas disueltas (iones y moléculas) es inferior a 109m La mayoría de los DIU son polímeros cuyas moléculas (macromoléculas) consisten en una gran cantidad de grupos repetitivos o unidades monoméricas interconectadas por enlaces químicos. Las soluciones de DIU se denominan soluciones de polielectrolitos. Los polielectrolitos incluyen poliácidos (heparina, ácido poliadenílico, ácido poliaspártico, etc.), polibases (polilisina), polianfolitos (proteínas, ácidos nucleicos). Las propiedades de las soluciones HMS difieren significativamente de las de las soluciones NMS. Por lo tanto, serán discutidos en una sección separada. Este capítulo está dedicado a las soluciones de electrolitos, anfolitos y no electrolitos de bajo peso molecular. 10. El agua como disolvente El disolvente más común en nuestro planeta es el agua. El cuerpo de una persona promedio que pesa 70 kg contiene aproximadamente 40 kg de agua. Al mismo tiempo, aproximadamente 25 kg de agua caen sobre el líquido dentro de las células y 15 kg son líquido extracelular, que incluye plasma sanguíneo, líquido intercelular, líquido cefalorraquídeo, líquido intraocular y contenido líquido del tracto gastrointestinal. En los organismos animales y vegetales, el agua suele ser más del 50% y, en algunos casos, el contenido de agua alcanza el 90-95%. Debido a sus propiedades anómalas, el agua es un disolvente único, perfectamente adaptado para la vida. En primer lugar, el agua disuelve bien los compuestos iónicos y polares. Esta propiedad del agua se debe en gran medida a su alta constante dieléctrica (78,5). Otra gran clase de sustancias altamente solubles en agua incluye compuestos orgánicos polares como azúcares, aldehídos, cetonas y alcoholes. Su solubilidad en agua se explica por la tendencia de las moléculas de agua a formar enlaces polares con los grupos funcionales polares de estas sustancias, por ejemplo, con los grupos hidroxilo de alcoholes y azúcares o con el átomo de oxígeno del grupo carbonilo de aldehídos y cetonas. Los siguientes son ejemplos de enlaces de hidrógeno importantes para la solubilidad de sustancias en sistemas biológicos. Debido a su alta polaridad, el agua provoca la hidrólisis de las sustancias. Dado que el agua es la parte principal del ambiente interno del cuerpo, proporciona los procesos de absorción, movimiento de nutrientes y productos metabólicos en el cuerpo. Cabe señalar que el agua es el producto final de la oxidación biológica de sustancias, en particular de la glucosa. La formación de agua como resultado de estos procesos va acompañada de la liberación de una gran cantidad de energía, aproximadamente 29 kJ/mol. También son importantes otras propiedades anómalas del agua: alta tensión superficial, baja viscosidad, altos puntos de fusión y ebullición, y una mayor densidad en estado líquido que en estado sólido. El agua se caracteriza por la presencia de asociados, grupos de moléculas conectadas por enlaces de hidrógeno. Dependiendo de su afinidad por el agua, los grupos funcionales de las partículas disueltas se dividen en hidrofílicos (que atraen agua), fácilmente solvatables en agua, hidrofóbicos (que repelen el agua) y anfifílicos. Los grupos hidrófilos incluyen grupos funcionales polares: hidroxilo -OH, amino -NH2 , tiol -SH, carboxilo -COOH. A grupos hidrófobos - no polares, por ejemplo radicales hidrocarbonados: CHXNUMX-(CH2)п -, DE6Н5 -. Los aminoácidos incluyen sustancias (aminoácidos, proteínas) cuyas moléculas contienen grupos hidrofílicos (-OH, -NH2 , -SH, -COOH) y grupos hidrófobos: (CH3 - (CH2)п ,-DE6Н5-). Cuando se disuelven las sustancias anfifílicas, la estructura del agua cambia como resultado de la interacción con los grupos hidrofóbicos. El grado de ordenación de las moléculas de agua ubicadas cerca de los grupos hidrófobos aumenta y se minimiza el contacto de las moléculas de agua con los grupos hidrófobos. Los grupos hidrofóbicos, al asociarse, empujan las moléculas de agua fuera de su área de ubicación. 11. La concentración de la solución y cómo expresarla Solución Se denomina sistema homogéneo de composición variable de dos o más sustancias en estado de equilibrio. Las sustancias que forman una solución se llaman componentes de la solución. Una característica importante de una solución es su concentración. Este valor determina muchas propiedades de la solución. Concentración de sustancia (componente de la solución) es una cantidad medida por la cantidad de soluto contenido en cierta masa o volumen de una solución o solvente. Las formas más utilizadas para expresar la concentración son: fracción de masa, concentración molar, concentración molar equivalente, fracción molar, fracción de volumen, título. Fracción de masa W(X) expresada en fracciones de unidad, por ciento (%), ppm (una milésima de por ciento) y en partes por millón (ppm). La fracción de masa se calcula mediante las fórmulas: W(X) = m(X)/metro(años), W(X) = m(X)/metro(años) × 100%, donde m(X) - masa del componente dado X (soluto), kg (g); m (años) es la masa de la solución, kg (g). La concentración molar se expresa en mol/m3 , mol/dm3 , mol/cm3 , mol/l, mol/ml. En medicina es preferible el uso de unidades de mol/l. La concentración molar se calcula mediante la fórmula: C(X) = norte(X)/V(páginas) = m(X)/M(X) ×V(r), donde n(X) - cantidad de la sustancia disuelta del sistema, mol; M(X) es la masa molar del soluto, kg/mol o g/mol; m(X) es la masa de la sustancia disuelta, respectivamente, kg o g; V(r) - volumen de solución, l. concentración molar b(X) expresado en unidades de mol/kg. Forma de registro, por ejemplo: b (HCl) \u0,1d XNUMX mol / kg. Calcular la concentración molar por la fórmula: b(X) = norte(X)/m(rl) = m(X)/M(X) × metro(rl) donde m(rl) - masa de disolvente, kg. En química, el concepto de equivalente y factor de equivalencia es ampliamente utilizado. Equivalente se denomina partícula real o condicional de sustancia X, que en una reacción ácido-base dada es equivalente a un ion hidrógeno, o en una reacción redox dada - a un electrón, o en una reacción de intercambio dada entre sales - a una unidad de cargar. fracción de volumen f(X) expresada en fracciones de una unidad o en porcentaje, se calcula mediante la fórmula: Ф(X) V =(X)/ V(r) donde v(X) - el volumen de este componente X de la solución; V(r) es el volumen total del disolvente. El título de la solución se denota por T(X), unidad de medida - kg/cm3 , g/cm3 , g/ml. El título de la solución se puede calcular mediante la fórmula: Т(X) = m(X)/ V(r) donde m(X) es la masa de la sustancia, generalmente g; V(r) volumen de solución, ml. 12. Proceso de disolución La naturaleza del proceso de disolución es compleja. Naturalmente, surge la pregunta de por qué algunas sustancias son fácilmente solubles en algunos solventes y poco solubles o prácticamente insolubles en otros. La formación de soluciones siempre está asociada con ciertos procesos físicos. Uno de estos procesos es la difusión de un soluto y un solvente. Debido a la difusión, las partículas (moléculas, iones) se eliminan de la superficie de la sustancia disuelta y se distribuyen uniformemente por todo el volumen del disolvente. Por eso, en ausencia de agitación, la velocidad de disolución depende de la velocidad de difusión. Sin embargo, es imposible explicar la solubilidad desigual de las sustancias en varios solventes solo por procesos físicos. El gran químico ruso D. I. Mendeleev (1834-1907) creía que los procesos químicos juegan un papel importante en la disolución. Demostró la existencia de hidratos de ácido sulfúrico H2SO4H2OH2SO42H2OH2SO44H2O y algunas otras sustancias, por ejemplo, C2Н5OH3H2R. En estos casos, la disolución va acompañada de la formación de enlaces químicos entre las partículas del soluto y el disolvente. Este proceso se denomina solvatación, en el caso particular cuando el disolvente es agua, hidratación. Como se ha establecido, dependiendo de la naturaleza del soluto, se pueden formar solvatos (hidratos) como resultado de interacciones físicas: interacción ion-dipolo (por ejemplo, al disolver sustancias con estructura iónica (NaCl, etc.); interacción dipolo-dipolo interacción: al disolver sustancias con una estructura molecular (sustancias orgánicas)). Las interacciones químicas se llevan a cabo debido a los enlaces donante-aceptor. Aquí, los iones de soluto son aceptores de electrones y los solventes (Н2oh, nh3) - donantes de electrones (por ejemplo, la formación de complejos acuáticos), así como como resultado de la formación de enlaces de hidrógeno (por ejemplo, la disolución de alcohol en agua). Los efectos térmicos y el cambio de color que acompañan a la disolución proporcionan evidencia de la interacción química de un soluto con un solvente. Por ejemplo, cuando el hidróxido de potasio se disuelve en agua, se libera calor: KOH + xN2O \uXNUMXd KOH (N2Vaya; ΔH°solución = 55 kJ/mol. Y cuando se disuelve el cloruro de sodio, se absorbe calor: NaCI + xH2O = NaCl(H2Vaya; ΔH°solución = +3,8 kJ/mol. El calor liberado o absorbido cuando se disuelve 1 mol de una sustancia se llama calor de solución Qsolución Según la primera ley de la termodinámica Qsolución = ΔHsolución, donde ΔHsolución es el cambio de entalpía tras la disolución de una cantidad dada de una sustancia. La disolución de sulfato de cobre blanco anhidro en agua da lugar a la aparición de un color azul intenso. La formación de solvatos, cambio de color, efectos térmicos, así como una serie de otros factores, indican un cambio en la naturaleza química de los componentes de la solución durante su formación. Por lo tanto, de acuerdo con los conceptos modernos, la disolución es un proceso fisicoquímico en el que juegan un papel tanto los tipos de interacción física como química. 13. Termodinámica del proceso de disolución De acuerdo con la segunda ley de la termodinámica, en p, T = const, las sustancias pueden disolverse espontáneamente en cualquier solvente si, como resultado de este proceso, la energía de Gibbs del sistema disminuye, es decir ΔG = (ΔН - TΔS) < 0. El valor de ΔН se denomina factor de entalpía y el valor de TΔS se denomina factor de disolución de entropía. Cuando se disuelven sustancias líquidas y sólidas, la entropía del sistema suele aumentar (ΔS > 0), ya que las sustancias disueltas pasan de un estado más ordenado a otro menos ordenado. La contribución del factor de entropía, que contribuye al aumento de la solubilidad, es especialmente notable a temperaturas elevadas, porque en este caso el factor T es grande y el valor absoluto del producto TΔS también es grande, respectivamente, la disminución de Gibbs aumenta la energía. Cuando los gases se disuelven en un líquido, la entropía del sistema suele disminuir (ΔS < 0), ya que el soluto pasa de un estado menos ordenado (gran volumen) a un estado más ordenado (pequeño volumen). Una disminución de la temperatura favorece la disolución de los gases, ya que en este caso el factor T es pequeño y el valor absoluto del producto TΔS será menor, y la disminución de la energía de Gibbs será mayor cuanto menor sea el valor de T. Durante la formación de una solución, la entalpía del sistema también puede aumentar (NaCl) y disminuir (KOH). El cambio en la entalpía del proceso de disolución debe considerarse de acuerdo con la ley de Hess como la suma algebraica de las contribuciones endo y exotérmicas de todos los procesos que acompañan al proceso de disolución. Estos son los efectos endotérmicos de la destrucción de la red cristalina de sustancias, la ruptura de los enlaces de las moléculas, la destrucción de la estructura inicial del solvente y los efectos exotérmicos de la formación de varios productos de interacción, incluidos los solvatos. Para simplificar la presentación, el incremento de la entalpía de disolución ΔНsolución se puede representar como la diferencia de energía Ecr, gastado en la destrucción de la red cristalina de la sustancia disuelta, y energía Esol, liberado durante la solvatación de partículas de soluto por moléculas de solvente. En otras palabras, el cambio de entalpía es la suma algebraica del cambio de entalpía ΔHcr como resultado de la destrucción de la red cristalina y un cambio en la entalpía ΔНsol debido a la solvatación por partículas de solvente: ΔHsolución = ΔHcr + ΔHsol, donde ΔHsolución - cambio de entalpía durante la disolución. Sin embargo, la disolución de gases nobles en disolventes orgánicos suele ir acompañada de la absorción de calor, por ejemplo, helio y neón en acetona, benceno, etanol y ciclohexano. Al disolver sólidos con una estructura de cristal molecular y líquidos, los enlaces moleculares no son muy fuertes y, por lo tanto, generalmente ΔHsol > ΔNcr Esto lleva al hecho de que la disolución de, por ejemplo, alcoholes y azúcares es un proceso exotérmico (ΔHsolución <0). Al disolver sólidos con una red iónica, la relación de energía Ecr y misol Puede ser diferente. Sin embargo, en la mayoría de los casos, la energía liberada durante la solvatación de los iones no compensa la energía gastada en la destrucción de la red cristalina, por lo que el proceso de disolución es endotérmico. Por lo tanto, los datos termodinámicos permiten predecir la disolución espontánea de diversas sustancias en función de la primera y segunda leyes de la termodinámica. 14. Solubilidad Si un soluto está en contacto con un solvente, el proceso de formación de la solución en muchos casos procede espontáneamente hasta que se alcanza cierta concentración límite (se produce la saturación). Esto sucede cuando se alcanza el equilibrio, cuando los factores de entalpía y entropía son iguales, es decir, ΔН = TΔS. Por ejemplo, cuando se introducen cristales en un líquido, las moléculas o los iones pasan de la superficie del cristal a la solución. Debido a la difusión, las partículas se distribuyen uniformemente por todo el volumen del disolvente. La disolución procede a la saturación. Una solución que contiene la máxima cantidad de soluto a una temperatura dada y está en equilibrio con un exceso de soluto se llama saturada. Una solución sobresaturada es una solución cuya concentración es mayor que la de una solución saturada. Una solución con una concentración más baja que una solución saturada se llama insaturada. La capacidad de una sustancia para disolverse en un solvente particular se llama solubilidad. Numéricamente, la solubilidad de una sustancia es igual a la concentración de su solución saturada. La solubilidad se puede expresar en las mismas unidades que la concentración, por ejemplo, en términos de la cantidad de soluto contenida en 1 litro de una solución saturada, mol/l, o en términos de la masa de un soluto en 100 g de una solución saturada. . La unidad de solubilidad es gramos por 100 g de solvente. El valor correspondiente se denomina coeficiente de solubilidad. La solubilidad depende de la naturaleza del soluto y del solvente, la temperatura, la presión y la presencia de otras sustancias en la solución. Influencia en la solubilidad de la naturaleza de los componentes. La capacidad de disolución de las sustancias está determinada por la naturaleza de las fuerzas de interacción entre las moléculas de los componentes de la solución X1 a ellos2 : solvente - solvente (X1 - X1 ), soluto - soluto (X2 - X2 ), solvente - soluto (X1 - X2 ) (los puntos indican enlace molecular). La solubilidad de las sustancias varía ampliamente. Los ejemplos muestran la solubilidad de diferentes sales en el mismo solvente (agua) y la solubilidad de la misma sustancia (AgNO3 ) en varios disolventes. Las sustancias con un tipo de enlace iónico y las sustancias que consisten en moléculas polares se disuelven mejor en solventes polares, como agua, alcoholes. Estos solventes se caracterizan por una alta constante dieléctrica. La alta solubilidad de las sustancias se debe con frecuencia a la formación de enlaces intermoleculares, en particular de hidrógeno. Por lo tanto, la solubilidad mutua ilimitada del agua y el alcohol se explica por la formación de enlaces de hidrógeno entre las moléculas de agua y alcohol, y la disolución de los cristales de AgcI en una solución acuosa de amoníaco se explica por la formación de un enlace químico donante-aceptor de un iones de plata con moléculas de amoníaco (AgCI es prácticamente insoluble en agua). Por la misma razón, la piridina, un disolvente de baja permitividad, presenta una solubilidad muy alta. Dado que la solubilidad caracteriza el verdadero equilibrio, la influencia de las condiciones externas en este estado (presión, temperatura) se puede estimar cualitativamente utilizando el principio de Le Chatelier. Dichas evaluaciones son necesarias en la práctica del buceo profundo, cuando se trabaja en tiendas calientes, etc. 15. Solubilidad de gases en líquidos. Leyes de Henry-Dalton y Sechenov La disolución de gases en líquidos casi siempre va acompañada de la liberación de calor. Por tanto, la solubilidad de los gases disminuye al aumentar la temperatura según el principio de Le Chatelier. Este patrón se utiliza a menudo para eliminar los gases disueltos del agua (p. ej., CO02) mediante ebullición. A veces, la disolución de un gas va acompañada de la absorción de calor (por ejemplo, la disolución de gases nobles en algunos disolventes orgánicos). En este caso, al aumentar la temperatura aumenta la solubilidad del gas. Un gas no se disuelve en un líquido indefinidamente. A una cierta concentración de gas X, se establece un equilibrio:  Cuando un gas se disuelve en un líquido, ocurre una disminución significativa en el volumen del sistema. Por tanto, un aumento de la presión, según el principio de Le Chatelier, debería conducir a un desplazamiento del equilibrio hacia la derecha, es decir, a un aumento de la solubilidad del gas. Si el gas es ligeramente soluble en un líquido dado y la presión es baja, entonces la solubilidad del gas es proporcional a su presión. Esta dependencia se expresa mediante la ley de Henry (1803): la cantidad de gas disuelto a una temperatura dada en un determinado volumen de líquido en equilibrio es directamente proporcional a la presión del gas. La ley de Henry se puede escribir de la siguiente forma: с (X) = kr(X) ×P(X) donde es la concentración de gas en una solución saturada, mol/l; P(X) - presión de gas X sobre la solución, Pa; Kr(X) - Constante de Henry para el gas X, mol × l1 × Pa1 . La constante de Henry depende de la naturaleza del gas, el solvente y la temperatura. La ley de Henry es válida solo para soluciones relativamente diluidas, a bajas presiones y en ausencia de interacción química entre las moléculas del gas disuelto y el solvente. La ley de Henry es un caso especial de la ley general de Dalton. Si estamos hablando de la disolución no de una sustancia gaseosa, sino de una mezcla de gases, entonces la solubilidad de cada componente obedece la ley de Dalton: la solubilidad de cada uno de los componentes de la mezcla gaseosa a temperatura constante es proporcional a la presión parcial del componente sobre el líquido y no depende de la presión total de la mezcla y de la individualidad de los demás componentes. En otras palabras, en el caso de la disolución de una mezcla de gases en un líquido, la presión parcial p! este componente Se entiende por presión parcial de un componente la proporción de la presión del componente respecto a la presión total de la mezcla gaseosa: Рi/ Rcomún La presión parcial del componente se calcula mediante la fórmula Al estudiar la solubilidad de los gases en líquidos en presencia de electrolitos, el fisiólogo ruso I. M. Sechenov (1829-1905) estableció el siguiente patrón (ley de Sechenov): la solubilidad de los gases en líquidos en presencia de electrolitos disminuye; se liberan gases. Рi = Pcomún ×(Xi) donde pi - presión parcial del componente Xi; Рcomún presión total de la mezcla de gases; x(Xi) es la fracción molar del i-ésimo componente. Al estudiar la solubilidad de los gases en líquidos en presencia de electrolitos, el fisiólogo ruso I. M. Sechenov (1829-1905) estableció el siguiente patrón (ley de Sechenov): la solubilidad de los gases en líquidos en presencia de electrolitos disminuye; se liberan gases. 16. El papel de la difusión en los procesos de transferencia de sustancias en los sistemas biológicos. La difusión juega un papel importante en los sistemas biológicos. En primer lugar, el movimiento de nutrientes y productos metabólicos en los fluidos tisulares se produce por difusión. Además, en muchos casos, la velocidad de los procesos fisicoquímicos en los organismos vivos está determinada por la velocidad de difusión de los reactivos, ya que la difusión de los reactivos suele ser la etapa más lenta del proceso, mientras que las reacciones bioquímicas que involucran enzimas son muy rápidas. Cada célula viva está rodeada por una membrana que sirve para proteger y regular el entorno intracelular. Las sustancias pasan a través de las membranas por dos mecanismos principales: por difusión ordinaria (transporte pasivo) y por transferencia activada energéticamente (transporte activo). La capa interna de la membrana consiste en cadenas de hidrocarburos. Por lo tanto, muchas moléculas neutras pequeñas y moléculas HMS no polares son solubles en esta capa y pueden atravesar la membrana por difusión normal a lo largo de un gradiente de concentración. Tal transporte de sustancias se llama pasivo. La difusión juega un papel importante en el proceso de oxigenación de la sangre en los pulmones. Debido a la gran ramificación, la superficie de los alvéolos de los pulmones es grande (~ 80 m2), por lo que el oxígeno se disuelve activamente en el plasma y entra en los eritrocitos. La sangre venosa se agota en oxígeno: la concentración de oxígeno en la sangre venosa tiende a cero. Por lo tanto, el gradiente de concentración de oxígeno entre la atmósfera y la sangre que ingresa a los pulmones es alto, lo que resulta en una captación activa (según la ley de Fick). El movimiento de sustancias desde un área de menor concentración a un área de mayor concentración en contra de un gradiente se denomina transporte activo. Tal proceso no puede proceder espontáneamente y requiere costos de energía. La fuente de energía es la reacción de hidrólisis exergónica de un compuesto bioinorgánico: el trifosfato de adenosina (ATP). Se logra una distribución estacionaria estable de las concentraciones de iones K dentro y fuera de la célula cuando el flujo de iones K a través de la membrana hacia la célula se vuelve igual al flujo de iones K desde la célula debido a la difusión pasiva. La distribución (homeostasis de iones) se logra de manera similar para los iones de Na, solo el transporte activo y la difusión pasiva compensatoria de iones se dirigen en dirección opuesta a los flujos correspondientes de iones de K. El proceso de difusión es ampliamente utilizado en medicina. Por ejemplo, el método de diálisis basado en la selectividad de difusión de sustancias de bajo peso molecular a través de una membrana semipermeable a lo largo de un gradiente de concentración se utiliza en la práctica clínica para crear un aparato de "riñón artificial". Las partículas del DIU no pasan a través de una membrana semipermeable, por lo que los fluidos biológicos (por ejemplo, plasma sanguíneo) pueden purificarse mediante diálisis de sustancias nocivas de bajo peso molecular: "escorias" (urea, ácido úrico, bilirrubina, aminas, exceso de iones K) que acumularse en diversas enfermedades. Durante la purificación, la sangre del paciente, extraída de la vena, ingresa a cámaras especiales con membranas semipermeables, a través de las cuales el NMS puede difundirse y eliminarse del plasma. En una serie de enfermedades inflamatorias, se produce la destrucción de proteínas y en el plasma sanguíneo, junto con el SNM, hay fragmentos de proteínas (péptidos y polipéptidos) que también deben eliminarse. 17. Disminución del punto de congelación y aumento del punto de ebullición de las soluciones. Una consecuencia directa de la disminución de la presión de vapor sobre la solución es un cambio en el punto de congelación ΔTз y punto de ebullición de las soluciones ΔТк en comparación con los valores de estas cantidades para un disolvente puro. Las relaciones entre estas cantidades también se derivan de la segunda ley de la termodinámica. El punto de ebullición de un líquido es la temperatura a la que su presión de vapor se iguala a la presión externa (por ejemplo, a 101,3 kPa, el punto de ebullición del agua es de 100 °C). El punto de congelación (cristalización) de un líquido es la temperatura a la cual la presión de vapor sobre el líquido es igual a la presión de vapor sobre la fase sólida. Si designamos los puntos de congelación y ebullición de la solución T3 y Tk, y los mismos valores para el solvente T°3 y T°к , entonces obtenemos: ΔTk = Tк - T°к > 0, ΔT3 = T°3 - T3 > 0. Los efectos de aumentar el punto de ebullición y reducir el punto de congelación de las soluciones se pueden explicar cualitativamente utilizando el principio de Le Chatelier. En efecto, si en un sistema de equilibrio "líquido - vapor" (por ejemplo, H2О(W) -H2О(G)), introduzca una sustancia no volátil soluble, luego la presión de vapor del solvente sobre la solución disminuirá. Para compensar la disminución de la presión de vapor y lograr el estado de equilibrio anterior, la solución debe calentarse a una temperatura más alta (más de 373°K), ya que el proceso es endotérmico. Sea un sistema de equilibrio "fase sólida - líquida", por ejemplo H2О(T) > H2О(W), a 273°K. Si una cierta cantidad de una sustancia no volátil (insoluble en la fase sólida) se disuelve en la fase líquida, la concentración de moléculas de agua en la fase líquida disminuirá. De acuerdo con el principio de Le Chatelier, comenzará un proceso para aumentar la cantidad de agua en la fase líquida: el derretimiento del hielo. Para establecer un nuevo equilibrio, se debe enfriar la solución, es decir, se debe bajar la temperatura, ya que el proceso es exotérmico. Según la ley de Raoult para soluciones diluidas, la disminución de la presión de vapor es proporcional a la concentración de la solución. Por lo tanto, el aumento del punto de ebullición y la disminución del punto de congelación de tales soluciones deberían aumentar al aumentar su concentración. Estudiando la congelación y ebullición de soluciones, Raúl encontró: un aumento en el punto de ebullición ΔTк y bajando el punto de congelación ΔT3 soluciones diluidas de no electrolitos es directamente proporcional a la concentración molar de la solución: ΔTк =Kэb(X), ΔT3 = kз b(X), donde b(X) - concentración molar, mol/kg; Кз y Kэ - coeficientes de proporcionalidad, kg × K × mol1 , que se denominan constantes ebulliométricas y criométricas, respectivamente. El significado físico de las constantes Kэ y Kз queda claro si aceptamos b(X) = 1. Entonces Kэ = ΔTк y kз = ΔTз . En otras palabras, la constante ebulliométrica es numéricamente igual al aumento en el punto de ebullición de una solución de un molar, y la constante criométrica es numéricamente igual a la disminución en el punto de congelación de una solución de un molar. Las constantes ebuliométricas y criométricas dependen únicamente de la naturaleza del solvente y no dependen de la naturaleza del soluto (soluciones ideales). 18. Presión osmótica La ósmosis es la penetración predominantemente unilateral de moléculas de solvente (difusión) a través de una membrana semipermeable de un solvente a una solución o de una solución con una concentración más baja a una solución con una concentración más alta. Una condición necesaria para que ocurra la ósmosis es la presencia de un solvente y una solución o dos soluciones de diferentes concentraciones, separadas por una membrana semipermeable. Desde el punto de vista de la termodinámica, la fuerza motriz de la ósmosis es la tendencia del sistema a igualar concentraciones, ya que en este caso la entropía del sistema aumenta, ya que el sistema pasa a un estado menos ordenado, la energía de Gibbs del sistema disminuye en consecuencia, y los potenciales químicos se igualan. Por lo tanto, la ósmosis es un proceso espontáneo. Un experimento simple puede servir como ilustración que explica la conexión entre el mecanismo de ósmosis y un cambio en la presión de vapor sobre una solución. Si un vaso con un solvente puro y un vaso con una solución de alguna sustancia no volátil (los niveles de líquidos en los recipientes son los mismos) se colocan en un recipiente de vidrio cerrado, luego de un rato el nivel del líquido en el el primer vaso disminuirá y el nivel de la solución en el segundo vaso aumentará. En este caso, el disolvente pasa del primer vaso al segundo vaso, lo que se debe (según la ley de Raoult) a una menor presión de vapor del disolvente sobre la solución que sobre el disolvente puro. Así, el espacio de aire entre el solvente y la solución actúa como una membrana semipermeable. Llenemos un recipiente de paredes semipermeables con una solución acuosa de glucosa y colóquelo en otro recipiente con agua para que coincidan los niveles de los líquidos en estos recipientes. Como resultado de la ósmosis, el volumen de la solución en el primer recipiente aumenta y el nivel del líquido en este recipiente aumenta gradualmente. Esto crea una presión hidrostática adicional que evita la ósmosis. La presión hidrostática de la columna de líquido en equilibrio osmótico determina la presión osmótica de la solución. Presión osmótica es el valor medido por la presión hidráulica mínima que debe aplicarse a la solución para detener la ósmosis. Leyes de la presión osmótica. Van't Hoff propuso una ecuación empírica para calcular la presión osmótica de soluciones diluidas de no electrolitos: π = C(X)RT, donde π - presión osmótica, kPa; С(X) - concentración molar, mol/l; R es la constante universal de los gases igual a 8,31 kPa-l/(mol-K); T - temperatura absoluta, K. Aunque la ley de van't Hoff se estableció sobre la base de datos experimentales, se puede derivar de las condiciones de equilibrio termodinámico en ΔG = 0. Por lo tanto, esta ley debe considerarse como una consecuencia de la segunda ley de la termodinámica. La expresión en la forma anterior es similar a la ecuación de Clapeyron-Mendeleev para gases ideales, sin embargo, estas ecuaciones describen procesos diferentes. 19. El papel de la ósmosis y la presión osmótica en los sistemas biológicos El fenómeno de la ósmosis juega un papel importante en muchos sistemas químicos y biológicos. La ósmosis regula el flujo de agua hacia las células y las estructuras intercelulares. La elasticidad de las células (turgencia), que asegura la elasticidad de los tejidos y la conservación de una determinada forma de los órganos, se debe a la presión osmótica. Las células animales y vegetales tienen caparazones o una capa superficial de protoplasma que tiene las propiedades de las membranas semipermeables. Cuando estas células se colocan en soluciones con diferentes concentraciones, se observa ósmosis. Las soluciones que tienen la misma presión osmótica se llaman isotónicas. Si dos soluciones tienen presión osmótica diferente, entonces la solución con presión osmótica alta es hipertónica con respecto a la segunda y la segunda es hipotónica con respecto a la primera. Cuando las células se colocan en una solución isotónica, conservan su tamaño y funcionan normalmente. Cuando las células se colocan en una solución hipotónica, el agua de una solución externa menos concentrada pasa a las células, lo que provoca su hinchazón y luego la ruptura de las membranas y la salida del contenido celular. Esta destrucción de células se denomina lisis, en el caso de los glóbulos rojos este proceso se denomina hemólisis. La sangre con contenido celular que sale durante la hemólisis se llama sangre de barniz debido a su color. Cuando las células se colocan en una solución hipertónica, el agua deja las células en una solución más concentrada y se observa el arrugamiento (secado) de las células. Este fenómeno se denomina plasmólisis. Los fluidos biológicos humanos (sangre, linfa, fluidos tisulares) son soluciones acuosas de compuestos de bajo peso molecular: NaCl, KCl, CaCl, compuestos de alto peso molecular: proteínas, polisacáridos, ácidos nucleicos y elementos formes: eritrocitos, leucocitos, plaquetas. Su acción total determina la presión osmótica de los fluidos biológicos. La presión osmótica de la sangre humana a 310°K (37°C) es de 780 kPa (7,7 atm). La misma presión se crea con una solución acuosa de NaCl al 0,9 % (0,15 mol/l), que, por lo tanto, es isotónica con la sangre (solución salina). Sin embargo, además de los iones Na y C1, existen otros iones en la sangre, así como los DIU y los elementos formes. Por tanto, para fines médicos, es más correcto utilizar soluciones que contengan los mismos componentes y en la misma cantidad que las que componen la sangre. Estas soluciones se utilizan como sustitutos de la sangre en cirugía. El cuerpo humano, además de la presión osmótica, se caracteriza por la constancia (homeostasis) y otros indicadores fisicoquímicos de la sangre, como la acidez. Las fluctuaciones permisibles en la presión osmótica de la sangre son muy pequeñas e incluso en patologías graves no superan varias decenas de kPa. En varios procedimientos, solo se pueden inyectar soluciones isotónicas en la sangre de humanos y animales en grandes cantidades. Con grandes pérdidas de sangre (por ejemplo, después de operaciones importantes, lesiones), a los pacientes se les inyectan varios litros de solución isotónica para compensar la pérdida de líquido con sangre. El fenómeno de la ósmosis es ampliamente utilizado en la práctica médica. Así, en cirugía se utilizan apósitos hipertónicos (gasas empapadas en una solución hipertónica de NaCl al 10%), que se inyectan en heridas purulentas. De acuerdo con la ley de ósmosis, la corriente del líquido de la herida a través de la gasa se dirige hacia afuera, como resultado de lo cual la herida se limpia constantemente de pus, microorganismos y productos de descomposición. 20. Grado de disociación (ionización). La fuerza de los electrolitos Los electrolitos que se disocian casi por completo en iones (se ionizan) se denominan electrolitos fuertes, y los electrolitos que no están completamente ionizados se denominan electrolitos débiles. En una solución de electrolitos débiles, junto con los iones, hay moléculas no ionizadas. Fue por ionización incompleta que S. Arrhenius explicó por qué el coeficiente isotónico de soluciones de electrolitos débiles no es igual a un número entero. Para caracterizar cuantitativamente la completitud de la disociación, se introduce el concepto del grado de disociación (ionización). El grado de disociación (ionización) de un electrolito es la relación entre el número de moléculas descompuestas en iones y el número total de moléculas introducidas en la solución. En otras palabras, an es la proporción de moléculas de electrolito descompuestas en iones. El grado de disociación an se expresa en porcentaje o fracciones de una unidad: αн = Nн/ np, donde N es el número de moléculas de electrolito descompuestas en iones; Np el número de moléculas de electrolito introducidas en la solución (disueltas). Entonces para C(CHXNUMXCOOH) = 0,1 mol/l, grado de disociación αн = 0,013 (o 1,3%). Según el grado de disociación, los electrolitos se dividen convencionalmente en fuertes (αн > 30%) y débil (αн <3%). En el intervalo, los electrolitos se consideran de fuerza media. Casi todas las sales se consideran electrolitos fuertes. De los ácidos y bases más importantes, H2SO4 , HCI, HBr, HI, HNO3 , NaOH, KOH, Ba(OH)2 . Los electrolitos débiles incluyen la mayoría de los ácidos orgánicos, así como algunos compuestos inorgánicos - H2S, HCN, N2CON3 , ASI QUE3 , HCl0, N2EN3VO3 ,Hg2CI2 ,Fe(SCN)3 . An se determina experimentalmente midiendo la desviación de las propiedades colativas de las soluciones electrolíticas de las dependencias teóricas de las soluciones ideales. Por ejemplo, el coeficiente isotónico i se determina por el método crioscópico, luego se calcula el grado de disociación.Para electrolitos fuertes, el grado de disociación es evidente, ya que se disocian en iones casi por completo. La desviación del coeficiente isotónico i del conocimiento entero se explica para ellos no por la presencia de moléculas no asociadas en la solución, sino por otras razones. La disociación va acompañada de la liberación o absorción de calor. Por lo tanto, el grado de disociación debe depender de la temperatura. La influencia de la temperatura se puede estimar según el principio de Le Chatelier. Si la disociación electrolítica procede con la absorción de calor, entonces al aumentar la temperatura, an aumenta, si con la liberación de calor, an disminuye. El grado de disociación electrolítica se ve afectado por la concentración de la solución. Cuando la solución se diluye, el grado de disociación aumenta significativamente. En este sentido, la clasificación indicada de la fuerza de los electrolitos según el grado de disociación αн válido sólo para soluciones con una concentración de alrededor de 0,1 mol/l. Si consideramos la disociación electrolítica como un proceso reversible en equilibrio, entonces, de acuerdo con el principio de Le Chatelier, la dilución con agua aumenta el número de moléculas destiladas, es decir, aumenta el grado de disociación. El grado de disociación de electrolitos débiles también se ve afectado por la adición de iones del mismo nombre. Por lo tanto, la introducción de un electrolito débil en el sistema de equilibrio aumenta la concentración de iones, lo que, de acuerdo con el principio de Le Chatelier, conduce a un desplazamiento significativo del equilibrio de disociación hacia la izquierda, es decir, una disminución en el grado de disociación. . Así, la adición de iones del mismo nombre a una solución electrolítica débil reduce el grado de su disociación. 21. Constante de disociación. Ley de cría de Ostwald. Teoría de soluciones de electrolitos fuertes. Cuantitativamente, la disociación electrolítica como un proceso reversible de equilibrio se puede caracterizar por una constante de disociación (ionización) determinada por la ley de acción de masas. La ley de acción de masas, estrictamente hablando, se aplica a reacciones reversibles, es decir, a soluciones de electrolitos débiles. Por ejemplo, la disociación del electrolito KtnAnm se puede representar como un proceso de equilibrio: Ktn Anm × nKtm+ +mAn . De acuerdo con la ley de acción de masas, la constante de equilibrio se escribe de la siguiente manera: КД = (ktm+)n+(Unn)m + (ktnAnm) donde (Ktm+) y unn ) - concentraciones de equilibrio molar de iones electrolitos; (ktnAnm) es la concentración de equilibrio molar de moléculas de electrolito no disociadas; КД es la constante de equilibrio, llamada constante de disociación. Esta ecuación es válida solo para soluciones diluidas de electrolitos débiles. Cuando se aplica a soluciones concentradas ya soluciones de electrolitos fuertes, la ecuación debe modificarse. Cuanto mayor sea la constante de disociación KД , más se disocia el electrolito. A diferencia del grado de disociación KД depende solo de la naturaleza del solvente, del electrolito y de la temperatura, pero no depende de la concentración de la solución. Así, tanto la constante como el grado de disociación electrolítica son características cuantitativas de la disociación. Naturalmente, hay una conexión entre ellos. Los ácidos polibásicos y las bases poliácidas se disocian en pasos. Por ejemplo, la disociación del ácido fosfórico ocurre en tres pasos:  De manera similar para las bases poliácidas (por ejemplo, Ca (OH)2) - la disociación tiene lugar en dos etapas. La disociación por etapas se caracteriza por el hecho de que la descomposición del electrolito en cada etapa subsiguiente ocurre en menor medida que en la anterior. Tal cambio en las constantes de disociación puede explicarse por la atracción electrostática sobre la base de la ley de Coulomb. La energía de ionización es mínima cuando un ion se separa de una molécula de electrolito neutro. El desprendimiento de un ion en cada paso siguiente de la disociación requiere una energía creciente, ya que la eliminación de un ion se produce a partir de una partícula cuya carga aumenta en los pasos siguientes. La disociación casi completa de electrolitos fuertes en iones, independientemente de la concentración de sus soluciones, se confirma mediante métodos de investigación físicos y fisicoquímicos. Así, los valores del calor de neutralización de todos los ácidos fuertes por bases fuertes en soluciones diluidas son casi los mismos. Independientemente de la naturaleza del ácido y la base, se obtiene el mismo valor de AH = 56,5 kJ/mol. Este hecho es una prueba clara de la completa disociación de soluciones diluidas de ácidos y bases. En todos los casos, el proceso común que ocurre durante la neutralización es la combinación de iones en un mol 22. Teoría de ácidos y bases Muchos electrolitos, en particular hidróxidos de varios elementos E, exhiben propiedades de ácidos o bases. La disociación del hidróxido de EON puede proceder de dos tipos: 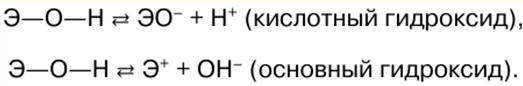 La brecha puede ocurrir a lo largo de ambos enlaces del grupo. EÓN. Como se sabe, la polaridad y la fuerza de los enlaces dependen de la diferencia en la electronegatividad de los elementos, el tamaño y la carga efectiva de los átomos. Si la energía de ruptura del enlace O-H es mucho menor que la energía de ruptura del enlace E-O, entonces la disociación del hidróxido procede de acuerdo con el tipo de ácido. Si, por el contrario, la energía de ruptura del enlace O-H es mucho mayor que la energía de ruptura del enlace E-O, entonces la disociación procede según el tipo principal. En los hidróxidos de metales alcalinos y alcalinotérreos, así como en los metales de transición en bajos estados de oxidación, la fuerza del enlace E-O es relativamente baja, el oxígeno está más fuertemente unido al hidrógeno y la disociación E-O-H procede principalmente de acuerdo con el tipo básico, es decir, con la eliminación de hidróxido diona. Esto se debe al hecho de que los iones de dichos elementos son bastante grandes y tienen una carga efectiva pequeña, es decir, tienen una capacidad de polarización débil. Con un aumento en el grado de oxidación, aumenta el efecto polarizador del átomo E (un aumento en la carga específica), el oxígeno se une más firmemente al elemento E y la disociación de E-O-H procede principalmente en el tipo ácido, es decir, el ion de hidrógeno se separa. Este último está relacionado con la redistribución de la densidad electrónica en el átomo de oxígeno. Como resultado, el enlace E-O se vuelve más fuerte y el enlace O-H se vuelve más débil. Actualmente, no existe una definición inequívoca de los conceptos de ácido y base, que podrían usarse igualmente para caracterizar las interacciones ácido-base en cualquier solvente. Para caracterizar muchos electrolitos en soluciones acuosas, todavía es posible utilizar los conceptos de ácido y base dados por Arrhenius: 1) un ácido es un electrolito que se disocia en soluciones para formar iones de hidrógeno H; 2) la base es un electrolito que se disocia en soluciones con la formación de iones de hidróxido de OH; 3) el anfolito (hidróxido anfótero) es un electrolito que se disocia en solución para formar iones de hidrógeno e iones de hidróxido. Los anfolitos incluyen hidróxidos de zinc, aluminio, cromo y otros elementos anfóteros, así como aminoácidos, proteínas y ácidos nucleicos. La aplicación del principio de Le Chatelier a la cadena de equilibrios ácido-base muestra que a medida que aumenta la concentración de iones hidróxido de OH en el sistema, aumenta la probabilidad de disociación de tipo ácido. Un aumento en la concentración de iones de hidrógeno H+ en el sistema conduce a una disociación predominante según el tipo principal. Esto significa que en un ambiente ácido, la anfolita exhibe un carácter básico, y en un ambiente alcalino exhibe un carácter ácido. Por ejemplo, el hidróxido de zinc se comporta como una base cuando interactúa con ácidos: Zn (OH)2 + 2HCl - ZnCI2 + 2Н2Oh y cuando interactúa con álcalis, como un ácido: Zn(OH)2+ 2NaOH → Na2[Zn(OH)4]. 23. Sistemas tampón sanguíneos Plasma sanguíneo Los sistemas amortiguadores son de gran importancia para mantener el equilibrio ácido-base de los organismos. Los fluidos intracelulares y extracelulares de todos los organismos vivos se caracterizan por un valor de pH constante, que se mantiene con la ayuda de sistemas tampón. El valor de pH de la mayoría de los fluidos intracelulares está en el rango de 6,8 a 7,8. El equilibrio ácido-base del equilibrio KO en la sangre humana lo proporcionan los sistemas tampón de carbonato de hidrógeno, fosfato y proteínas. El valor de pH normal del plasma sanguíneo es de 7,40 ± 0. Esto corresponde al rango de valores de acidez activa de 05 a 3,7x4,0 mol/l. Dado que hay varios electrolitos en la sangre (HC1083 , H2CO3 H2RO4 , NRO42 ), proteínas, aminoácidos, lo que significa que se disocian a tal punto que la actividad de un (H+) está en el rango indicado. Debido a que el contenido de sustancias inorgánicas y orgánicas en el plasma y las células sanguíneas no es el mismo, es recomendable considerar estos componentes de la sangre por separado. Plasma sanguíneo Sistema tampón HCO3 / N2CON3 se compone de ácido carbónico2CON3 y base conjugada HCO3 . Es el sistema amortiguador más importante de la sangre. Uno de los componentes es el ácido carbónico H2CON3 - formado por la interacción del CO disuelto en el plasma2 con agua: CON2(r) + N2él N2CON3. donde CO2(r) - concentración de CO disuelto2 . La constante de equilibrio de esta reacción es: K = [N2CON3] / [CO2] Entre OC2 en los alvéolos y el tampón de carbonato de hidrógeno en el plasma sanguíneo que fluye a través de los capilares de los pulmones, se establece una cadena de equilibrios. El sistema tampón de carbonato de hidrógeno actúa como un tampón fisiológico efectivo cerca de un pH de 7,4. Al entrar en la sangre de ácidos - donantes de H+ el equilibrio en la cadena según el principio de Le Chatelier se desplaza hacia la izquierda como resultado del hecho de que los iones HCO3 unen iones de H en moléculas de H2CON3 . Al mismo tiempo, la concentración de H2CON3 aumenta, y la concentración de iones HCO3 baja. Aumentar la concentración de H2CON3 conduce a un desplazamiento del equilibrio hacia la izquierda (principio de Le Chatelier). Provoca decadencia2CON3 y un aumento en la concentración de CO2 disuelto en plasma. Como resultado, el equilibrio se desplaza hacia la izquierda y la presión de CO aumenta.2 en los pulmones Exceso de CO2 excretado del cuerpo. Como resultado, el sistema de hidrogenocarbonato de la sangre se equilibra rápidamente con el CO2 en los alvéolos y mantiene eficazmente la constancia del pH del plasma sanguíneo. 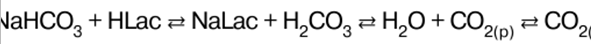 Por lo tanto, se mantiene un valor de pH sanguíneo normal con un cambio de pH ligeramente pronunciado debido a la acidosis. En espacios cerrados, a menudo experimentan asfixia (falta de oxígeno), aumento de la respiración. Sin embargo, la asfixia se asocia no tanto a la falta de oxígeno, sino a un exceso de CO2. Exceso de CO2 en la atmósfera, de acuerdo con la ley de Henry, conduce a una disolución adicional de CO2 en sangre. Y esto conduce a una disminución del pH de la sangre, es decir, a la acidosis. El sistema amortiguador de hidrogenocarbonato responde más rápidamente a los cambios en el pH de la sangre. Su capacidad amortiguadora de ácido es Vк \u40d XNUMX mmol / l de plasma sanguíneo, y la capacidad amortiguadora para el álcali es mucho menor y es aproximadamente igual a Vщ = 1-2 mmol/l de plasma sanguíneo. 24. Reacciones de neutralización Las reacciones de neutralización se denominan reacciones de intercambio de la interacción de ácidos y bases, como resultado de lo cual se forman sal y agua. Considere diferentes tipos de reacciones de neutralización. 1. Neutralización de una base fuerte con un ácido fuerte: KOH + HNO3 - NO3 + N2O. La ecuación iónica molecular para tal reacción H+ + OH → H2O y el valor negativo de la energía de Gibbs ΔG° muestran que el equilibrio está prácticamente desplazado hacia la formación de agua. Un caso común de una reacción de neutralización es la interacción de ácidos y bases que difieren en fuerza (el grado de disociación). Estas reacciones no se completan debido a la reacción inversa de la hidrólisis de la sal. 2. Neutralización de un ácido débil con una base fuerte:  o en forma molecular:  En este caso, la reacción de neutralización es reversible. La reacción de neutralización de una base débil con un ácido fuerte también es reversible:  o en forma molecular: 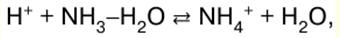 y también - una base débil con un ácido débil: 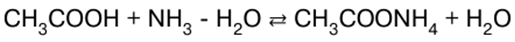 o en forma molecular:  En estos sistemas, el equilibrio está fuertemente desplazado hacia la derecha, ya que el agua es un electrolito mucho más débil que el ácido cianhídrico, el amoníaco y el ácido acético. Las reacciones de neutralización forman la base del método de neutralización. Este método se utiliza en laboratorios clínicos para determinar la acidez del jugo gástrico, la capacidad amortiguadora del plasma sanguíneo. En farmacología, se utiliza para el análisis cuantitativo de ácidos inorgánicos (clorhídrico, sulfúrico, bórico) y orgánicos (acético, benzoico, tartárico, cítrico, salicílico). En estudios biofarmacéuticos, el pKa de los ácidos y el pKa de las bases se determinan por neutralización, ya que el valor de estos valores puede predecir la capacidad de los fármacos para atravesar las membranas biológicas. La titulación ácido-base se utiliza para determinar el pKа aminoácidos y pKа grupos disociados en proteínas. Las curvas de titulación de proteínas obtenidas a dos temperaturas diferentes se pueden utilizar para determinar el número de grupos carboxilo, imidazol y otros. La titulación de aminoácidos y proteínas permite determinar sus puntos isoeléctricos. La hidrólisis es la descomposición de una sustancia por el agua. Los compuestos químicos de varias clases pueden sufrir hidrólisis: proteínas, grasas, carbohidratos, ésteres, sales, etc. En química inorgánica, se encuentran con mayor frecuencia en la hidrólisis de sales. 25. Hidrólisis de sal Hidrólisis de sal - esta es la interacción de la sal con las moléculas de agua, lo que lleva a la formación de compuestos de baja disociación. El proceso de hidrólisis consiste en la transición de un protón de una molécula de agua a un ion dado (CO32 + HOH * HCO3+ OH ) o de un ion dado, incluso de un catión de metal hidratado, a una molécula de agua. Según la naturaleza de la sal, el agua actúa como ácido o como base, y la sal es, respectivamente, la base conjugada o el ácido conjugado. Son posibles cuatro variantes de hidrólisis según el tipo de sal. 1. Sales formadas por un ácido fuerte y una base débil:  2. Sales formadas por una base fuerte y un ácido débil: CH3COONa + HOH → CH3COOH + NaOH. 3. Sales formadas por un ácido débil y una base débil. El cianuro de amonio se hidroliza por la reacción: 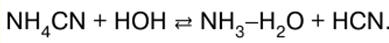 4. Sales formadas por un ácido fuerte y una base fuerte. NaCl, KNO3 no sufren hidrólisis. El mecanismo de hidrólisis de la sal consiste en la interacción de polarización de los iones de sal con su capa de hidratación. Cuanto más fuerte es esta interacción, más intensa es la hidrólisis. Todos los casos considerados de hidrólisis se referían a sales formadas por bases monoácidas y ácidos monobásicos. Las sales de ácidos polibásicos y bases de poliácidos se hidrolizan por etapas, formando sales ácidas y básicas. Cuantitativamente, la hidrólisis como equilibrio de CO se caracteriza por el grado de hidrólisis y la constante de hidrólisis. El grado de hidrólisis se mide por la relación entre la cantidad de sustancia hidrolizada y la cantidad total de soluto. El grado de hidrólisis depende de la naturaleza de la sal, su concentración y temperatura. De acuerdo con la ley de acción de masas, el grado de hidrólisis aumenta con la dilución de la solución. Entonces, a una concentración Na2CO3 0,001 mol/l, el grado de hidrólisis es del 34%. En el caso general, las siguientes regularidades son verdaderas. 1. La hidrólisis de la sal debe aumentar con el aumento de la temperatura y la dilución de la solución. 2. Con hidrólisis reversible, de acuerdo con el principio de Le Chatelier, el proceso debe ser suprimido por acidificación (si esta sal está formada por un ácido fuerte y una base débil, los iones H se acumulan) o por alcalinización (si la sal está formada por un ácido débil y una base fuerte, se acumulan iones OH). 3. La hidrólisis de sales, como resultado de lo cual se forman productos gaseosos o poco solubles, que se eliminan de la esfera de reacción (el principio del cambio de equilibrio), es irreversible. Por ejemplo, la hidrólisis de Pb(SO4)2 procede enteramente debido a la formación de un precipitado de PbO2: Pb(ASI QUE4)2 + 2Н2O→PbO2 + 2H2SO4. La hidrólisis es característica de muchas clases de compuestos inorgánicos y orgánicos. La hidrólisis de compuestos inorgánicos es importante para evaluar su toxicidad. La hidrólisis de compuestos orgánicos se usa para obtener productos valiosos a partir de madera, grasas, ésteres y otras cosas, pero la hidrólisis juega un papel particularmente importante en la vida de los organismos vivos. 26. Precipitación y reacción de disolución Las reacciones de intercambio que ocurren en la solución electrolítica incluyen las reacciones de precipitación y disolución. Las reacciones de precipitación van acompañadas de precipitación. Las reacciones acompañadas de la disolución de precipitados se denominan reacciones de disolución. Los sistemas que consisten en un depósito de un electrolito escasamente soluble y una solución saturada encima son ampliamente utilizados. En tales sistemas, se establece un equilibrio dinámico entre la solución saturada y el precipitado. Debido a la baja solubilidad, la concentración del electrolito escasamente soluble en la solución es muy baja, por lo que se puede considerar que está completamente disociado en la solución. En otras palabras, el equilibrio dinámico en una solución saturada se establece entre la fase sólida de la sustancia y los iones que han pasado a la solución. Por ejemplo, en una solución saturada de AgCl, se produce el siguiente equilibrio: AgCl(T) → Ag+(P) + Cl(R). La concentración de la fase sólida AgCl como valor constante se excluye de la expresión de la constante de equilibrio. Como resultado, la constante de equilibrio está determinada únicamente por el producto de las concentraciones de iones en la solución y se denomina constante o producto de solubilidad. En el caso general, para el electrolito Ktn Anm, la constante de solubilidad está determinada por el producto estequiométrico de las concentraciones de iones: Кпр= [ktm+ ]n[Unn]m Este valor caracteriza la solubilidad del electrolito a temperatura constante en ausencia de sustancias extrañas. k constanciaпр no significa la constancia de las concentraciones de iones individuales en solución. Por lo tanto, es posible aumentar la concentración de iones Ag en una solución saturada de AgCl agregando, por ejemplo, AgNO3 , mientras que el equilibrio según el principio de Le Chatelier se desplazará hacia la izquierda, lo que conducirá a un aumento en la tasa de depósito de iones. Después de algún tiempo, las velocidades de disolución de AgCl y la precipitación de iones Ag y Cl se igualarán. El equilibrio recién establecido se caracterizará, como antes, por el valor Kпр(AgCl), pero las concentraciones de equilibrio de los iones Ag y Cl cambiarán. Por lo tanto, con base en Kпр es posible predecir la formación y disolución de precipitados electrolíticos en base a dos reglas. 1. El electrolito precipita cuando el producto estequiométrico de las concentraciones de sus iones en solución es mayor que la constante de solubilidad. 2. El precipitado de electrolito se disuelve cuando el producto estequiométrico de las concentraciones de sus iones constituyentes en solución se vuelve menor que la constante de solubilidad. Las reacciones de precipitación forman la base del método de precipitación utilizado en el análisis cuantitativo de productos farmacéuticos. El método de precipitación se utiliza en el análisis clínico de cloruros en orina, jugo gástrico, sangre, en la práctica sanitaria e higiénica, en el análisis de agua potable. Los científicos creen que la diferente solubilidad de los compuestos naturales de los elementos en el agua tuvo una gran influencia en su contenido en los organismos vivos. Existe una estrecha relación entre la solubilidad de los compuestos en agua y el efecto tóxico de los iones de varios elementos. Por ejemplo, la introducción de Al3 + en el cuerpo debido a la formación de fosfato de aluminio AlPO4 poco soluble 27. Reacciones redox Uno de los conceptos básicos de la química inorgánica es el concepto de estado de oxidación (CO). El estado de oxidación de un elemento en un compuesto es la carga formal del átomo del elemento, calculada a partir de la suposición de que los electrones de valencia pasan a átomos con una electronegatividad relativa (REO) más alta y todos los enlaces en la molécula del compuesto son iónicos. El estado de oxidación del elemento E se indica en la parte superior sobre el símbolo del elemento con un signo "+" o "-" antes del número. El grado de oxidación de los iones que realmente existen en una solución o cristales coincide con su número de carga y se indica de manera similar con el signo "+" o "-" después del número, por ejemplo, Cl,California2+. El método de Stock también se utiliza para indicar el grado de oxidación en números romanos después del símbolo del elemento: Mn (VII), Fe (III). La cuestión del signo del estado de oxidación de los átomos en una molécula se resuelve sobre la base de una comparación de las electronegatividades de los átomos interconectados que forman la molécula. En este caso, un átomo con una electronegatividad más baja tiene un estado de oxidación positivo y con una electronegatividad más alta, uno negativo. Cabe señalar que el estado de oxidación no se puede identificar con la valencia del elemento. La valencia, definida como el número de enlaces químicos por los cuales un átomo dado está conectado a otros átomos, no puede ser cero y no tiene un signo "+" o "-". El estado de oxidación puede tener valores tanto positivos como negativos, así como cero e incluso valores fraccionarios. Por ejemplo, en una molécula de CO2 el estado de oxidación de C es +4, y en la molécula de CH4 el estado de oxidación del C es 4. La valencia del carbono4a en ambos compuestos es IV. A pesar de las desventajas anteriores, el uso del concepto de grado de oxidación es conveniente en la clasificación de compuestos químicos y la formulación de ecuaciones para reacciones redox. Cuando un elemento se oxida, el estado de oxidación aumenta, es decir, el agente reductor durante la reacción aumenta el estado de oxidación. Por el contrario, cuando el elemento se reduce, el estado de oxidación disminuye, es decir, durante la reacción, el agente oxidante reduce el estado de oxidación. Por lo tanto, es posible dar la siguiente formulación de reacciones redox: las reacciones redox son reacciones que ocurren con un cambio en el estado de oxidación de los átomos de los elementos que componen las sustancias que reaccionan. 28. Agentes oxidantes y reductores Para predecir los productos y la dirección de las reacciones redox, es útil recordar que los agentes oxidantes típicos son sustancias simples cuyos átomos tienen un EER grande > 3,0 (elementos de los grupos VIA y VIIA). De estos, los agentes oxidantes más potentes son el flúor (OEO = 4,0), el oxígeno (OEO = 3,0), el cloro (OEO = 3,5). Los oxidantes importantes incluyen PbO2 , NO4 , Ca(SO4)2 , K2Cr2O7 , HClO, HClO3, KSIO4, Nabio3, H2SO4(final), H NO3 (fin) , N / A2O2 , (NH4)2S2O8 , KSIO3 , H2O2 y otras sustancias que contienen átomos de CO superiores o superiores. Los agentes reductores típicos incluyen sustancias simples cuyos átomos tienen un EER pequeño < 1,5 (metales de los grupos IA y IIA y algunos otros metales). Los agentes reductores importantes incluyen H2S, N.H.3, Hola, Ki, SnCl2 , FeSO4 ,C,H2 , CO, H2SO3 , cr2(SO4)3 , CuCl, Na2S2O3 y otras sustancias que contienen átomos bajos de CO. Las sustancias que contienen átomos en los estados de oxidación máximo y mínimo, respectivamente, solo pueden ser agentes oxidantes, por ejemplo, K2sg2O7 , KMPO4 , PbO2 , HClO4 o solo agentes reductores, como NH3 , H2S, hola. Las sustancias que contienen átomos en estados de oxidación intermedios son capaces tanto de subir como de bajar el estado de oxidación, es decir, pueden ser tanto agentes reductores (bajo la acción de un agente oxidante más activo que ellos) como oxidantes (bajo la acción de un agente más activo que ellos). activo que ellos, agente reductor). Tales sustancias exhiben dualidad redox. Al compilar las ecuaciones de las reacciones redox, se pueden usar dos métodos: el método de balance de electrones y el método de ion-electrón (método de media reacción). El método ion-electrón da una idea más correcta de los procesos redox en soluciones. Con la ayuda de este método, se predicen los cambios que experimentan los iones y las moléculas que realmente existen en una solución. Además de predecir los productos de reacción, las ecuaciones de semirreacción iónica son necesarias para comprender los procesos redox que ocurren durante la electrólisis y en las celdas galvánicas. Este método refleja el papel del medio ambiente como participante en el proceso. Y finalmente, al utilizar este método, no es necesario conocer de antemano todas las sustancias formadas, ya que muchas de ellas se obtienen compilando la ecuación de reacciones redox. Debe tenerse en cuenta que aunque las semirreacciones reflejan los procesos reales que ocurren durante las reacciones redox, no pueden identificarse con las etapas reales (mecanismo) de las reacciones redox. Muchos factores influyen en la naturaleza y dirección de las reacciones redox: la naturaleza de los reactivos, la reacción del medio, la concentración, la temperatura y los catalizadores. Debe tenerse en cuenta que un valor negativo no siempre conduce a una decisión inequívoca sobre el curso real de la reacción en una dirección dada, ya que además es necesario tener en cuenta el factor cinético. 29. Importancia biológica de los procesos redox. Las reacciones redox son procesos químicos acompañados por la transferencia de electrones de una molécula o ion a otra. En las reacciones redox, ocurren dos procesos interrelacionados: oxidación y reducción. La oxidación es el proceso de pérdida de electrones. La recuperación es el proceso de agregar electrones. Las sustancias cuyos átomos o iones donan electrones se denominan agentes reductores. Las sustancias cuyos átomos o iones agregan electrones (o atraen un par común de electrones hacia sí mismos) se denominan agentes oxidantes. En la reacción de zinc con CuSO4 Cu2 + añadir electrones: ellos mismos2+ + 2mi- - si0 . Los átomos de zinc donan electrones: Zn0 -Zn2 + 2mi-. En consecuencia, CuSO4 - agente oxidante, Zn - agente reductor. Los procesos importantes en los organismos animales son las reacciones de oxidación enzimática de sustancias sustrato: carbohidratos, grasas, aminoácidos. Como resultado de estos procesos, los organismos reciben una gran cantidad de energía. Aproximadamente el 90% del requerimiento total de energía de un hombre adulto es cubierto por la energía producida en los tejidos durante la oxidación de carbohidratos y grasas. El resto de la energía - ~10% es proporcionada por la descomposición oxidativa de los aminoácidos. La oxidación biológica procede a través de mecanismos complejos con la participación de un gran número de enzimas. En las mitocondrias, la oxidación ocurre como resultado de la transferencia de electrones desde sustratos orgánicos. Como transportadores de electrones, la cadena respiratoria de las mitocondrias incluye varias proteínas que contienen varios grupos funcionales que están diseñados para transportar electrones. A medida que se mueven a lo largo de la cadena de un intermedio a otro, los electrones pierden su energía libre. Por cada par de electrones transferidos a través de la cadena respiratoria al oxígeno, se sintetizan 3 moléculas de ATP. La energía libre liberada durante la transferencia de 2 electrones al oxígeno es de 220 kJ/mol. La síntesis de 1 molécula de ATP en condiciones estándar consume 30,5 kJ. De esto queda claro que una parte bastante significativa de la energía libre liberada durante la transferencia de un par de electrones se almacena en moléculas de ATP. A partir de estos datos, también queda claro el papel de la transferencia de electrones en varias etapas desde el agente reductor inicial al oxígeno. La gran energía (220 kJ) liberada durante la transferencia de un par de electrones al oxígeno se divide en varias porciones correspondientes a etapas individuales de oxidación. En tres de estas etapas, la cantidad de energía liberada corresponde aproximadamente a la energía requerida para la síntesis de 1 molécula de ATP. Las reacciones redox son la base de los métodos de oxidimetría, que se utilizan en el análisis clínico para determinar los iones Ca, el ácido úrico, las enzimas catalasa y peroxidasa, el azúcar en la sangre y en el análisis sanitario e higiénico para determinar la oxidabilidad del agua, el contenido de cloro activo en lejía, cloro residual en agua doméstica y potable. 30. Enlace químico y sus características experimentales El desarrollo de un modelo moderno del átomo y la predicción de las propiedades de los átomos individuales sobre su base es un logro muy importante de la mecánica cuántica. Sin embargo, los átomos aislados rara vez se encuentran en condiciones terrestres. Los cuerpos de la naturaleza viva e inanimada que nos rodea consisten en una variedad de moléculas. A. M. Butlerov (1828-1886) creó la teoría de la estructura química de las sustancias orgánicas (1861). Desde ese momento, los conceptos de "valencia" y "enlace químico" comenzaron a entrar gradualmente en la química. La valencia es la capacidad de un átomo para unirse a un cierto número de otros átomos para formar una molécula. La valencia se indica mediante guiones junto al símbolo del elemento. El hidrógeno (H) es monovalente, el oxígeno (0= ) es divalente. El número de líneas de valencia determina el número de enlaces químicos que un átomo dado puede formar con otros átomos. Un enlace químico es un conjunto de interacciones entre electrones y núcleos, que conducen a la combinación de átomos en una molécula. Las propiedades de un enlace químico se estudian mediante varios métodos. Con la ayuda de métodos químicos, se determina el número de enlaces de átomos (valencia) y su reactividad. Mediante métodos físicos, se determinan la longitud, la fuerza, la orientación y la polaridad de los enlaces químicos. Longitud del enlace químico rс llamado el valor medido por la distancia entre los núcleos de los átomos unidos. Como unidad de longitud de enlace químico gс cómodo de usar picómetro (pm): 1 pm = 1012 m Fuerza de unión química Eс - valor medido por entalpía ΔÅс formación de conexiones. Como unidad de fuerza de enlace químico Eс Se utilizan kJ/mol. Orientación del enlace químico aс - un valor medido por el ángulo entre las direcciones de los enlaces de un átomo dado con los átomos vecinos de la molécula. El ángulo ac se llama ángulo de valencia. Unidad de ángulo de enlace aс - la licenciatura. Polaridad del enlace químico μс - el valor medido por el momento eléctrico de esta conexión. El momento eléctrico para dos cargas eléctricas +q y ־q, iguales en valor absoluto y de signo opuesto, es igual a μ = qr, donde r es la distancia entre las cargas. Estas dos cargas forman un dipolo eléctrico. Un enlace químico se polariza cuando se unen 2 átomos con diferente electronegatividad (EEO). Como resultado, surge un exceso de carga negativa δ en un átomo con una EER grande, y surge un exceso de carga positiva +δ en otro átomo con una EER más pequeña. La polaridad del enlace se calcula mediante la fórmula: μс = δrс. Como unidad para medir la polaridad de un enlace químico, es conveniente utilizar la unidad Debye fuera del sistema (D) - 1 D = 3,3 x 1030 C/m. La polaridad del enlace O-H en la molécula de agua es μél = 1,5D. El estudio del enlace químico mostró que en la mayoría de los casos la longitud, la fuerza, la orientación, la polaridad del mismo enlace químico en diferentes compuestos tienen aproximadamente los mismos valores. De ahí se sigue que las interacciones que conducen a la formación de un enlace dado entre átomos son de la misma naturaleza en diferentes moléculas. Las teorías mecánicas cuánticas del enlace químico proporcionan una explicación para este hecho. 31. Enlace de hidrógeno. Puentes de hidrógeno intermoleculares e intramoleculares Los enlaces químicos en las moléculas suelen ser muy fuertes, su energía está en el rango de 100-150 kJ/mol. Además, existen los llamados enlaces de hidrógeno, cuya fuerza es de 10-40 kJ/mol. La duración de estos bonos es de 270-230 pm, respectivamente. Enlace de hidrógeno entre átomos EА y miВ se llama interacción llevada a cabo por un átomo de hidrógeno conectado a EА mineralВ enlace químico. La imagen de un enlace de hidrógeno en el caso general tiene la forma: ЭА-NORDESTEв.. Obviamente, el enlace de hidrógeno es tricéntrico, ya que en su formación participan 3 átomos. Para que se produzca tal enlace, es necesario que los átomos EА y miВ tienen alta electronegatividad. Estos son los átomos de los elementos más negativos: nitrógeno (REO = 3,0), oxígeno (REO = 3,5), flúor (REO = 4,0) y cloro (REO = 3,0). Se forma un enlace de hidrógeno como resultado de una combinación de hidrógeno ls-AO y dos átomos de 2pAO EА y miВ; 2rorbitales están orientados a lo largo de una línea recta. Por lo tanto, el enlace de hidrógeno es lineal. El enlace de hidrógeno se llama: 1) intramolecular, si los átomos EА y miВ , conectados por este enlace, pertenecen a la misma molécula; 2) intermolecular, si los átomos EА y miВ están en diferentes moléculas. Los enlaces de hidrógeno intramoleculares juegan un papel biológico importante, ya que determinan, por ejemplo, la estructura helicoidal de las moléculas de proteínas poliméricas. En las proteínas, estos son enlaces N-H ... O entre residuos de aminoácidos. Igualmente importantes son los enlaces de hidrógeno intermoleculares. Con su ayuda, se conectan cadenas de ácidos nucleicos, formando una doble hélice. Hay dos tipos de enlaces entre bases nucleicas: NHN y N-H-O. La energía cinética promedio del movimiento térmico de las moléculas es del orden de 3/2RT. A una temperatura del cuerpo humano de 37 °C (310 °K), esto es aproximadamente 4 kJ/mol. La fuerza de los enlaces de hidrógeno está en el rango de 10-40 kJ/mol, por lo que son lo suficientemente fuertes para resistir los impactos constantes de las moléculas circundantes y asegurar la constancia de la forma de las estructuras biológicas poliméricas. Al mismo tiempo, tras el impacto de las moléculas activas, los enlaces de hidrógeno se rompen periódicamente y luego se restauran nuevamente, asegurando el flujo de varios procesos vitales. Los ejemplos considerados ilustran claramente una gama más amplia de aplicaciones del método MO LCAO que el método VS. Sin embargo, el método VS se puede utilizar con éxito para predecir las propiedades y la estructura de muchas sustancias, incluidos los compuestos complejos. 32. Macro y microelementos en el medio ambiente y en el cuerpo humano Hay varias clasificaciones de elementos químicos contenidos en el cuerpo humano. Entonces, V. I. Vernadsky, según el contenido promedio (fracción de masa w, %) en los organismos vivos, dividió los elementos según el sistema de diez días. Según esta clasificación, los elementos contenidos en los organismos vivos se dividen en tres grupos: macro, micro y ultramicroelementos. Macronutrientes Son elementos cuyo contenido en el organismo es superior a 102% Estos incluyen oxígeno, carbono, hidrógeno, nitrógeno, fósforo, azufre, calcio, magnesio, sodio y cloro. Elementos de seguimiento Estos son elementos cuyo contenido en el cuerpo está en el rango de 103 a 105% Estos incluyen yodo, cobre, arsénico, flúor, bromo, estroncio, bario, cobalto. Ultramicroelementos Son elementos cuyo contenido en el cuerpo es inferior a 105% Estos incluyen mercurio, oro, uranio, torio, radio, etc. Actualmente, los ultramicroelementos se combinan con microelementos en un solo grupo. Esta clasificación refleja solo el contenido de elementos en los organismos vivos, pero no indica el papel biológico y el significado fisiológico de este o aquel elemento. V. V. Kovalsky, en función de su importancia para la vida, dividió los elementos químicos en tres grupos. Elementos vitales (irreemplazables) Están contenidos constantemente en el cuerpo humano, forman parte de enzimas, hormonas y vitaminas: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Su deficiencia conduce a la interrupción de la vida humana normal. elementos de impureza Estos elementos se encuentran constantemente en el cuerpo de animales y humanos: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Su papel biológico es poco conocido o desconocido. elementos de impureza Sc, Tl, In, La, Pr, Sm, W, Re, Tb, etc. Se encuentran en humanos y animales. Los datos sobre el número y el papel biológico aún no se han aclarado. Los elementos necesarios para la construcción y actividad vital de diversas células y organismos se denominan elementos biogénicos. Todavía es imposible enumerar con precisión todos los elementos biogénicos debido a la dificultad de determinar concentraciones muy bajas de elementos traza y establecer sus funciones biológicas. Para 24 elementos, la biogenicidad se estableció de forma fiable. Estos son elementos del primero y algunos elementos del segundo grupo (según Kowalski). 33. Topografía de los elementos biogénicos más importantes del cuerpo humano Los órganos humanos concentran de manera diferente varios elementos químicos en sí mismos, es decir, los elementos micro y macro se distribuyen de manera desigual entre los diferentes órganos y tejidos. La mayoría de los oligoelementos se acumulan en el hígado, los huesos y los tejidos musculares. Estos tejidos son los principales depósitos (almacenes) de muchos elementos traza. Los elementos pueden mostrar una afinidad específica por ciertos órganos y estar contenidos en ellos en altas concentraciones. Es bien sabido que el zinc se concentra en el páncreas, el yodo - en la glándula tiroides, el flúor - en el esmalte dental, el aluminio, el arsénico, el vanadio se acumulan en el cabello y las uñas, el cadmio, el mercurio, el molibdeno - en los riñones, el estaño - en el tejidos intestinales, estroncio - en la glándula prostática, tejido óseo, bario - en la retina pigmentada del ojo, bromo, manganeso, cromo - en la glándula pituitaria, etc. En los organismos, los elementos traza pueden estar en un estado ligado y en forma de formas iónicas libres. Se sabe que el silicio, el aluminio, el cobre y el titanio en los tejidos cerebrales se encuentran en forma de complejos con proteínas, mientras que el manganeso se encuentra en forma iónica. El hidrógeno y el oxígeno son macronutrientes. Son parte del agua, que en el cuerpo de un adulto contiene en promedio alrededor del 65%. El agua se distribuye de manera desigual sobre los órganos, tejidos y fluidos biológicos humanos. Entonces, en el jugo gástrico, la saliva, el plasma sanguíneo, la linfa, el agua es del 89,5 al 90%, en la orina, la materia gris del cerebro, los riñones, el 80%, en la materia blanca del cerebro, el hígado, la piel, la médula espinal, músculos, pulmones, corazón - 70-80%. Menos de todo, el 40% del agua, está contenida en el esqueleto. Los macronutrientes (carbono, hidrógeno, oxígeno, nitrógeno, azufre, fósforo) son parte de las proteínas, los ácidos nucleicos y otros compuestos biológicamente activos del cuerpo. El contenido de carbono en las proteínas es 51-55%, oxígeno - 22-24%, nitrógeno - 15-18%, hidrógeno - 6,5-7%, azufre - 0,3-2,5%, fósforo - alrededor de 0,5%. El carbono, el hidrógeno y el oxígeno también forman parte de los carbohidratos, cuyo contenido en los tejidos animales es bajo, alrededor del 2%. Estos elementos forman parte de los lípidos (grasas). Además, la composición de los fosfolípidos incluye fósforo en forma de grupos fosfato. Los lípidos se concentran en mayor medida en el cerebro (12 %), luego en el hígado (5 %), la leche (2-3 %) y el suero sanguíneo (0,6 %). Sin embargo, la mayor parte del fósforo (600 g) se encuentra en el tejido óseo. Este es el 85% de la masa de todo el fósforo en el cuerpo humano. El fósforo también se concentra en los tejidos duros de los dientes, en los que se incluye junto con calcio, cloro, flúor en forma de hidroxilo, cloro, fluorapatitas de fórmula general Ca5 (CORREOS4)3X, donde X = OH, CI, F, respectivamente. El calcio se concentra predominantemente en los huesos, así como en los tejidos dentales. El sodio y el cloro se encuentran principalmente en los fluidos extracelulares, mientras que el potasio y el magnesio se encuentran en los fluidos intracelulares. En forma de fluoruros, el sodio y el potasio forman parte de los tejidos óseos y dentales. Magnesio como fosfato de Mg3 (PO4)2 contenido en los tejidos duros del diente. Las hormonas están involucradas en el mantenimiento de un cierto contenido de macro y microelementos en el cuerpo. 34. El papel biológico de los elementos químicos en el cuerpo. El papel biológico de los elementos químicos en el cuerpo humano es extremadamente diverso. La función principal de los macronutrientes es construir tejidos, mantener una presión osmótica constante, composición iónica y ácido-base. Los oligoelementos, al formar parte de enzimas, hormonas, vitaminas, sustancias biológicamente activas como agentes complejantes o activadores, intervienen en el metabolismo, los procesos de reproducción, la respiración de los tejidos y la neutralización de sustancias tóxicas. Los oligoelementos influyen activamente en los procesos de hematopoyesis, oxidación, reducción, permeabilidad de los vasos sanguíneos y tejidos. Los macro y microelementos (calcio, fósforo, flúor, yodo, aluminio, silicio) determinan la formación de tejido óseo y dental. Se han identificado muchas enfermedades asociadas con una deficiencia o acumulación excesiva de varios oligoelementos. La deficiencia de flúor causa caries dental, deficiencia de yodo - bocio endémico, exceso de molibdeno - gota endémica. Dichos patrones están relacionados con el hecho de que el equilibrio de concentraciones óptimas de elementos biogénicos se mantiene en el cuerpo humano: la homeostasis química. La violación de este equilibrio debido a la falta o el exceso del elemento puede provocar diversas enfermedades. Además de los seis macronutrientes principales -organógenos (carbono, hidrógeno, nitrógeno, oxígeno, azufre y fósforo), que componen los carbohidratos, grasas, proteínas y ácidos nucleicos, macronutrientes inorgánicos -calcio, cloro, magnesio, potasio, sodio- y microelementos - cobre, flúor, yodo, hierro, molibdeno, zinc y también, posiblemente (se ha comprobado en animales), - selenio, arsénico, cromo, níquel, silicio, estaño, vanadio. El análisis del contenido y la proporción de microelementos en el cuerpo humano también se utiliza en el examen médico forense. Por ejemplo, en el caso de intoxicación por alcohol, bajo la influencia del alcohol etílico, aumenta el contenido de calcio en el hígado y disminuye el sodio y el potasio. Al mismo tiempo, en el corazón y los riñones, por el contrario, disminuye el contenido de calcio. La falta de elementos como el hierro, el cobre, el flúor, el zinc, el yodo, el calcio, el fósforo, el magnesio y algunos otros en la dieta acarrea graves consecuencias para la salud humana. Sin embargo, debe recordarse que no solo una deficiencia, sino también un exceso de elementos biogénicos es perjudicial para el cuerpo, ya que altera la homeostasis química. Los componentes minerales, que son vitales en cantidades insignificantes, se vuelven tóxicos en concentraciones más altas. Una serie de elementos (plata, mercurio, plomo, cadmio, etc.) se consideran tóxicos, ya que su entrada en el organismo, incluso en cantidades mínimas, provoca fenómenos patológicos graves. Varios elementos y sus compuestos son ampliamente utilizados como medicamentos. Así, el estudio del papel biológico de los elementos químicos, la elucidación de la relación entre el intercambio de estos elementos y otras sustancias biológicamente activas (enzimas, hormonas, vitaminas) contribuye a la creación de nuevos fármacos y al desarrollo de regímenes de dosificación óptimos para tanto con fines terapéuticos como profilácticos. 35. Elementos S y sus compuestos El agua es uno de los compuestos de hidrógeno más importantes y extendidos en la Tierra. El espacio acuático ocupa casi el 75% de la superficie del globo. El cuerpo de un adulto contiene en promedio 65-67% de agua, el feto (4 meses) - 94%, en recién nacidos - 74%. Todas las reacciones químicas en el cuerpo ocurren solo en el ambiente acuático. La vida sin agua es imposible. El agua destilada es un preparado de la farmacopea. En la práctica médica, se usa otro compuesto de hidrógeno: peróxido de hidrógeno H2 02. Este compuesto es un subproducto importante del metabolismo. El peróxido de hidrógeno es un líquido incoloro y transparente. Provoca ardor al contacto con la piel y mucosas. Molécula H2О2 polar. La presencia de pares de electrones solitarios en los átomos de oxígeno hace posible formar enlaces donante-aceptor de peróxido de hidrógeno con ligandos - aceptores de electrones. El estado de oxidación del oxígeno en H2О2 es igual a 1, es decir, tiene un valor intermedio entre el estado de oxidación del oxígeno en agua (2) y en el oxígeno elemental O2 . De esto se deduce que el peróxido de hidrógeno puede presentar tanto las propiedades de un agente oxidante como las propiedades de un agente reductor (dualidad redox). Sin embargo, a juzgar por los potenciales de semirreacción redox estándar, las propiedades oxidantes son más características del peróxido de hidrógeno. El peróxido de hidrógeno puro es termodinámicamente inestable y, en reposo, se descompone explosivamente en agua y oxígeno, liberando una gran cantidad de calor. Las soluciones acuosas de peróxido de hidrógeno son más estables, en un lugar fresco se pueden almacenar durante mucho tiempo. El peróxido de hidrógeno generalmente se vende en forma de una solución acuosa al 30%: perhidrol. El coproceso de descomposición del peróxido de hidrógeno se acelera significativamente en presencia de sales de metales pesados. La descomposición del peróxido de hidrógeno catalizada por iones metálicos puede conducir a la formación de radicales, los más importantes de los cuales son el hidróxido HO y el hidroperóxido. La toxicidad se debe a que2О2 y O2 interactuar con la capa lipídica de las membranas celulares y dañarlas. En la práctica médica, el peróxido de hidrógeno se utiliza principalmente como agente bactericida externo. Acción H2О2 basado en el poder oxidante del peróxido de hidrógeno y la inocuidad de su producto de reducción, el agua. En el tratamiento de heridas, el oxígeno liberado juega un doble papel: 1) tiene un efecto antimicrobiano, desodorizante y despigmentante, matando los cuerpos microbianos; 2) forma espuma, lo que contribuye a la transición de las partículas de descomposición del tejido a un estado suspendido y a la limpieza de heridas. Como preparación de la farmacopea, se usa una solución acuosa de peróxido de hidrógeno al 3%, una solución de peróxido de hidrógeno al 6% se usa para decolorar el cabello. En forma de una solución al 30%, el peróxido de hidrógeno se usa en el tratamiento de la forma verrugosa del liquen plano y para eliminar las verrugas juveniles. 36. El papel biológico de los elementos s del grupo IA (litio, rubidio, cesio, francio) Según el contenido en el cuerpo humano, el sodio (0,08%) y el potasio (0,23%) son macronutrientes, y el resto de los metales alcalinos son litio (104%), rubidio (105%), cesio (104%) - a los elementos traza. Litio El contenido de litio en el cuerpo humano es de aproximadamente 70 mg (10 mmol) - 104%. Los compuestos de litio en los animales superiores se concentran en el hígado, los riñones, el bazo, los pulmones, la sangre y la leche. La cantidad máxima de litio se encuentra en los músculos humanos. El papel biológico del litio como elemento traza aún no se ha dilucidado por completo. Se ha comprobado que a nivel de las membranas celulares, los iones de Li (en una concentración suficiente) compiten con los iones de sodio al penetrar en las células. Obviamente, la sustitución de iones de Na en las células por iones de Li está asociada a una mayor covalencia de los compuestos de litio, por lo que se disuelven mejor en los fosfolípidos. Se ha establecido que algunos compuestos de litio tienen un efecto positivo en pacientes con depresión maníaca. Absorbidos del tracto gastrointestinal, los iones de litio se acumulan en la sangre. Cuando la concentración de iones de Li alcanza los 0,6 mmol/ly más, se produce una disminución de la tensión emocional y un debilitamiento de la excitación maníaca. Al mismo tiempo, se debe controlar estrictamente el contenido de iones de litio en el plasma sanguíneo. En los casos en que la concentración de iones de litio supere los 1,6 mmol/l, es posible que se produzcan fenómenos negativos. Rubidio y cesio Según el contenido de rubidio en el cuerpo humano (105%) y cesio (104%) pertenecen a oligoelementos. Están contenidos constantemente en el cuerpo, pero su papel biológico aún no ha sido dilucidado. Al ser un análogo completo del potasio, el rubidio también se acumula en el fluido intracelular y puede reemplazar una cantidad equivalente de potasio en varios procesos. isótopos radioactivos 13rcs y 87Rb se utiliza en radioterapia de tumores malignos, así como en el estudio del metabolismo del potasio. Debido a su rápida descomposición, incluso pueden introducirse en el cuerpo sin temor a efectos nocivos a largo plazo. Francia Este es un elemento químico radiactivo obtenido por medios artificiales. Existe evidencia de que el francio puede acumularse selectivamente en tumores en las primeras etapas de su desarrollo. Estas observaciones pueden ser útiles en el diagnóstico de cáncer. Así, entre los elementos del grupo IA, Li, Rb, Cs son fisiológicamente activos, mientras que Na y K son vitales. La proximidad de las propiedades fisicoquímicas del Li y el Na, debido a la similitud de la estructura electrónica de sus átomos, se manifiesta también en la acción biológica de los cationes (acumulación en el líquido extracelular, intercambiabilidad). Una naturaleza similar de la acción biológica de los cationes de elementos de grandes períodos - K+, rb+, cs+ (acumulación en el fluido intracelular, intercambiabilidad) también se debe a la similitud de su estructura electrónica y propiedades fisicoquímicas. Esta es la base para el uso de preparaciones de sodio y potasio en caso de intoxicación con sales de litio y rubidio. 37. El papel biológico de los elementos s del grupo IA (sodio, potasio) El contenido de sodio en un cuerpo humano que pesa 70 kg es de aproximadamente 60 g (2610 mmol) - 0,08%. De esta cantidad, el 44% del sodio se encuentra en el líquido extracelular y el 9% en el líquido intracelular. El resto del sodio está en el tejido óseo, que es el lugar de depósito del ion Na en el cuerpo. Alrededor del 40% del sodio contenido en el tejido óseo está involucrado en los procesos metabólicos, y debido a esto, el esqueleto es donante o aceptor de iones de Na, lo que ayuda a mantener una concentración constante de iones de Na en el líquido extracelular. El sodio es el principal ion extracelular. En el cuerpo humano, el sodio se encuentra en forma de sus sales solubles, principalmente cloruro, fosfato e hidrogenocarbonato. El sodio se distribuye por todo el cuerpo: en suero sanguíneo, líquido cefalorraquídeo, líquido ocular, jugos digestivos, bilis, riñones, piel, tejido óseo, pulmones y cerebro. Los iones de Na desempeñan un papel importante para garantizar la constancia del entorno interno del cuerpo humano, participan en el mantenimiento de una presión osmótica constante del biofluido (homeostasis osmótica). Los iones Na están involucrados en la regulación del metabolismo del agua y afectan el funcionamiento de las enzimas. Junto con los iones K, Mg, Ca, Cl, el ion Na participa en la transmisión de los impulsos nerviosos y mantiene la excitabilidad normal de las células musculares. Cuando cambia el contenido de sodio en el cuerpo, se producen disfunciones de los sistemas nervioso, cardiovascular y otros, músculos lisos y esqueléticos. El cloruro de sodio NaCl es la principal fuente de ácido clorhídrico para el jugo gástrico. El sodio ingresa al cuerpo humano principalmente en forma de sal de mesa. El verdadero requerimiento diario de sodio del cuerpo es de 1 g, aunque la ingesta promedio de este elemento alcanza los 4-7 g El exceso continuo de ingesta de NaCl contribuye a la hipertensión. Bajo la influencia de los álcalis en las células microbianas, se produce la precipitación de proteínas celulares y, como resultado, la muerte de los microorganismos. Sulfato de sodio (sal de Glauber) Na2SO4 × 10 horas2El O se usa como laxante. Tetraborato de sodio Na2B4О7 × 10 horas2El O se usa externamente como antiséptico para enjuagues, duchas vaginales y lubricación. El hidróxido de sodio en forma de una solución al 10% es parte de la silina utilizada en la práctica ortopédica para moldear modelos refractarios en la fabricación de prótesis coladas a partir de una aleación de cromo-cobalto. El contenido de potasio en un cuerpo humano que pesa 70 kg es de aproximadamente 160 g (4090 mmol) - 0,23%. El potasio es el principal catión intracelular, representando 2/3 del número total de cationes celulares activos. De la cantidad total de potasio contenida en el cuerpo, el 98% se encuentra dentro de las células y solo alrededor del 2% se encuentra en el líquido extracelular. El potasio se distribuye por todo el cuerpo. Su topografía: hígado, riñones, corazón, tejido óseo, músculos, sangre, cerebro, etc. Los iones K juegan un papel importante en los procesos fisiológicos: contracción muscular, funcionamiento normal del corazón, conducción de impulsos nerviosos, reacciones metabólicas. Los iones K son importantes activadores de enzimas ubicadas dentro de la célula. 38. Función biológica de los elementos s del grupo IIA. Su uso en medicina (berilio, magnesio, calcio) El berilio se encuentra tanto en plantas como en organismos animales. El contenido de berilio en los organismos vivos es del 107%, es decir, es un ultramicroelemento de impureza. El papel biológico del berilio no se ha estudiado lo suficiente. Los compuestos de berilio son tóxicos y causan una serie de enfermedades (raquitismo de berilio, beriliosis, etc.). Los compuestos volátiles de berilio son especialmente tóxicos. El efecto negativo del Be2+ sobre los procesos fisiológicos se explica por sus propiedades químicas. El magnesio es formalmente un macronutriente. Su contenido total en el organismo es del 0,027% (unos 20 g). La topografía del magnesio en el cuerpo humano es la siguiente: el magnesio se concentra en mayor medida en la dentina y el esmalte dental, el tejido óseo. También se acumula en el páncreas, los músculos esqueléticos, los riñones, el cerebro, el hígado y el corazón. En un adulto, el requerimiento diario de magnesio es de aproximadamente 0,7 g El ion Mg, como el ion K, es un catión intracelular. En fluidos biológicos y tejidos del cuerpo, el magnesio se encuentra tanto en forma de ion agua como en un estado unido a proteínas en una cantidad de < 102%, es decir, en esencia, es un microelemento. La concentración de iones Mg dentro de las células es aproximadamente 2,5-3 veces mayor que en los fluidos extracelulares. Los iones de magnesio juegan un papel biológico importante en el cuerpo humano. Debido al radio de iones más pequeño y la energía de ionización más alta de Mg2+ forma enlaces más fuertes que el ion Ca y, por lo tanto, es un catalizador más activo para los procesos enzimáticos. Al formar parte de varios sistemas enzimáticos, el ion Mg es su componente y activador indispensable (enzimas como la carboxipeptidasa, la colinesterasa y algunas otras son específicas del ion Mg). La hidrólisis de ATP, asociada con una serie de reacciones enzimáticas, como resultado de lo cual se forma hidrofosfatación HPO2 y se libera una gran cantidad de energía, se lleva a cabo con un exceso de Mg.2+. El calcio es un macronutriente. Su contenido total en el organismo es del 1,4%. El calcio se encuentra en cada célula del cuerpo humano. La mayor parte del calcio se encuentra en los tejidos óseos y dentales. En promedio, un adulto debe consumir 1 g de calcio por día, aunque la necesidad de calcio es de solo 0,5 g. El calcio administrado con alimentos se absorbe solo en un 50 % en los intestinos. La absorción relativamente pobre es una consecuencia de la formación en el tracto gastrointestinal de fosfato de calcio Ca escasamente soluble.3(CORREOS4)2 y sales de calcio de ácidos grasos. En el cuerpo, la concentración de iones Ca está regulada por hormonas. En los huesos y dientes de un adulto, aproximadamente 1 kg de calcio se encuentra en forma de un mineral cristalino insoluble: hidroxilapatita Ca10(RO4)6(OH)2 , cuya formación se produce durante la interacción de los iones de Ca con la fosfatación. En la sangre y la linfa, el calcio se encuentra tanto en estado ionizado como no ionizado, en compuestos con proteínas, carbohidratos, etc. El mecanismo de coagulación de la sangre consta de varias etapas, dependiendo de la presencia de Ca ionizado. Los iones Ca están involucrados en la transmisión de los impulsos nerviosos, la contracción muscular, la regulación del músculo cardíaco. La concentración de iones Ca dentro y fuera de la célula, respectivamente, es 106 y (2,25-2,8) 103 prostituta. Dado que el calcio prácticamente no se usa dentro de la célula, actúa como material de construcción en el cuerpo, en huesos, dientes. El esqueleto es el principal almacén de calcio del cuerpo. 39. Papel biológico de los elementos d del grupo VIB. Su uso en medicina El cromo se encuentra en organismos vegetales y animales. El cuerpo de un adulto contiene aproximadamente 6 g de Cr (0,1%). El cromo metálico no es tóxico, mientras que los compuestos de Cr(III) y Cr(VI) son peligrosos para la salud. Provocan irritación de la piel, lo que conduce a la dermatitis. Existe la suposición de que los derivados del cromo (VI) tienen propiedades cancerígenas. 0,25-0,3 g de dicromato de potasio causan la muerte. Los compuestos de cromo (VI) se utilizan como fungicidas (agentes decapantes, hongos - "hongo", caldere - "matar"). Los compuestos de cromo (III) tienen un efecto beneficioso sobre el crecimiento de las plantas. El molibdeno pertenece a los "metales de la vida", siendo uno de los bioelementos más importantes. Su posición especial fue notada hace 20-25 años por F. Krin y L. Oril. Estos científicos plantearon la idea de que el surgimiento de la vida en la Tierra no ocurrió por evolución, sino que fue traída por una civilización desconocida desde el espacio desde las estrellas de molibdeno, donde la vida existió mucho antes que nosotros. En procesos bioquímicos, el molibdeno está involucrado en los estados de oxidación de VI y VI. En estos estados, crea formas oxo estables. El molibdeno forma complejos oxo estables y, aparentemente, por lo tanto, forma parte de las enzimas que aseguran la transferencia de grupos oxo. Mo (VI) predomina en la sangre; si el ligando es oxígeno, entonces se forman isopolimolibdaciones estables. El contenido excesivo de molibdeno en los alimentos altera el metabolismo del Ca2+ y RO4 , causando una disminución en la fuerza ósea - osteoporosis. Quizás se produzca la unión a complejos de fosfomolibdeno. Dichos complejos pueden considerarse como residuos ácidos de ácidos heteropolimolíbdicos. Con el calcio, estos residuos forman cristales insolubles. Es posible que estos cristales inicien la deposición de sales de ácido úrico y causen gota. La gota deforma las articulaciones, lo que justifica su traducción literal: "trampa para los pies". Además de los complejos de oxígeno, el molibdeno forma complejos de haluro (Hal), tiocianato (NCS) y cianuro (CN). El molibdeno es un componente de varias enzimas. En el cuerpo humano, estos incluyen aldehído hidroxidasas, xantina deshidrogenasas y xantina oxidasas. El peso molecular de la xantina oxidasa (COX) es de 250 a.u. e. m. Esta es una enzima de mamíferos que contiene molibdeno. Puede catalizar la oxidación de xantina y otras purinas, así como de aldehídos. La xantina oxidasa cataliza la conversión de hipoxantina y xantina en ácido úrico. Se supone que durante el proceso catalítico, el molibdeno forma un enlace con el nitrógeno y el oxígeno de la xantina. El molibdeno es el microelemento más importante de las plantas, ya que las sustancias biológicamente activas con su participación proporcionan una fijación leve de nitrógeno: lo convierten en amoníaco o productos que contienen nitrógeno. En comparación con otros metales de importancia industrial, el molibdeno tiene una toxicidad baja. El consumo de molibdeno con alimentos es de 0,1 - 0,3 mg/día, pero no se ha establecido la ingesta diaria necesaria. La deficiencia de molibdeno provoca una disminución de la actividad de la xantina oxidasa en los tejidos. El contenido excesivo de molibdeno causa osteoporosis. El tungsteno es un oligoelemento. Su papel en el cuerpo no se entiende bien. La forma aniónica de tungsteno se absorbe fácilmente en el tracto gastrointestinal. El tungsteno metálico y sus formas catiónicas no se absorben en el cuerpo. No hay información sobre la homeostasis del tungsteno en los mamíferos. 40. Papel biológico de los compuestos de manganeso. Su uso en medicina De los elementos del grupo VIIB, solo el manganeso es un elemento biogénico y uno de los diez "metales de la vida" necesarios para el curso normal de los procesos en los organismos vivos. El cuerpo de un adulto contiene 12 mg. El manganeso se concentra en los huesos (43%), el resto, en los tejidos blandos, incluido el cerebro. En el cuerpo, el manganeso forma complejos metálicos con proteínas, ácidos nucleicos, ATP, ADP, aminoácidos individuales. Contiene metaloenzimas de manganeso arginasa, colinesterasa, fosfoglucomutasa, piruvato carboxilasa. La unión del amoniaco -producto tóxico de la transformación de los aminoácidos en el organismo de los mamíferos- se realiza a través del aminoácido arginina. La arginasa es una enzima que cataliza la hidrólisis de la arginina en el hígado. Como resultado, la arginina se descompone en urea y el aminoácido cíclico ornitina. La urea es una sustancia no tóxica, soluble en agua. Es transportado por el torrente sanguíneo a los riñones y excretado en la orina. El radio atómico del manganeso es 128 pm. Esto explica el hecho de que el manganeso pueda reemplazar al magnesio (radio atómico 160 pm) en su combinación con ATP, afectando significativamente la transferencia de energía en el cuerpo. Los iones Mg y Mn también llevan a cabo la activación de enzimas - nucleasas. Estas enzimas catalizan la hidrólisis de los ácidos nucleicos de ADN y ARN en el duodeno. Como resultado, estos biopolímeros se dividen en unidades monoméricas: nucleótidos. En particular, tal nucleasa es la desoxirribonucleasa, que cataliza la hidrólisis del ADN solo en presencia de Mg2+ o manganeso2+. El manganeso también puede ser parte de compuestos inorgánicos en el cuerpo. Este, por ejemplo, es un pirofosfato de manganeso y magnesio poco soluble MnMgP2O7. Los cristales de esta sal se localizan en la superficie interna de la membrana de la vesícula. Casi el mismo valor del radio atómico del manganeso y el hierro explica la capacidad del manganeso para reemplazar el hierro en el complejo de porfirina de los eritrocitos. Por la misma razón, el manganeso también puede reemplazar al zinc en enzimas dependientes de zinc, cambiando así sus propiedades catalíticas. Permanganato de potasio KMnO4 - el compuesto de manganeso más famoso utilizado en medicina. Use soluciones acuosas que contengan KMnO4 0,01-5%. Se utiliza una solución al 5% como agente hemostático. Las soluciones de permanganato de potasio tienen propiedades antisépticas, que vienen determinadas por su alto poder oxidante. De los demás compuestos de manganeso, cabe destacar el sulfato de manganeso (II) y el cloruro de manganeso (II), que se utilizan en el tratamiento de la anemia. No hay datos sobre la presencia de tecnecio en organismos vivos. Sin embargo, los compuestos de tecnecio con bisfosfonatos se utilizan para el método de diagnóstico de radioisótopos. 41. El papel biológico de los compuestos de hierro. Hemoglobina El hierro es un elemento biogénico que se encuentra en los tejidos de animales y plantas. La masa total de hierro en el cuerpo de un adulto es de aproximadamente 5 g, que es 0,007%. El hierro metálico es poco tóxico y los compuestos de Fe (II), Fe (III) y Fe (VI) en grandes cantidades son peligrosos para la salud. La mioglobina, los citocromos y la catalasa proporcionan la respiración celular. Todas estas proteínas consisten en sus propias partes proteicas y centros activos asociados con ellas. El centro activo es un compuesto complejo macrocíclico - hemo. El compuesto porfirina actúa como un ligando macrocíclico. Los átomos de nitrógeno donante están ubicados en las esquinas de un cuadrado, en el centro del cual hay un ion Fe. En general, el complejo tiene una configuración octaédrica. El quinto orbital a través del nitrógeno del aminoácido (histidina) se usa para unir el hemo a la proteína. La hemoglobina consta de 4 moléculas de proteína (subunidades) que forman un único agregado macromolecular. Cada subunidad es similar en estructura a la molécula de mioglobina. Por lo tanto, la hemoglobina puede unirse simultáneamente a cuatro moléculas de O2 , y mioglobina - 1. También hay varios complejos de proteínas que contienen hierro no hemo en los tejidos. Estos son, por ejemplo, enzimas, oxidasas, así como proteínas, almacenamiento (depósito) y transportadores de hierro. El exceso de hierro es transportado en la sangre por la proteína transferrina y se acumula en forma de proteína ferritina en varios tejidos y órganos, especialmente en el hígado, el bazo y la médula ósea. La ferritina consta de 24 moléculas de proteína (subunidades) que forman una esfera con un diámetro de 12-14 nm. Cada subunidad contiene una cavidad de 7 nm de diámetro que contiene hasta 4500 átomos de hierro. Así, cada agregado de ferritina puede almacenar aproximadamente 100 átomos de hierro, proporcionando numerosas reacciones metabólicas en las que interviene este elemento. Con base en las leyes del equilibrio químico, no es difícil comprender el funcionamiento de la hemoglobina como transportador de oxígeno desde los pulmones hasta los tejidos. La hemoglobina sin oxígeno (desoxihemoglobina) es un ácido débil y su fórmula química se puede representar como HHb+. La adición de oxígeno va acompañada de la eliminación de un protón y se forma oxihemoglobina HbO.2 . En este caso, hay un equilibrio: HHb+ + O2 → HbO2 + N+. Cuando la sangre venosa pobre en oxígeno ingresa a los pulmones, donde la presión parcial de oxígeno es alta (hasta 20 kPa), su solubilidad aumenta de acuerdo con la ley de Henry. Esto conduce, de acuerdo con el principio de Le Chatelier, a un desplazamiento del equilibrio hacia la derecha ya la formación de oxihemoglobina. Un desplazamiento adicional del equilibrio hacia la derecha se debe al hecho de que en los pulmones aumenta el valor del pH (hasta 7,5). Como resultado, en los pulmones, la desoxihemoglobina se satura casi por completo (hasta un 97 %) con oxígeno y pasa a la oxihemoglobina. En los capilares que penetran en los tejidos periféricos, la presión parcial de oxígeno disminuye a 5 kPa y el valor del pH disminuye a 7,2. Como resultado, el equilibrio se desplaza hacia la izquierda. En la sangre que fluye desde la periferia, la hemoglobina está saturada de oxígeno solo en un 65%. 42. El papel biológico de los compuestos de hierro. Monóxido de carbono CO. Las propiedades del complejo metálico de las proteínas que contienen hemo se manifiestan bajo la acción de sustancias tóxicas como CO (monóxido de carbono) y MCN (cianuros, sales de ácido cianhídrico). Las más importantes desde un punto de vista fisiológico son las proteínas que contienen hierro: hemoglobina, mioglobina, citocromos, peroxidasas, catalasa. La hemoglobina, el componente principal de los glóbulos rojos, proporciona respiración externa, siendo un transportador de oxígeno desde los pulmones hasta los tejidos. El hierro Fe y el cobalto Co son elementos traza esenciales de los organismos vivos. El monóxido de carbono CO es uno de los productos de la combustión incompleta del combustible. Se emiten cantidades significativas de este gas durante la operación de calderas, motores de combustión interna y fumar. Cuando se inhala CO con aire en los pulmones en paralelo con la oxihemoglobina HbO2 se forma un compuesto complejo metálico: carbonil hemoglobina HbCO. La constante de estabilidad de la HbCO es unas 200 veces la de la HbO2 . Por lo tanto, incluso pequeñas cantidades de CO "interceptan" una proporción significativa de desoxihemoglobina, como resultado, disminuye el suministro de oxígeno a los órganos. Hay signos de hipoxia - deficiencia de oxígeno. El tejido nervioso es el primero en verse afectado. Para desintoxicar (eliminar el efecto tóxico) del monóxido de carbono, en muchos casos es suficiente detener su suministro y aumentar la ventilación de oxígeno: lleve a la víctima al aire libre. En este caso, el principio de Le Chatelier vuelve a funcionar: el equilibrio se desplaza hacia la formación de oxihemoglobina. A altas concentraciones, el monóxido de carbono bloquea las proteínas de la respiración celular que contienen hemo, y es difícil evitar un resultado letal. El mecanismo de acción de los cianuros es similar, pero su toxicidad es superior a la del CO. Incluso la entrada en la sangre de cantidades muy pequeñas de estas sustancias provoca un paro respiratorio y la muerte. La alta toxicidad de los cianuros se explica por la alta fuerza del enlace Fe-CN-, que determina la mayor estabilidad de la hemoglobina cianurada. La respiración de oxígeno conduce a la formación de peróxido de hidrógeno H2O2 . Esta sustancia tiene un alto poder oxidante. Cuando interactúa con los compuestos bioorgánicos de las células, se forman radicales, partículas moleculares muy activas con valencia insaturada, y se inicia la oxidación del peróxido. Bajo la acción de los radicales, los componentes más importantes de la célula, las membranas y el ADN, se destruyen. En el curso de la evolución biológica, la naturaleza ha desarrollado una proteína especial: la enzima catalasa, que destruye el peróxido de hidrógeno. Esto limita la acumulación excesiva de esta sustancia y evita la destrucción de la célula. La acción de la catalasa (CatFe2+ ) se puede representar como un ciclo catalítico de dos reacciones sucesivas: Gato2+ + N2O2 - Gato Fe2+ × H2O2 , Gato2+ × H2O2 + N2O2 → CatFe2+ + 2Н2O2 + O2 . Como resultado, se destruyen 2 moléculas de peróxido de hidrógeno y se libera la molécula del biocatalizador CatFe2+ y puede entrar en el siguiente ciclo catalítico. Este proceso es muy rápido. En un segundo, 1 molécula de catalasa puede realizar hasta 20 ciclos. 43. El papel biológico de los compuestos de hierro y cobalto Con la falta de hierro en el cuerpo, se puede desarrollar una enfermedad: anemia por deficiencia de hierro (anemia). Hay deficiencia de oxígeno tisular asociada a la falta de hierro para la síntesis de hemoglobina. Como resultado, disminuye el suministro de oxígeno a los órganos periféricos y, en consecuencia, disminuye el nivel de respiración celular y el metabolismo se ralentiza. La introducción de cloruro de hierro (II) o sulfato de hierro (II) como fármacos reduce la gravedad de la enfermedad. Para los mismos fines, se utiliza un polvo fino de hierro metálico (hierro reducido, hasta 1 g por dosis), que es fácilmente soluble en ácido clorhídrico del jugo gástrico. Por tanto, la acción de este fármaco es similar a la del cloruro de hierro (II). Sin embargo, los fármacos que son complejos bioinorgánicos de hierro con azúcares, nicotinamida y otras sustancias orgánicas son más efectivos. Dichos complejos se absorben bien en la sangre, lo que explica su eficacia farmacológica. Es interesante notar que desde la antigüedad hasta el presente, el llamado vino de hierro se usa para tratar la anemia por deficiencia de hierro, una bebida que se obtiene al infundir vino de uva en limaduras de hierro. Obviamente, el hierro se disuelve en el vino (ambiente ácido) y forma complejos con sustancias orgánicas naturales, que están contenidas en él en grandes cantidades. Está claro que el mecanismo de acción de la bebida antigua es aproximadamente el mismo que el de las drogas modernas. Al igual que el hierro, el cobalto también es uno de los elementos biogénicos más importantes. La masa total de cobalto en el cuerpo de un adulto es de aproximadamente 1,2 mg, que es menos del 10%. Alrededor de 100 mg de esta masa se encuentra en forma de cianocobalamina (vitamina B liposoluble12 ) y sus análogos. Esta sustancia, como el hemo, es un compuesto complejo macrocíclico. Un compuesto tetradentado, la porfina, actúa como ligando macrocíclico. R es un sustituyente orgánico complejo. En los análogos de la cianocobalamina, actúan varios sustituyentes orgánicos en lugar del anión CN. El papel más importante de la vitamina B.12 juega en el desarrollo y formación de glóbulos rojos (eritropoyesis). Deficiencia de vitamina B12 (la recepción de menos de 3 mcg por día) conduce a una enfermedad grave: anemia perniciosa (anemia). Se ha establecido que los análogos de la cianocobalamina son activadores, cofactores de varias enzimas involucradas en la eritropoyesis. La falta de cofactores se manifiesta en la deficiencia de hemoglobina y eritrocitos. Las plantas y los animales no pueden sintetizar la vitamina B.12. Es producido sólo por ciertos tipos de bacterias. Estas bacterias están presentes en el tracto gastrointestinal humano. Sintetizan suficiente vitamina B12. La anemia perniciosa se asocia con una mala absorción de esta vitamina en la sangre. Por lo tanto, tomar pastillas no es efectivo. Una inyección de vitamina (100-200 mcg durante 2 días) en la sangre mejora significativamente la condición del paciente con anemia maligna. 44. El papel de los elementos d del grupo IB. El uso de sus compuestos en medicina. El cobre Cu es un microelemento esencial de los organismos vivos. La plata Ag y el oro Au son elementos traza de impurezas. Sus compuestos se utilizan en medicina. El cobre es un elemento biogénico que se encuentra en los tejidos de animales y plantas. La masa total de cobre en el cuerpo de un adulto es de aproximadamente 100 mg, que es alrededor del 0,0001 %. Aproximadamente el 30% de esta cantidad se encuentra en los músculos. El hígado y el cerebro también son ricos en cobre. El cobre metálico y sus compuestos son tóxicos. Las más importantes desde un punto de vista fisiológico son las proteínas que contienen cobre: la citocromo oxidasa y la superóxido dismutasa. La citocromo oxidasa es uno de los componentes de la cadena respiratoria localizada en las membranas mitocondriales. Proporciona respiración celular al reducir el oxígeno a agua al final de la cadena respiratoria. El cuerpo necesita 2,5-5,0 mg de cobre al día. Con la falta de cobre en el cuerpo, se puede desarrollar una enfermedad: anemia por deficiencia de cobre. El cobre es necesario para la absorción del hierro, en particular, en la síntesis de la citocromo oxidasa, que contiene tanto hierro como cobre. Con la deficiencia de cobre, se altera el desarrollo normal de los tejidos conectivos y los vasos sanguíneos. El envenenamiento generalmente se asocia con una sobredosis accidental de insecticidas, inhalación de polvo metálico, ingestión de soluciones de sal de cobre. Las bebidas almacenadas en recipientes de cobre sin una capa protectora de las paredes son muy peligrosas. Como agente externo se utiliza una solución acuosa al 0,25% de sulfato de cobre CuSO.4 con inflamación de las mucosas y conjuntivitis. Se pueden tomar pequeñas dosis de este medicamento con alimentos para aumentar la eritropoyesis en la anemia. Plata y oro Aproximadamente 1 mg de plata, es decir, aproximadamente el 10 % (1 ppm), y hasta 10 mg de oro, es decir, aproximadamente el 10 % (10 ppm), se encuentran en el cuerpo de un adulto. Las propiedades antisépticas de las sales de plata solubles se conocen desde la antigüedad. Los sacerdotes saben desde hace mucho tiempo que el agua ("sagrada"), cuando se almacena en recipientes de plata, no se deteriora durante mucho tiempo, es decir, no está sujeta a contaminación microbiana. Actualmente, esta propiedad del agua "plateada" es utilizada por los marineros en viajes de larga distancia. Se observan fuertes manifestaciones tóxicas en un adulto cuando se ingieren 7 g de AgNO.3. En medicina se han utilizado durante mucho tiempo fármacos como el nitrato de plata cristalino AgNO03 (lapislázuli) y sus soluciones acuosas. Las preparaciones de plata metálica coloidal protargol (8% Ag) y collargol (70% Ag) se conocen desde hace mucho tiempo, que son polvos finos con un brillo metálico. Cada partícula de tales polvos es un cristal de plata metálica reducida de menos de 1 μm de tamaño con una cubierta proteica de albúmina (protargol) o colágeno (collargol). La cubierta de proteína evita que los cristales de plata se peguen entre sí y asegura su transición al medio acuoso (los solubiliza). Las preparaciones de plata se utilizan como agentes antiinflamatorios, antisépticos y astringentes. Las preparaciones de oro también se usan como medicamentos antiinflamatorios efectivos. Los más conocidos son el krizanol con un contenido del 30% del metal noble y el oro coloidal. 45. Papel biológico de los elementos d del grupo IIB. El uso de sus compuestos en medicina. Zinc Zn, cadmio Cd, mercurio Hg son oligoelementos. El cuerpo de un adulto contiene 1,8 g de Zn, 50 mg de Cd, 13 mg de Hg. El cadmio y el mercurio son elementos de impureza. Alrededor del 70% del mercurio se concentra en los tejidos adiposo y muscular. El cadmio se localiza en un 30% en los riñones, el resto, en el hígado, los pulmones y el páncreas. El zinc es un elemento esencial para todas las plantas y animales. En el cuerpo de un adulto, la mayor parte del zinc se encuentra en los músculos (65%) y huesos (20%). El resto de la cantidad cae en el plasma sanguíneo, el hígado, los eritrocitos. La mayor concentración de zinc en la próstata. El zinc no presenta valencia variable. Aparentemente, por lo tanto, sus biocomplejos participan en muchas reacciones de hidrólisis bioquímica que ocurren sin transferencia de electrones. El ion Zn forma parte de más de 40 metaloenzimas que catalizan la hidrólisis de ésteres y proteínas. Uno de los más estudiados es el complejo bioinorgánico de zinc, la enzima anhidrasa carbónica (Mg = 30 000), que consta de unos 260 residuos de aminoácidos. El zinc no forma parte de las dipeptidasas, enzimas que catalizan la hidrólisis de dipéptidos (sustancias que consisten en 2 aminoácidos). El zinc forma un complejo bioinorgánico con la insulina, una hormona que regula el azúcar en la sangre. La necesidad humana de zinc está completamente satisfecha por los productos alimenticios: carne, lácteos, huevos. Con la falta de zinc en las plantas, se altera el metabolismo de proteínas y carbohidratos, se inhibe la síntesis de clorofila y vitaminas. La deficiencia de zinc se elimina mediante el uso de fertilizantes que contienen zinc. La toxicidad de los compuestos del grupo IIB aumenta del zinc al mercurio. Los compuestos solubles en agua irritan la piel y causan envenenamiento si se ingieren. Los metales en sí también son tóxicos: al inhalar vapor de zinc (el aire de la producción de zinc), aparece una fiebre de "metal". El envenenamiento por vapor de mercurio en la Edad Media se llamaba la "enfermedad del sombrerero loco". El contenido de mercurio en los alimentos (en el mar, como en Japón) conduce a la enfermedad de minomata. La toxicidad del mercurio está asociada con la aglutinación (pegado) de glóbulos rojos, inhibición de enzimas. Por ejemplo, sublimar provoca un cambio de tamaño, fragilidad osmótica y una disminución de la deformabilidad de los glóbulos rojos, que es necesaria para su movimiento a través de los capilares. La toxicidad del cadmio está relacionada con su afinidad por los ácidos nucleicos. Como resultado de su unión al ADN, su funcionamiento se ve interrumpido. La toxicidad crónica por cadmio y mercurio puede afectar la mineralización ósea. Los elementos tóxicos pueden reemplazar el calcio. Esto conduce a la formación de apatito con una estructura imperfecta debido a la distorsión de los parámetros del componente cristalino del tejido óseo. Como resultado, la fuerza ósea disminuye. 46. Propiedades tóxicas de compuestos del grupo IIB (Zn, Cd, Hg) Los compuestos Zn, Cd, Hg pueden causar una violación del metabolismo de las proteínas, que se manifiesta en la liberación de proteínas plasmáticas a través de los riñones (en proteinuria). El efecto tóxico de los compuestos del grupo IIB en el cuerpo también es causado por el hecho de que estos iones metálicos interactúan con los grupos sulfhidrilo SH de proteínas, enzimas y aminoácidos. Cuando los iones metálicos interactúan con los grupos SH, se forman compuestos débilmente disociados y, por regla general, insolubles. Por lo tanto, el bloqueo de los grupos sulfhidrilo conduce a la supresión de la actividad enzimática y al plegamiento de proteínas. Los iones metálicos divalentes bloquean simultáneamente dos grupos SH. En reacciones de este tipo, los iones metálicos actúan como aceptor y el azufre actúa como donante de electrones. La afinidad química más pronunciada por los grupos SH en el mercurio. Obviamente, esto se debe al hecho de que las propiedades complejantes del mercurio son más altas y forma enlaces más fuertes con el azufre. Los grupos SH forman parte de más de 100 enzimas, cuya actividad puede ser suprimida debido al bloqueo de estos grupos. Por lo tanto, es obvio lo importante que es conocer el mecanismo de bloqueo y los métodos de tratamiento para envenenar el cuerpo con metales. Se sabe que las propiedades tóxicas de los elementos dependen de la forma química en que ingresan al cuerpo. Las formas más tóxicas son aquellas que se disuelven en lípidos y penetran fácilmente a través de la membrana hacia el interior de la célula. La literatura describe un caso de envenenamiento masivo por mercurio en Japón. Los compuestos inorgánicos de mercurio se convirtieron en metilmercurio bajo la acción de enzimas microbianas. El metilmercurio se acumuló en el pescado y luego entró en el cuerpo humano con los alimentos. Concentrándose gradualmente, el metilmercurio causa una destrucción irreversible en el cuerpo y la muerte. El uso de compuestos de zinc y mercurio en medicina se basa en sus efectos astringentes, cauterizantes y antisépticos. Como gotas para los ojos, se usa una solución acuosa al 0,25% de sulfato de zinc ZnSO.4. En odontología, el cloruro de zinc se usa para cauterizar papilomas, para tratar las membranas mucosas inflamadas. También se utiliza óxido de zinc ZnO. El cloruro de mercurio (II) (cloruro de mercurio) es muy tóxico, y sus soluciones acuosas en diluciones altas (1: 1000) se utilizan para la desinfección. Para el tratamiento de enfermedades de la piel y de transmisión sexual, se utilizan ungüentos que contienen óxido de mercurio (II) HgO y sulfuro de mercurio (II) HgS. El cloruro de mercurio(I) (calomelano) es poco soluble en agua y, por lo tanto, ligeramente tóxico. Esta sal se utiliza en medicina veterinaria como laxante. El mercurio en condiciones normales es un metal líquido que puede disolver otros metales. En este caso, se forman aleaciones duras, amalgamas. En odontología, las amalgamas de plata y cadmio se han utilizado durante mucho tiempo para obturar los dientes. Son químicamente inertes, se ablandan fácilmente cuando se calientan y, por lo tanto, son fáciles de moldear. Las fuentes de luz ultravioleta (lámparas de mercurio y cuarzo para fines médicos) contienen mercurio gaseoso (vapores). Cuando se irradia con la luz de estas lámparas en las habitaciones de los hospitales, se destruyen los microorganismos contenidos en el aire. Con la ayuda de los rayos ultravioleta, se tratan diversas enfermedades de la piel. Por lo tanto, de acuerdo con la naturaleza del funcionamiento y el impacto en el cuerpo, los metales del grupo IIB se pueden dividir en el elemento vital Zn y los elementos de impureza tóxica Cd y Hg. 47. Papel biológico de los elementos p del grupo IIIA. El uso de sus compuestos en medicina. El boro es un oligoelemento de impureza, su fracción de masa en el cuerpo humano es del 105%. El boro se concentra principalmente en los pulmones (0,34 mg), glándula tiroides (0,30 mg), bazo (0,26 mg), hígado, cerebro (0,22 mg), riñones, músculo cardíaco (0,21 mg). El efecto biológico del boro aún no ha sido suficientemente estudiado. Se sabe que el boro está presente en dientes y huesos, aparentemente en forma de sales de ácido bórico poco solubles con cationes metálicos. El exceso de boro es perjudicial para el cuerpo humano. Hay evidencia de que un exceso de boro inhibe las amilasas, las proteinasas y reduce la actividad de la adrenalina. Según el contenido en el cuerpo humano (105%), el aluminio pertenece a los microelementos de impurezas. El aluminio se concentra principalmente en el suero sanguíneo, los pulmones, el hígado, los huesos, los riñones, las uñas, el cabello, ingresa a la estructura de las vainas nerviosas del cerebro humano. La ingesta diaria de aluminio por un ser humano es de 47 mg. El aluminio afecta el desarrollo de los tejidos epiteliales y conectivos, la regeneración del tejido óseo, afecta el intercambio de fósforo. El aluminio tiene un efecto sobre los procesos enzimáticos. Un exceso de aluminio en el cuerpo inhibe la síntesis de hemoglobina, porque debido a su capacidad complejante bastante alta, el aluminio bloquea los centros activos de las enzimas involucradas en la hematopoyesis. Existe evidencia de que el aluminio puede catalizar la reacción de transaminación. El galio es un oligoelemento de impureza (el contenido en el cuerpo humano es 10-6-10-5%). El papel biológico del galio en los organismos vivos casi no está claro. El talio es un elemento altamente tóxico. El ion T1 tiende, como Ag+, a formar compuestos fuertes con ligandos que contienen azufre. Como resultado, es muy tóxico, ya que inhibe la actividad de las enzimas que contienen grupos tio - SH. Incluso cantidades muy pequeñas de compuestos T1+, cuando se ingieren, provocan la caída del cabello. Debido a la proximidad de los radios K+ y T1+ tienen propiedades similares y pueden reemplazarse entre sí en enzimas. Los iones T1 y K son sinergistas. Esto explica el hecho de que las enzimas piruvato quinasa y diol deshidratasa sean activadas no solo por los iones K, sino también por los iones T1 (el ion T1 reemplaza al ion K en el centro catalítico de las enzimas). La sinergia del talio y el potasio también se manifiesta en el hecho de que, al igual que los iones K, los iones T1 se acumulan en los eritrocitos. Como antídoto para el envenenamiento con iones T1, se usa un ligando que contiene azufre, el aminoácido cistina. En conclusión, cabe señalar que el papel biológico de los elementos p del grupo IIIA no ha sido suficientemente estudiado. Ahora se sabe que el boro y el galio interactúan en las plantas con los polifenoles, inhibidores de su desarrollo, reduciendo la toxicidad de estos últimos. También se ha establecido el indudable papel del aluminio en la construcción de tejidos epiteliales y conectivos y, además, su participación en procesos enzimáticos, tanto como activador como inhibidor. El ion T1 tiene la capacidad de inhibir muchas enzimas que contienen azufre. La actividad biológica de los elementos del grupo IIIA se relaciona principalmente con su capacidad para formar compuestos complejos con ligandos que contienen oxígeno y fosfatos insolubles. 48. Papel biológico de los elementos p del grupo IVA. El uso de sus compuestos en medicina. Según el contenido en el cuerpo humano (21,15%), el carbono pertenece a los macronutrientes. Forma parte de todos los tejidos y células en forma de proteínas, grasas, carbohidratos, vitaminas, hormonas. Desde un punto de vista biológico, el carbono es el organógeno número 1. Según el contenido en el cuerpo humano (103% ־), el silicio pertenece a los microelementos impuros. La mayoría de silicio en el hígado, las glándulas suprarrenales, el cabello, el cristalino. Dado que el dióxido de silicio natural es poco soluble en agua, ingresa al cuerpo humano no tanto a través del tracto digestivo como por aire a través de los pulmones en forma de polvo de SiO.2. Con una violación del metabolismo del silicio, se asocia la aparición de hipertensión, reumatismo, úlceras, anemia. En la práctica médica, se utiliza carburo de silicio (IV) SiC: carborundo para moler empastes y prótesis de plástico. Dióxido de silicio SiO2 parte de los cementos de silicato. Cabe señalar que el polvo que consiste en partículas de carbón, dióxido de silicio y aluminio, cuando se expone sistemáticamente a los pulmones, causa una enfermedad: la neumoconiosis. Bajo la acción del polvo de carbón, es la antracosis, una enfermedad profesional de los mineros. Inhalación de polvo que contiene S1O2 , se produce silicosis, bajo la acción del polvo de aluminio - aluminosis. Según el contenido en el cuerpo humano (10-6-10-5%) germanio es un microelemento. El papel biológico no se ha dilucidado completamente. Los compuestos de germanio mejoran los procesos de hematopoyesis en la médula ósea. También se sabe que los compuestos de germanio tienen baja toxicidad. Según el contenido en el cuerpo humano (104 %) de estaño se refiere a oligoelementos. El estaño ingresa al cuerpo humano con alimentos ácidos conservados en latas recubiertas con una capa de estaño. En un ambiente ácido, el estaño se disuelve y entra en la sangre en forma de sal, exhibiendo un efecto tóxico. Sin embargo, en experimentos con ratas, se encontró que el estaño en pequeñas cantidades tiene un efecto estimulante sobre el crecimiento de las ratas. Esto da razón para asumir su necesidad para los humanos. Sin duda, la elucidación del papel biológico de este microelemento requiere más estudio. En la práctica médica se utilizan diversos materiales, en particular materiales de obturación que contienen estaño. Así, el estaño forma parte de la amalgama de plata (28%) para la fabricación de empastes. El plomo y sus compuestos, especialmente los orgánicos, son altamente tóxicos. Los compuestos de plomo afectan la síntesis de proteínas, el equilibrio energético celular y su aparato genético. Muchos factores hablan a favor de un mecanismo de desnaturalización. Se ha establecido que el plomo es uno de los elementos cuya presencia en los alimentos incide en el desarrollo de caries. Con alimentos, agua, aire atmosférico, una persona absorbe diariamente hasta 100 microgramos de plomo. El plomo se deposita principalmente en el esqueleto (hasta un 90%) en forma de fosfato escasamente soluble. La fracción de masa de plomo en el cuerpo humano es 106% ־. Una ingesta diaria de 0,2-2 mg de plomo se considera segura para los humanos. En la práctica médica, el acetato de plomo (lociones) y el óxido de plomo (II) PbO (parte del parche de plomo simple) han encontrado aplicación como antisépticos astringentes externos. 49. Papel biológico de los elementos p del grupo VA. El uso de sus compuestos en medicina (nitrógeno, fósforo) El contenido de nitrógeno en el cuerpo humano (3,1%) se refiere a los macronutrientes. Si tenemos en cuenta solo la masa de materia seca del cuerpo (sin agua), el contenido de nitrógeno en las células es del 8-10%. Este elemento es una parte integral de los aminoácidos, proteínas, vitaminas, hormonas. El nitrógeno forma enlaces polares con los átomos de hidrógeno y carbono en las biomoléculas. En muchos complejos bioinorgánicos (metaloenzimas), los átomos de nitrógeno se unen a las partes orgánica e inorgánica de la molécula mediante el mecanismo donador-aceptor. Junto con el oxígeno y el carbono, el nitrógeno forma compuestos vitales: aminoácidos que contienen un grupo amino con propiedades básicas y un grupo carboxilo (-COOH) con propiedades ácidas. El grupo amino también realiza una función muy importante en las moléculas de ácido nucleico. La importancia fisiológica de los bioligandos que contienen nitrógeno, las porfirinas, como la hemoglobina, es enorme. El ciclo del nitrógeno tiene lugar en la biosfera. El ciclo del nitrógeno es vital para la agricultura. Es necesario tener en cuenta otra propiedad biológicamente importante del nitrógeno: su solubilidad en agua es casi la misma que la del oxígeno. La presencia de exceso de nitrógeno en la sangre puede ser la causa del desarrollo de la enfermedad por descompresión. Con el rápido ascenso de los buzos, se produce una fuerte caída de la presión, la solubilidad del nitrógeno en la sangre disminuye en consecuencia (ley de Henry) y las burbujas de nitrógeno elemental que salen de la sangre obstruyen los vasos pequeños, lo que puede provocar parálisis y muerte. Según el contenido en el cuerpo humano (0,95%), el fósforo pertenece a los macronutrientes. El fósforo es un elemento organogénico y juega un papel extremadamente importante en el metabolismo. En forma de fosfato, el fósforo es un componente esencial del ATP intracelular. Forma parte de proteínas (0,5-0,6%), ácidos nucleicos, nucleótidos y otros compuestos biológicamente activos. El fósforo es la base del esqueleto de animales y humanos (ortofosfato de calcio, hidroxiapatita), dientes (hidroxiapatita, fluorapatita). Muchas reacciones biosintéticas se llevan a cabo debido a la transferencia de grupos fosfato de un aceptor de alta energía a uno de baja energía. El sistema amortiguador de fosfato es uno de los principales sistemas amortiguadores de la sangre. Los organismos vivos no pueden prescindir del fósforo. La importancia del fósforo radica en que los azúcares y los ácidos grasos no pueden ser utilizados por las células como fuentes de energía sin una fosforilación previa. El intercambio de fósforo en el cuerpo está íntimamente relacionado con el intercambio de calcio. Esto se confirma por una disminución en la cantidad de fósforo inorgánico con un aumento en el contenido de calcio en la sangre (antagonismo). La necesidad humana diaria de fósforo es de 1,3 G. El fósforo está tan extendido en los productos alimenticios que los casos de su aparente deficiencia (inanición de fosfato) son prácticamente desconocidos. Sin embargo, no todo el fósforo contenido en los productos alimenticios puede ser absorbido, ya que su absorción depende de muchos factores: el pH, la relación entre calcio y fósforo en los alimentos, la presencia de ácidos grasos en los alimentos, pero ante todo, del contenido de vitamina D. Una serie de compuestos de fósforo se utilizan como medicamentos. Cabe señalar que los compuestos organofosforados que contienen el enlace C-P son fuertes venenos para los nervios y forman parte de los agentes de guerra química. 50. Papel biológico de los elementos p del grupo VA (arsénico, antimonio, bismuto). Su uso en medicina Según el contenido en el cuerpo humano, el arsénico pertenece a los oligoelementos. Se concentra en el hígado, riñones, bazo, pulmones, huesos, cabello. La mayor parte del arsénico se encuentra en el tejido cerebral y los músculos. El arsénico se acumula en los huesos y el cabello y no se elimina por completo durante varios años. Esta característica se utiliza en el examen forense para aclarar la cuestión de si ha habido envenenamiento con compuestos de arsénico. La determinación de arsénico en material biológico se lleva a cabo en un dispositivo simple según la reacción de Marsh: se agrega zinc y ácido clorhídrico al objeto biológico. El hidrógeno liberado durante la reacción reduce cualquier compuesto de arsénico a arsina. Si el hidrógeno liberado contiene una mezcla de arsina, entonces AsH se descompone cuando la mezcla de gases se calienta.3 : 2ceniza3 = 2As° + 3H2. y en las paredes del tubo para la evolución del gas se forma una capa negra brillante de arsénico - un "espejo de arsénico". La reacción de Marsh es muy sensible y puede detectar 7-107 arsénico. En dosis relativamente altas, los compuestos de arsénico son muy tóxicos. Como ya se mencionó, el efecto tóxico de los compuestos de arsénico se debe al bloqueo de los grupos sulfhidrilo de las enzimas y otras sustancias biológicamente activas. Según el contenido en el cuerpo humano (10%), el antimonio y el bismuto son microelementos. Según la clasificación de V. V. Kovalsky, el antimonio y el bismuto pertenecen al grupo de microelementos que se encuentran constantemente en los organismos vivos, pero cuyo papel fisiológico y bioquímico prácticamente no está claro. El papel fisiológico del antimonio es obviamente similar al del arsénico. Los iones de arsénico As y antimonio Sb y, en menor medida, bismuto Bi son sinergistas. Por lo tanto, se sabe que en las provincias biogeoquímicas con un exceso de arsénico en los organismos, aumenta el contenido no solo de arsénico, sino también de antimonio. Al mismo tiempo, ambos elementos se acumulan en la glándula tiroides de los habitantes, inhiben su función y provocan bocio endémico. El sinergismo del arsénico y el antimonio está asociado con su capacidad para formar compuestos con ligandos que contienen azufre. El bismuto es más propenso a unirse con ligandos que contienen grupos amino. Entonces, la entrada de compuestos de bismuto solubles en el cuerpo conduce a la inhibición de las enzimas amino y carboxipolipeptidasa. La ingestión de compuestos de antimonio solubles en agua, como la estibina SbH3, tiene un efecto tóxico similar al de los compuestos de arsénico. Los compuestos de bismuto también son tóxicos cuando se inyectan. Por ejemplo, para perros, la dosis letal es de 6 mg/kg de peso corporal. Sin embargo, cuando la mayoría de los compuestos de antimonio y bismuto ingresan al tracto digestivo, prácticamente no tienen un efecto tóxico. La débil toxicidad de estos compuestos se debe al hecho de que las sales de Sb (III), Bi (III) en el tracto digestivo sufren hidrólisis con la formación de productos poco solubles que no se absorben en las paredes del tracto gastrointestinal. Esta es la base para el uso de drogas de antimonio y bismuto, por ejemplo, nitrato de bismuto básico. 51. Papel biológico de los elementos p del grupo VIA. El uso de sus compuestos en medicina. Según el contenido en el cuerpo humano (62%), el oxígeno pertenece a los macronutrientes. Es indispensable y es uno de los elementos más importantes que forman la base de los sistemas vivos, es decir, es un organógeno. El oxígeno forma parte de un gran número de moléculas, desde las más simples hasta los biopolímeros. El papel del oxígeno en los procesos de la vida es grande, ya que la oxidación de los nutrientes (carbohidratos, proteínas, grasas) con oxígeno sirve como fuente de energía necesaria para el funcionamiento de los órganos y tejidos de los organismos vivos. La mayoría de las reacciones redox en el cuerpo proceden con la participación de oxígeno y sus formas activas. Las funciones fagocíticas (protectoras) del cuerpo también están asociadas con la presencia de oxígeno, y una disminución en el contenido de oxígeno en el cuerpo reduce sus propiedades protectoras. En los fagocitos (células capaces de captar y digerir cuerpos extraños), el oxígeno 02 se reduce a superóxido. En la práctica médica, el oxígeno se usa para la inhalación en condiciones dolorosas acompañadas de deficiencia de oxígeno (hipoxia), enfermedades del tracto respiratorio, sistema cardiovascular, envenenamiento con monóxido de carbono (II) CO, ácido cianhídrico HCN, así como enfermedades con funciones respiratorias deterioradas . Ampliamente utilizado en la práctica clínica es la oxigenación hiperbárica, el uso de oxígeno a alta presión. La modificación alotrópica del oxígeno - ozono O3 como agente oxidante muy fuerte se utiliza para la desinfección de locales, la desinfección del aire y la purificación del agua potable. Según el contenido en el cuerpo humano (0,16%), el azufre pertenece a los macronutrientes. Como el oxígeno, es vital. El requerimiento diario de azufre de un adulto es de aproximadamente 4-5 g El azufre es parte de muchas biomoléculas: proteínas, aminoácidos (cistina, cisteína, metionina, etc.), hormonas (insulina), vitaminas (vitamina B1). Se encuentra mucho azufre en el caroteno del cabello, los huesos y el tejido nervioso. En los organismos vivos, el azufre, que forma parte de los aminoácidos, se oxida. Los productos finales de este proceso son predominantemente sulfatos. Además, se forman tiosulfatos, azufre de cemento y ácidos politiónicos. Según el contenido en el cuerpo (10-5-10-7%) el selenio es un microelemento. Algunos investigadores lo consideran un elemento vital. El selenio proviene de los alimentos: 55-110 mg por año. El selenio se concentra principalmente en el hígado y los riñones. La concentración de selenio en sangre es de 0,001-0,004 mmol/l. La conexión del selenio con el azufre en los organismos vivos es indudable. En dosis altas, el selenio se acumula principalmente en las uñas y el cabello, que se basan en aminoácidos que contienen azufre. También se conoce la capacidad del selenio para proteger al cuerpo del envenenamiento con mercurio Hg y cadmio Cd. El selenio favorece la unión de estos metales tóxicos a otros centros activos, a aquellos que no se ven afectados por su efecto tóxico. Un dato interesante es la relación entre un alto contenido de selenio en la dieta y una baja mortalidad por cáncer. El selenio es tóxico en dosis altas. La descomposición de los compuestos de selenio en los animales conduce a la liberación de dimetil selenio altamente tóxico, que tiene un olor a ajo. 52. Papel biológico de los elementos p del grupo VIIA. El uso de sus compuestos en medicina (flúor y cloro) Según el contenido en el cuerpo humano, el cloro (0,15%) pertenece a los macroelementos, mientras que los elementos restantes de este grupo son microelementos (contenido - 105 %). Los halógenos en forma de varios compuestos forman parte de los tejidos de humanos y animales. El cloro y el yodo son elementos insustituibles, mientras que el resto son constituyentes permanentes de los tejidos. La masa de flúor en el cuerpo humano es de unos 7 mg (~105 %). Los compuestos de flúor se concentran en el tejido óseo, las uñas y los dientes. La composición de los dientes incluye aproximadamente 0,01% de flúor, y la mayor parte cae sobre el esmalte, lo que se asocia con la presencia de fluorapatita escasamente soluble en él. La falta de flúor en el cuerpo conduce a la caries dental. El interés por la acción biológica del flúor está asociado principalmente al problema de las enfermedades dentales, ya que el flúor protege los dientes de la caries. La base mineral de los tejidos dentales (dentina) es la hidroxiapatita, la clorapatita y la fluorapatita. Muy a menudo, no la superficie exterior del diente, cubierta con una capa de esmalte, está sujeta a destrucción, sino las partes internas de la dentina, expuestas cuando el esmalte está dañado. Hay sugerencias de que mientras el esmalte está levemente dañado, la introducción de fluoruro de sodio promueve la formación de fluorapatita, lo que facilita la remineralización del daño que ha comenzado. El fluoruro de sodio NaF se utiliza en la práctica médica como agente externo tópico. El uso de NaF se basa en la formación de fluorapatito. Al mismo tiempo, también se produce la alcalinización del ambiente de la cavidad bucal, lo que contribuye a la neutralización de los ácidos producidos por las bacterias. No solo la falta, sino también el exceso de flúor es perjudicial. Cuando el contenido de flúor en el agua potable está por encima de la tasa máxima permitida (1,2 mg/l), el esmalte dental se vuelve quebradizo, se destruye fácilmente y aparecen otros síntomas de intoxicación crónica por flúor: aumento de la fragilidad ósea, deformidades óseas y agotamiento general del cuerpo. . La enfermedad que ocurre en este caso se llama fluorosis (fluorosis). El cuerpo humano contiene alrededor de 100 g (2790 mmol) de cloro. Los cloridios juegan un papel biológico importante. Activan algunas enzimas, crean un entorno favorable para la acción de las enzimas protolíticas del jugo gástrico, proporcionan flujos de iones a través de las membranas celulares y participan en el mantenimiento del equilibrio osmótico. El cloridio tiene un radio óptimo para la penetración a través de la membrana celular. Esto explica su participación conjunta con los iones Na y K en la creación de una determinada presión osmótica y la regulación del metabolismo agua-sal. El requerimiento diario de cloruro de sodio es de 5 a 10 g Como ya se mencionó, el NaCl es necesario para la producción de ácido clorhídrico en el estómago. Además del importante papel del ácido clorhídrico en el proceso de digestión, destruye varias bacterias patógenas (cólera, fiebre tifoidea). Si las bacterias ingresan al estómago con una gran cantidad de agua, debido a la dilución de HCl, no tiene un efecto antibacteriano y las bacterias sobreviven. Esto conduce a la enfermedad en el cuerpo. Por lo tanto, durante las epidemias, el agua cruda es especialmente peligrosa. Con una cantidad insuficiente de ácido clorhídrico en el estómago, el pH aumenta y se altera la digestión normal, lo que afecta gravemente la salud humana. Con acidez reducida del jugo gástrico, en la práctica médica se usa una solución diluida de ácido clorhídrico. Con inflamación del estómago (gastritis), úlcera péptica, aumenta la secreción de jugo gástrico, aumenta su acidez. 53. Papel biológico de los elementos p del grupo VIIA. El uso de sus compuestos en medicina (bromo, yodo) La masa de bromo en el cuerpo humano es de unos 7 mg. Se localiza principalmente en las glándulas endocrinas, principalmente en la glándula pituitaria. El papel biológico de los compuestos de bromo en el funcionamiento normal del cuerpo aún no se ha dilucidado suficientemente. Los compuestos de bromo inhiben la función de la glándula tiroides y aumentan la actividad de la corteza suprarrenal. Cuando se introducen bromuriones en el cuerpo, el sistema nervioso central es el más sensible. Los bromidiones se acumulan uniformemente en varias partes del cerebro y actúan de manera calmante con una mayor excitabilidad. Contribuyen a la restauración del equilibrio perturbado entre los procesos de excitación e inhibición. Los bromidiones se absorben fácilmente en el tracto gastrointestinal. La toxicidad de los bromuriones es baja. Debido a la excreción lenta del cuerpo (dentro de 30 a 60 días), pueden acumularse (acumularse), lo que conduce al desarrollo de una intoxicación crónica, que se denomina bromismo. Si aparecen signos de envenenamiento crónico por bromo, las preparaciones de bromuro deben suspenderse inmediatamente. Además, se administra una gran cantidad de cloruro de sodio (hasta 25 g por día) para aumentar la tasa de liberación de bromuriones (principio de Le Chatelier) y se prescribe una bebida abundante. Debido a las diferentes sensibilidades individuales, la dosificación de las preparaciones de bromo varía de 0,05 a 2,0 g. El yodo es uno de los elementos biogénicos esenciales y sus compuestos juegan un papel importante en los procesos metabólicos. El yodo afecta la síntesis de ciertas proteínas, grasas, hormonas. El cuerpo humano contiene alrededor de 25 mg de yodo. De la cantidad total de yodo en el cuerpo, más de la mitad está en la glándula tiroides. Casi todo el yodo contenido en esta glándula se encuentra en un estado ligado (en forma de hormonas) y solo alrededor del 1% se encuentra en forma de yodidiona. La glándula tiroides puede concentrar I-25 veces, en comparación con su contenido en plasma. La glándula tiroides secreta las hormonas tiroxina y triyodotironina. Una glándula tiroides poco activa (hipotiroidismo) puede estar asociada con una disminución de su capacidad para acumular iones de yoduro, así como con una falta de yodo en la dieta (bocio endémico). Con bocio endémico, se prescriben preparaciones de yodo: (yoduro de potasio KI o yoduro de sodio NaI) en dosis correspondientes a la necesidad humana diaria de yodo (0,001 g de yoduro de potasio). ¡En áreas donde hay una deficiencia de yodo, se agrega NaI o K a la sal de mesa para prevenir el bocio endémico! (1-2,5 g por 100 kg). Con el aumento de la actividad de la glándula tiroides (hipertiroidismo), debido a la síntesis excesiva de hormonas tiroideas, se observa un aumento anormal de la tasa de procesos metabólicos. Con la ineficacia de estos medicamentos para el tratamiento del hipertiroidismo, se usa una preparación de yodo radiactivo 131 I, cuya radiación destruye los folículos de la glándula tiroides y, por lo tanto, reduce el exceso de síntesis de hormonas. Todos los elementos del grupo VIIA son fisiológicamente activos, y el cloro y el yodo son indispensables para la actividad vital del organismo. El flúor se considera un elemento necesario para el normal funcionamiento de los organismos vivos. En el cuerpo, los halógenos son intercambiables, observándose casos tanto de sinergia como de antagonismo. 54. Aerosoles Los aerosoles son sistemas dispersos con un medio de dispersión gaseoso. Dependiendo del estado de agregación de la fase dispersa, se distinguen las nieblas: aerosoles con una fase líquida dispersa; humo, polvo - aerosoles con una fase sólida dispersa; smog - aerosoles con una fase dispersa mixta. Los tamaños de partícula de la fase dispersa de los aerosoles, de acuerdo con la clasificación de los sistemas dispersos, van desde 107 a 109 m Al igual que otros sistemas dispersos, los aerosoles se obtienen por dos métodos: condensación y dispersión. método de condensación La fase dispersa se obtiene a partir de la fase vapor por el proceso físico de condensación de moléculas a partículas de tamaño coloidal. métodos de dispersión Las partículas de tamaño coloidal se obtienen triturando agregados más grandes. Los aerosoles tienen la capacidad de dispersar la luz. Las partículas de la fase dispersa de los aerosoles no tienen una doble capa eléctrica, pero las partículas de la fase dispersa muy a menudo llevan carga eléctrica. La carga surge como resultado de la fricción o debido a la adsorción de iones de gas. Cabe señalar que muy a menudo las partículas de aerosol (pequeñas y grandes) llevan una carga de signo opuesto. La separación de partículas por tamaño en grandes volúmenes de aerosoles a lo largo de la altura puede dar lugar a la aparición de un campo eléctrico de alta intensidad. Por lo tanto, se produce una descarga eléctrica en las nubes: un rayo. Los aerosoles son sistemas cinética y agregativamente inestables, ya que no existe una doble capa eléctrica en el límite de fase. Por lo tanto, los aerosoles se coagulan a un ritmo más rápido que los liosoles. En medicina, los aerosoles se utilizan en terapia de inhalación, para proteger la piel dañada, desinfección. A veces, la formación de aerosoles es muy indeseable. Los aerosoles peligrosos para la salud humana se forman en las industrias de fundición, cerámica, durante la extracción y procesamiento de varios minerales (mineral, carbón, amianto, etc.). Los aerosoles que contienen partículas de carbón causan enfermedades pulmonares - antracosis, óxido de silicio (IV) - silicosis, amianto - asbestosis. Las enfermedades alérgicas son causadas por aerosoles formados por polen de plantas, polvo generado durante el procesamiento del algodón, lino, cáñamo, etc. Las suspensiones de bacterias, mohos y virus -aerosoles microbiológicos o bacterianos- son una de las vías de transmisión de enfermedades infecciosas: tuberculosis pulmonar , influenza, enfermedades respiratorias agudas. Los efectos nocivos para el cuerpo humano son producidos por los aerosoles formados durante la combustión del combustible, cuya fase dispersa consiste en hollín, alquitrán, ceniza e hidrocarburos cancerígenos. Los smogs son especialmente peligrosos para la salud. Por lo tanto, la lucha contra el polvo y la contaminación de la atmósfera es cada vez más importante. La purificación del aire a partir de aerosoles se logra mediante la introducción de tecnologías que no generan desechos: atrapando partículas de la fase dispersa mediante filtros, ciclones (colectores de polvo centrífugos) y un campo eléctrico de alto voltaje. 55. Emulsiones Las emulsiones son sistemas microheterogéneos en los que la fase dispersa y el medio de dispersión son líquidos inmiscibles. Los tamaños de partícula de la fase dispersa -gotas líquidas- oscilan entre 104 y 106 m. Según la concentración de la fase dispersa, se distinguen las emulsiones: diluidas, concentradas y muy concentradas. Dependiendo de la naturaleza de la fase dispersa y del medio de dispersión, existen: 1) emulsiones de un líquido no polar (DF) en un líquido polar (DS): emulsiones directas, llamadas emulsiones del primer tipo o emulsiones del tipo "aceite / agua" (O / W); 2) emulsiones de un líquido polar (DF) en uno no polar (DS) - emulsiones inversas, llamadas emulsiones del segundo tipo o emulsiones del tipo "agua / aceite" (W / O). Aquí, DF y DS son la fase dispersa y el medio de dispersión, respectivamente, "agua" es cualquier líquido polar, "aceite" es no polar. El tipo de emulsión se puede configurar: 1) medición de la conductividad eléctrica; 2) mezclar con un exceso de un líquido polar o no polar; 3) tinción con tintes solubles en agua o solubles en aceite; 4) humedeciendo y esparciendo una gota de emulsión sobre una superficie hidrófoba o hidrófila. Las emulsiones, al igual que otros sistemas dispersos, se pueden obtenidos por métodos de condensación y dispersión. Las emulsiones como dispersiones gruesas son sistemas cinética y agregativamente inestables. Cuando las gotas de la fase dispersa chocan, se fusionan (coalescencia). Como resultado de la coalescencia, la emulsión se separa en dos fases líquidas continuas. Los emulsionantes se utilizan para aumentar la estabilidad de las emulsiones. Estos son tensioactivos que, como resultado de la adsorción en el límite de fase, reducen el valor de la tensión interfacial y forman una película de adsorción mecánicamente fuerte. Si el emulsionante es un tensioactivo iónico, imparte una carga eléctrica del mismo signo a las gotitas de la fase dispersa y las gotitas se repelen entre sí. El tipo de emulsión formada depende de las propiedades del emulsionante. El medio de dispersión es siempre el líquido que mejor disuelve o humedece el emulsionante. Como emulsionantes se utilizan sales de ácidos grasos superiores, ésteres de ácidos grasos superiores y alcoholes polihídricos, aminas de cadena larga. Las emulsiones se encuentran ampliamente en la naturaleza. Las emulsiones son leche, crema, crema agria, mantequilla, yema de huevo, jugo de plantas lechosas, aceite crudo. Las emulsiones que contienen sustancias medicinales se usan ampliamente en medicina: el primer tipo (O/W) para uso interno, el segundo tipo (W/M) para uso externo. Se sabe que las grasas vegetales y animales son mejor absorbidas por el cuerpo en forma emulsionada (leche). En este caso, los derivados de los ácidos cólico y desoxicólico actúan como emulsionantes. A veces es necesario romper la emulsión resultante. La ruptura de una emulsión se llama demulsificación. La demulsificación se lleva a cabo subiendo y bajando la temperatura, exposición a un campo eléctrico, centrifugación, adición de electrolitos y sustancias especiales: desemulsionantes. Los desemulsionantes son tensioactivos con mayor actividad superficial que los emulsificantes, pero no tienen la capacidad de formar una capa de adsorción mecánicamente fuerte. 56. Surfactantes coloidales Los tensioactivos coloidales son sustancias que, con el mismo disolvente, según las condiciones, forman una solución verdadera y coloidal. Como ya se mencionó, las moléculas de surfactante son anfifílicas. Se componen de grupos no polares y polares. Los radicales no polares, por ejemplo, las cadenas de hidrocarburos, no tienen afinidad por el solvente polar: el agua, por los grupos polares es bastante alta. Hay una interacción hidrófoba (van der Waals) entre grupos no polares. Con una longitud de cadena de aproximadamente 1022 átomos de carbono debido a las interacciones hidrofóbicas de los radicales de hidrocarburos y la fuerte interacción de los grupos polares con el agua, las moléculas de surfactante se asocian y se forman las micelas. La concentración mínima de un tensioactivo coloidal, a partir de la cual se forman micelas en su solución, se denomina concentración micelar crítica (CMC). La forma de las micelas resultantes depende de la concentración de la solución. A bajas concentraciones de tensioactivo coloidal, se forman micelas esféricas. Un aumento en la concentración de una solución de tensioactivo coloidal conduce primero a un aumento en su número y luego a un cambio en la forma. A concentraciones más altas, en lugar de micelas esféricas, se forman micelas cilíndricas y lamelares. El valor de CMC depende de varios factores: la naturaleza del tensioactivo coloidal, la temperatura y la presencia de impurezas de sustancias extrañas, especialmente electrolitos. La CMC se puede determinar por las propiedades de la solución, que dependen del número y tamaño de las partículas cinéticamente activas, en particular, por los cambios en la presión osmótica, la tensión superficial, la conductividad eléctrica y las características ópticas. Dado que el tamaño de las partículas cinéticamente activas (iones, moléculas, micelas) y su número cambian durante la transición "solución verdadera - solución coloidal", aparece un punto de ruptura correspondiente a CMC en el gráfico "propiedad - concentración". Una de las propiedades más importantes de las soluciones de tensioactivos coloidales, por lo que son ampliamente utilizadas en diversos sectores de la economía nacional y en la medicina, es la solubilización. El mecanismo de solubilización consiste en la disolución de sustancias no polares en el núcleo hidrofóbico de las micelas. El fenómeno de la solubilización es ampliamente utilizado en varios sectores de la economía nacional: en la industria alimentaria, en la industria farmacéutica (para obtener formas líquidas de sustancias medicinales). En el sistema "agua - fosfolípido", la agitación y la agitación forman micelas esféricas - liposomas. Las moléculas de fosfolípidos forman una membrana bicapa en los liposomas, en la que los grupos polares se enfrentan al agua y los no polares se enfrentan entre sí. Los liposomas se pueden considerar como un modelo de membranas biológicas. Se pueden utilizar para estudiar la permeabilidad de las membranas y la influencia de varios factores sobre ella para varios compuestos. Los liposomas se usan ampliamente para la administración dirigida de medicamentos a ciertos órganos o áreas afectadas. Los liposomas pueden transportar fármacos al interior de las células. Las membranas liposomales se utilizan en estudios inmunológicos para estudiar la interacción entre anticuerpos y antígenos. Autores: Drozdova M.V., Drozdov
▪ Psicología General. Notas de lectura ▪ Derecho laboral de la Federación Rusa. Cuna ▪ Dinero. Crédito. Bancos. Notas de lectura
Cuero artificial para emulación táctil.
15.04.2024 Arena para gatos Petgugu Global
15.04.2024 El atractivo de los hombres cariñosos.
14.04.2024
▪ sección del sitio Manual del electricista. Selección de artículos ▪ artículo Estudiar, estudiar y estudiar. expresión popular ▪ artículo Boquilla y cigarrillo. Secreto de enfoque
Hogar | Biblioteca | Artículos | Mapa del sitio | Revisiones del sitio www.diagrama.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Ver otros artículos sección
Ver otros artículos sección 