
|
|
Notas de clase, hojas de trucos
Terapia hospitalaria. Apuntes de clase: brevemente, los más importantes
Directorio / Notas de clase, hojas de trucos tabla de contenidos
CONFERENCIA N° 1. Enfermedades del sistema cardiovascular. Reumatismo Reuma (Enfermedad de Sokolsky-Buyo) es una enfermedad inflamatoria sistémica del tejido conectivo con una localización predominante del proceso en el sistema cardiovascular, que se desarrolla en personas predispuestas (por regla general, estos son jóvenes) debido a una infección aguda con estreptococo β-hemolítico del grupo A. Esta definición de la enfermedad fue dada en 1989 por V. A. Nasonov. Refleja todos los rasgos característicos de la enfermedad: 1) daño predominante al sistema cardiovascular; 2) el papel de la herencia patológica; 3) la importancia de la infección estreptocócica. La esencia de la enfermedad radica en la derrota de todas las membranas del corazón, pero principalmente del miocardio y el endocardio con la aparición de deformación del aparato valvular: enfermedad cardíaca y el posterior desarrollo de insuficiencia cardíaca. La derrota de otros órganos y sistemas en el reumatismo es de importancia secundaria y no determina su gravedad y pronóstico posterior. Etiología. Los estreptococos betahemolíticos del grupo A causan daño al tracto respiratorio superior. Es por eso que la aparición del reumatismo, por regla general, va precedida de dolor de garganta, exacerbación de la amigdalitis crónica y una mayor cantidad de antígeno estreptocócico y anticuerpos antiestreptocócicos (ASL-O, ASG, ASA, antidesoxirribonucleasa B (anti-DNasa B)) se detectan en la sangre de los enfermos. Tal conexión con una infección estreptocócica previa es especialmente pronunciada en el curso agudo del reumatismo, acompañado de poliartritis. En el desarrollo del reumatismo intervienen la edad y los factores sociales (condiciones de vida desfavorables, desnutrición), también importa la predisposición genética (el reumatismo es una enfermedad de herencia poligénica, es bien conocida la existencia de familias “reumáticas”), que consiste en una respuesta hiperinmune a antígenos de estreptococos, la propensión de los pacientes a procesos autoinmunes e inmunocomplejos. Patogenesia. En el reumatismo se produce una respuesta inmunitaria compleja y diversa (reacciones de hipersensibilidad inmediata y retardada) a numerosos antígenos estreptocócicos. Cuando una infección ingresa al cuerpo, se producen anticuerpos antiestreptocócicos y se forman complejos inmunes (antígenos estreptocócicos + anticuerpos contra ellos + complemento), que circulan en la sangre y se depositan en el lecho microcirculatorio. Las toxinas y enzimas estreptocócicas también tienen un efecto perjudicial sobre el miocardio y el tejido conectivo. Debido a un defecto determinado genéticamente en el sistema inmunitario, los antígenos estreptocócicos y los complejos inmunitarios no se eliminan completa y rápidamente del cuerpo de los pacientes. Los tejidos de tales pacientes tienen una mayor tendencia a fijar estos complejos inmunes. Los anticuerpos de reacción cruzada también juegan un papel aquí, que, al formarse en antígenos estreptocócicos, pueden reaccionar con tejidos, incluidos los antígenos cardíacos del cuerpo. En respuesta, la inflamación se desarrolla sobre una base inmune (según el tipo de hipersensibilidad inmediata), mientras que los factores que implementan el proceso inflamatorio son las enzimas lisosomales de los neutrófilos que fagocitan los complejos inmunes y son destruidos al mismo tiempo. Este proceso inflamatorio se localiza en el tejido conjuntivo, predominantemente del sistema cardiovascular, y modifica las propiedades antigénicas de éste y del miocardio. Como resultado, los procesos autoinmunes se desarrollan de acuerdo con el tipo de hipersensibilidad de tipo retardado y los linfocitos que reaccionan con el tejido cardíaco se encuentran en la sangre de los pacientes. Estas células son de gran importancia en el origen de lesiones en órganos (principalmente el corazón). En el tejido conectivo con reumatismo, se producen cambios de fase: hinchazón mucoide - cambios fibrinoides - necrosis fibrinoide. La expresión morfológica de los trastornos inmunológicos son reacciones celulares: infiltración de linfocitos y plasmocitos, formación de granulomas reumáticos o Ashoff-Talalayevsky. El proceso patológico termina con la esclerosis. Otro sustrato morfológico del daño cardíaco en la cardiopatía reumática es una reacción inflamatoria inespecífica similar a la de las articulaciones y las serosas: hinchazón del tejido conjuntivo intermuscular, sudoración de fibrina, infiltración por neutrófilos y linfocitos. La enfermedad fluye en oleadas, agravada bajo la influencia de infecciones o factores inespecíficos (hipotermia, estrés físico, estrés, etc.), lo que se asocia con la naturaleza autoinmune del proceso patológico. Cuando el corazón está afectado, el proceso inflamatorio puede extenderse a todas las membranas del corazón (pancarditis) o de forma aislada a cada una de las membranas. Los cambios morfológicos en el reumatismo se encuentran principalmente en el miocardio, por lo que es la miocarditis en las primeras etapas la que determina el cuadro clínico. Los cambios inflamatorios en el endocardio (valvulitis, endocarditis verrugosa), daño a los filamentos tendinosos y al anillo fibroso se detectan clínicamente 6-8 semanas después del ataque de reumatismo. La válvula mitral es la más comúnmente afectada, seguida de las válvulas aórtica y tricúspide. La válvula pulmonar en el reumatismo casi nunca se ve afectada. Clasificación del reumatismo. Actualmente, se ha adoptado la clasificación y nomenclatura del reumatismo, aprobada en 1990 por la Sociedad Científica de Reumatología de toda la Unión, que refleja la fase del proceso, las características clínicas y anatómicas del daño a órganos y sistemas, la naturaleza del curso. y el estado funcional del sistema cardiovascular (ver Tabla 1). Cuadro clínico. Todas las manifestaciones de la enfermedad se pueden dividir en cardíacas y extracardíacas. Desde estas posiciones se puede describir el cuadro clínico de la enfermedad. Etapa I: se revela la conexión de la enfermedad con la infección transferida. En casos típicos, 1-2 semanas después de un dolor de garganta o una enfermedad respiratoria aguda, la temperatura corporal aumenta, a veces hasta 38-40 ° C, con fluctuaciones durante el día dentro de 1-2 ° C y sudor fuerte (generalmente sin escalofríos). Con ataques repetidos de reumatismo, a menudo se desarrolla una recurrencia de la enfermedad bajo la influencia de factores no específicos (como hipotermia, sobrecarga física, cirugía). Tabla 1 Clasificación del reumatismo
La manifestación más común del reumatismo es el daño cardíaco: cardiopatía reumática: daño simultáneo del miocardio y el endocardio. En los adultos, la cardiopatía reumática no es grave. Los pacientes se quejan de dolor leve o molestias en la región del corazón, una ligera dificultad para respirar durante el ejercicio, interrupciones o palpitaciones son mucho menos comunes. Estos síntomas no son específicos de la cardiopatía reumática y se pueden observar en otros trastornos cardíacos. La naturaleza de tales quejas se especifica en las etapas posteriores de la búsqueda de diagnóstico. La cardiopatía reumática en pacientes jóvenes, por regla general, es grave: desde el comienzo de la enfermedad, se observa una grave dificultad para respirar durante el ejercicio y en reposo, dolor constante en el corazón y palpitaciones. Puede haber síntomas de insuficiencia circulatoria en un círculo grande en forma de edema y pesadez en el hipocondrio derecho (debido a un aumento en el hígado). Todos estos síntomas apuntan a una miocarditis difusa grave. La pericarditis, así como las manifestaciones extracardíacas del reumatismo, son raras. Con el desarrollo de pericarditis seca, los pacientes solo notan dolor constante en la región del corazón. Con la pericarditis exudativa, caracterizada por la acumulación de exudado seroso-fibrinoso en el saco cardíaco, el dolor desaparece, ya que las capas pericárdicas inflamadas se separan por el exudado acumulado. Aparece dificultad para respirar, que aumenta con la posición horizontal del paciente. Debido a la dificultad de flujo de sangre al corazón derecho, aparece congestión en un gran círculo (edema, pesadez en el hipocondrio derecho por aumento del hígado). Lo más característico del reumatismo es la derrota del sistema musculoesquelético en forma de poliartritis reumática. Los pacientes notan un dolor que aumenta rápidamente en las articulaciones grandes (rodilla, codo, hombro, tobillo, muñeca), la imposibilidad de movimientos activos, un aumento en el volumen de las articulaciones. Hay un efecto rápido después del uso de ácido acetilsalicílico y otros medicamentos antiinflamatorios no esteroideos con alivio durante varios días, a menudo varias horas de todas las manifestaciones articulares. Las lesiones reumáticas de los riñones también son extremadamente raras, detectadas solo en el estudio de la orina. Las lesiones del sistema nervioso en el reumatismo son raras, principalmente en niños. Las quejas son similares a las de la encefalitis, meningoencefalitis, vasculitis cerebral de una etiología diferente. Solo la "pequeña corea" merece atención, que ocurre en niños (más a menudo niñas) y se manifiesta por una combinación de labilidad emocional e hipercinesia violenta del tronco, las extremidades y los músculos mímicos. El síndrome abdominal (peritonitis) ocurre casi exclusivamente en niños y adolescentes con reumatismo primario agudo. Se caracteriza por aparición súbita, fiebre y signos de disfagia (se producen cólicos difusos o localizados, náuseas, vómitos, retención o deposiciones frecuentes). En la etapa II de la búsqueda diagnóstica, la detección de signos de daño cardíaco tiene poca importancia. En la cardiopatía reumática primaria, el corazón generalmente no está agrandado. La auscultación revela un tono I amortiguado, a veces la aparición de un tono III, un soplo sistólico suave en el vértice. Esta sintomatología se debe a cambios en el miocardio. Sin embargo, un aumento en la intensidad, duración y persistencia del ruido puede indicar la formación de insuficiencia de la válvula mitral. Es posible juzgar con confianza la formación del defecto 6 meses después del inicio del ataque, manteniendo la imagen auscultatoria anterior. En caso de daño de la válvula aórtica, se puede escuchar un soplo protodiastólico en el punto de Botkin y se puede conservar la sonoridad del tono II. Solo muchos años después, después de la formación de insuficiencia valvular aórtica severa, este signo auscultatorio se une al debilitamiento (o ausencia) del tono II en el espacio intercostal II a la derecha. En pacientes con poliartritis, se observa deformidad articular debido a la inflamación de la membrana sinovial y los tejidos periarticulares, dolor a la palpación de la articulación. En la zona de las articulaciones afectadas pueden aparecer nódulos reumáticos, que se localizan en antebrazos y espinillas, por encima de las prominencias óseas. Estas son formaciones pequeñas, densas e indoloras que desaparecen bajo la influencia del tratamiento. El eritema anular (signo casi patognomónico del reumatismo) son elementos rosados en forma de anillo, que no pican, que se localizan en la piel de la superficie interna de brazos y piernas, abdomen, cuello y tronco. Este síntoma es extremadamente raro (en 1-2% de los pacientes). La neumonía reumática y la pleuresía tienen los mismos signos físicos que enfermedades similares de etiología banal. En general, las lesiones no cardíacas se observan actualmente muy raramente, en personas jóvenes con un curso agudo de reumatismo (en presencia de alta actividad - grado III). Se expresan con poca nitidez, rápidamente susceptibles de revertir el desarrollo durante la terapia antirreumática. En la etapa III de la búsqueda de diagnóstico, los datos de laboratorio y estudios instrumentales nos permiten establecer la actividad del proceso patológico y aclarar el daño al corazón y otros órganos. Con un proceso reumático activo, los exámenes de laboratorio revelan una fase aguda inespecífica y parámetros inmunológicos alterados. Indicadores de fase aguda: neutrofilia con un cambio de la fórmula de sangre de leucocitos hacia la izquierda; un aumento en el contenido de 2-globulinas, seguido de un aumento en el nivel de - globulinas; aumento del contenido de fibrinógeno; la aparición de proteína C reactiva; La VSG aumenta. En cuanto a los parámetros inmunológicos, aumentan los títulos de anticuerpos antiestreptocócicos (antihialuronidasa y antiestreptoquinasa más de 1:300, anti-O-estreptolisina más de 1:250). El ECG a veces revela alteraciones del ritmo y la conducción: bloqueo auriculoventricular transitorio (más a menudo grado I - prolongación del intervalo P-Q, con menos frecuencia - grado II), extrasístole, ritmo auriculoventricular. En varios pacientes se registra una disminución de la amplitud de la onda T hasta la aparición de dientes negativos. Estas alteraciones del ritmo y la conducción son inestables y desaparecen rápidamente en el curso de la terapia antirreumática. Si los cambios en el ECG son persistentes y permanecen después de la eliminación de un ataque reumático, entonces se debe pensar en el daño orgánico del miocardio. Durante el examen fonocardiográfico, se especifican los datos de la auscultación: debilitamiento del XNUMXer tono, aparición del XNUMXer tono, soplo sistólico. En el caso de la formación de una enfermedad cardíaca, aparecen cambios en la PCG que corresponden a la naturaleza de la lesión valvular. Radiografía en el primer ataque de reumatismo, no se detectan cambios. Solo con la cardiopatía reumática grave en niños y jóvenes se puede detectar un aumento en el corazón debido a la dilatación del ventrículo izquierdo. Con el desarrollo de la enfermedad cardíaca reumática en el contexto de una enfermedad cardíaca existente, la imagen de rayos X corresponderá a un defecto específico. Un estudio ecocardiográfico en la cardiopatía reumática primaria no revela cambios característicos. Solo en la cardiopatía reumática grave con signos de insuficiencia cardíaca en el ecocardiograma se muestran signos que indican una disminución de la función contráctil del miocardio y expansión de las cavidades del corazón. diagnósticos. Reconocer el reumatismo primario es muy difícil, ya que sus manifestaciones más comunes, como la poliartritis y el daño cardíaco, son inespecíficas. Actualmente, los criterios mayores y menores para el reumatismo de la American Heart Association son los más utilizados. La combinación de dos criterios mayores o uno mayor y dos menores indica una mayor probabilidad de reumatismo solo en casos de infección estreptocócica previa. Con la aparición gradual del reumatismo, el diagnóstico sindrómico propuesto por A. I. Nesterov en 1973 (ver Tabla 2) importa: síndrome clínico y epidemiológico (conexión con infección estreptocócica); síndrome clínico e inmunológico (signos de convalecencia incompleta, artralgia, títulos elevados de anticuerpos antiestreptocócicos, así como la detección de disproteinemia e indicadores de fase aguda); síndrome cardiovascular (detección de carditis, así como lesiones extracardiacas) (ver Tabla 3). Tabla 2 Criterios para el reumatismo
Tabla 3 Grados de reumatismo
Diagnóstico diferencial. La poliartritis reumática debe diferenciarse de las no reumáticas (ver Tabla 4). Tabla 4 Poliartritis reumática y no reumática
Las siguientes enfermedades y síntomas son sospechosos en relación con el reumatismo: 1) endocarditis; 2) miocarditis; 3) pericarditis; 4) defectos cardíacos; 5) alteraciones del ritmo y la conducción; 6) insuficiencia cardíaca aguda y crónica; 7) estado subfebril prolongado; 8) eritema nudoso; 9) eritema anular; 10) nódulos subcutáneos; 11) poliartritis alérgica aguda; 12) corea. Ninguno de los síndromes clínicos enumerados anteriormente es específico de esta enfermedad. Solo una combinación de patología cardíaca con al menos un síntoma principal extracardíaco de reumatismo da motivos para sospechar reumatismo. El reconocimiento de la enfermedad cardíaca reumática en sí se lleva a cabo sobre la base de síntomas como dificultad para respirar y palpitaciones, fatiga, dolor en la región del corazón y alteraciones del ritmo cardíaco, ruidos, a veces ritmo de galope y debilitamiento del tono I. De gran importancia en el diagnóstico de la cardiopatía reumática es la identificación de la patología en el ECG. En el reumatismo, es causado por miocarditis, pericarditis y defectos cardíacos. La observación dinámica permite distinguir los cambios irreversibles característicos de la hipertrofia de varias partes del corazón en caso de defectos, de los transitorios, lo que indica el proceso inflamatorio actual. tratamiento. Un efecto positivo en el tratamiento, así como la prevención del desarrollo de enfermedades cardíacas, se ve facilitado por el diagnóstico precoz y el tratamiento individual, que se basa en una evaluación del tipo de curso, la actividad del proceso patológico, la gravedad de la carditis, y la variante de valvulopatía. Son importantes el estado del miocardio, otros tejidos y órganos, la profesión del paciente, etc. Así, todo el complejo de tratamiento del reumatismo consiste en terapia antimicrobiana y antiinflamatoria, medidas que tienen como objetivo restaurar la homeostasis inmunológica. Se recomienda utilizar una dieta equilibrada racional, centrarse en la adaptación a la actividad física, preparación para el trabajo, tratamiento quirúrgico oportuno de pacientes con defectos cardíacos complejos. A todos los pacientes durante la fase activa del reumatismo se les muestra penicilina (1-200 UI por 000 dosis por día, cada 1 horas), que tiene un efecto bactericida en todos los tipos de estreptococos A. El curso del tratamiento es de 500 semanas durante la fase activa del reumatismo, en el futuro, se requiere una transferencia al medicamento prolongado bicilina-000 (6 unidades). Con intolerancia a la penicilina, se puede prescribir eritromicina 4 mg 2 veces al día. Los medicamentos con efecto antiinflamatorio, que se utilizan en el tratamiento moderno de la fase activa del reumatismo, son los glucocorticosteroides, los salicílicos, los derivados del indol, los derivados del ácido fenilacético, etc. La prednisolona se usa a 20-30 mg por día (durante 2 semanas, luego la dosis se reduce en 2,5-5 mg cada 5-7 días, por un total de 1,5-2 meses) para primaria y recurrente con III y II grado de actividad del proceso de cardiopatía reumática, con poliserositis y corea, con desarrollo de insuficiencia cardíaca por carditis activa. En este último caso, se prefiere la triamcinolona en dosis de 12-16 mg por día, ya que tiene poca capacidad para alterar el equilibrio electrolítico. Los agentes corticoides afectan el metabolismo del agua y la sal, por lo tanto, se debe usar cloruro de potasio 3-4 g / día, panangin y otros en el tratamiento, con retención de líquidos: antagonistas de la aldosterona (veroshpiron hasta 6-8 tabletas por día), diuréticos (lasix 40 -80 mg/día, furosemida 40-80 mg/día, etc.), con euforia - tranquilizantes, etc. Los medicamentos antiinflamatorios no esteroideos también se usan ampliamente para el reumatismo: las dosis promedio de ácido acetilsalicílico son de 3 a 4 g por día, con menos frecuencia de 5 g por día o más. Indicaciones para el uso de salicilatos: 1) grado mínimo de actividad, leve severidad de carditis, principalmente miocarditis; 2) tratamiento a largo plazo del reumatismo, sospecha de un curso latente; 3) tratamiento prolongado con una disminución en la actividad del curso del proceso y el cese del uso de corticosteroides, así como después de la finalización del tratamiento en un hospital; 4) enfermedad cardíaca reumática recurrente que ocurre en el contexto de defectos cardíacos graves e insuficiencia circulatoria, ya que los salicilatos no pueden retener líquidos, previenen la formación de coágulos de sangre y son estimulantes del centro respiratorio; 5) reducir la probabilidad de exacerbación del reumatismo en los períodos de primavera y otoño, así como después de sufrir infecciones intercurrentes (junto con antibióticos). El ácido acetilsalicílico se usa 1 g 3-4 veces al día después de las comidas durante 1-3 meses o más con tolerancia normal y sujeto al control de los efectos secundarios. El uso exitoso del derivado del ácido indolacético - indometacina en el reumatismo durante más de 20 años. Tiene un efecto terapéutico pronunciado: los síntomas subjetivos de carditis (cardialgia, palpitaciones, dificultad para respirar) desaparecen entre los días 8 y 10 de la terapia y los signos objetivos, entre los días 14 y 16. La desaparición de la poliartritis y la poliserositis ocurre aún más rápido. En el tratamiento del reumatismo, es importante una combinación de tres etapas principales: hospital - clínica - centro turístico. En el hospital, el tratamiento se lleva a cabo con los medicamentos enumerados anteriormente. Después de reducir la actividad del reumatismo y normalizar la condición del paciente, se transfieren a la etapa II: tratamiento en un sanatorio reumatológico. El objetivo principal de esta etapa es la continuación del tratamiento con medicamentos antiinflamatorios no esteroideos, que se seleccionan individualmente en el hospital, derivados de aminoquinolina, bicilina-5, rehabilitación. La etapa III incluye la observación del dispensario y el tratamiento preventivo. Esta es la implementación de medidas terapéuticas dirigidas a la eliminación final del curso activo del proceso reumático; realizar tratamiento sintomático de trastornos circulatorios en pacientes con enfermedades del corazón; resolver problemas de rehabilitación, capacidad de trabajo y empleo; implementación de la prevención primaria del reumatismo y la prevención secundaria de la recurrencia de la enfermedad. CONFERENCIA N° 2. Enfermedades del sistema cardiovascular. Miocardiopatía. Miocardiopatía dilatada 1. Miocardiopatía Miocardiopatía - lesiones miocárdicas primarias aisladas de naturaleza no inflamatoria de etiología desconocida (idiopática), que no estén asociadas a defectos valvulares o cortocircuitos intracardíacos, hipertensión arterial o pulmonar, enfermedad coronaria o enfermedades sistémicas (tales como: colagenosis, amiloidosis, hemocromatosis, etc.), y en la etapa final de la enfermedad, se desarrolla insuficiencia cardíaca congestiva grave y alteraciones complejas del ritmo cardíaco y la permeabilidad. La clasificación de las miocardiopatías es la siguiente: 1) miocardiopatía dilatada: a) idiopático; b) tóxico; c) infeccioso; d) con colagenosas; 2) hipertrófica; 3) restrictivo; 4) displasia arrítmica del ventrículo derecho; 5) una combinación de uno de los 4 tipos de miocardiopatías con hipertensión arterial. 2. Miocardiopatía dilatada La miocardiopatía dilatada (MCD) es una enfermedad del músculo cardíaco caracterizada por una expansión difusa de todas las cámaras del corazón (principalmente el ventrículo izquierdo), en la que la patología de la función de bombeo del corazón está en primer plano y, como resultado , insuficiencia cardíaca crónica (de ahí que el segundo nombre sea congestivo, cuando el corazón no puede bombear sangre por completo y se "estanca" en los tejidos y órganos del cuerpo). La pared muscular del corazón permanece sin cambios o hipertrofiada en diversos grados. Las enfermedades y los factores que precedieron al desarrollo de DCM se describen en la siguiente tabla (ver Tabla 5). Tabla 5 Enfermedades y factores que precedieron al desarrollo de DCMP
Esta es la forma más común de daño al músculo cardíaco. La incidencia es de 5-8 casos por 100 habitantes por año. No hay antecedentes familiares claros para estos pacientes. Los hombres se enferman 000 o 2 veces más a menudo que las mujeres. Patogenesia. Como resultado del proceso inflamatorio en el músculo cardíaco (miocarditis), se produce la muerte de células individuales en sus distintas partes. En este caso, la inflamación es de naturaleza viral y las células afectadas por el virus se convierten en agentes extraños para el organismo. En consecuencia, cuando aparecen antígenos en el cuerpo, se desarrolla un complejo de reacciones de respuesta inmune destinadas a su destrucción. Poco a poco, las células musculares muertas son reemplazadas por tejido conectivo, que no tiene la capacidad de extensibilidad y contractilidad inherente al miocardio. Como resultado de la pérdida de funciones básicas del miocardio, el corazón pierde su capacidad de funcionar como bomba. En respuesta a esto (como reacción compensatoria), las cámaras del corazón se expanden (es decir, se dilatan) y en la parte restante del miocardio se produce un engrosamiento y compactación (es decir, se desarrolla su hipertrofia). Para aumentar el suministro de oxígeno a los órganos y tejidos del cuerpo, se produce un aumento persistente de la frecuencia cardíaca (taquicardia sinusal). Esta respuesta compensatoria solo mejora temporalmente la función de bombeo del corazón. Sin embargo, las posibilidades de dilatación e hipertrofia miocárdica están limitadas por la cantidad de miocardio viable y son individuales para cada caso específico de la enfermedad. Con la transición del proceso a la etapa de descompensación, se desarrolla insuficiencia cardíaca crónica. Sin embargo, en esta etapa entra en juego otro mecanismo compensatorio: los tejidos del cuerpo aumentan la extracción de oxígeno de la sangre en comparación con un cuerpo sano. Pero este mecanismo es insuficiente, ya que una disminución en la función de bombeo del corazón conduce a una disminución en el suministro de oxígeno a los órganos y tejidos, que es necesario para su funcionamiento normal, mientras que aumenta la cantidad de dióxido de carbono en ellos. En 2/3 de los pacientes en las cavidades de los ventrículos en las últimas etapas de la enfermedad, se forman trombos parietales (debido a una disminución en la función de bombeo del corazón, así como a una contracción desigual del miocardio en las cavidades del corazón) ), seguido del desarrollo de embolia en la circulación pulmonar o sistémica. Cambios patohistológicos y patomorfológicos en el corazón. La forma del corazón se vuelve esférica, su masa aumenta de 500 a 1000 g, principalmente debido al ventrículo izquierdo. El miocardio se vuelve flácido, opaco, con capas blanquecinas notables de tejido conectivo, hay una alternancia característica de cardiomiocitos hipertrofiados y atróficos. Microscópicamente, se detecta fibrosis difusa, se puede combinar tanto con atrofia como con hipertrofia de los cardiomiocitos, en los que hay un aumento significativo en el volumen de los núcleos, el número de mitocondrias, hiperplasia del aparato de Golgi, un aumento en el número de miofibrillas. , libre y asociado con los ribosomas del retículo endoplásmico, una gran cantidad de gránulos de glucógeno. Cuadro clínico. No hay signos específicos de la enfermedad. El cuadro clínico es polimórfico y está determinado por: 1) síntomas de insuficiencia cardíaca; 2) alteraciones del ritmo y la conducción; 3) síndrome tromboembólico. Todos estos fenómenos se desarrollan en la etapa terminal de la enfermedad, por lo que el reconocimiento de la MCD antes de la aparición de estos síntomas presenta importantes dificultades. En la mayoría de los casos, el pronóstico de la enfermedad está determinado por la derrota del ventrículo izquierdo del corazón. Antes del inicio de la insuficiencia cardíaca, la DCM está latente. Las quejas más frecuentes de insuficiencia cardíaca ya iniciada son quejas de disminución del rendimiento, aumento de la fatiga, dificultad para respirar durante el esfuerzo y luego en reposo. Por la noche, tiene tos seca (el equivalente al asma cardíaca), más tarde, ataques de asma típicos. Los pacientes presentan dolor anginoso característico. Con el desarrollo de congestión en la circulación sistémica, aparece pesadez en el hipocondrio derecho (debido al agrandamiento del hígado), hinchazón de las piernas. diagnósticos. Al diagnosticar la enfermedad, un signo importante es un agrandamiento significativo del corazón (no hay signos de valvulopatía ni hipertensión arterial). La cardiomegalia se manifiesta por la expansión del corazón en ambas direcciones, determinada por la percusión, así como por un desplazamiento del impulso apical hacia la izquierda y hacia abajo. En casos graves, se escuchan ritmo de galope, taquicardia y sonidos de relativa insuficiencia de las válvulas mitral o tricúspide. En el 20% de los casos se desarrolla fibrilación auricular. La presión arterial suele ser normal o ligeramente elevada (debido a insuficiencia cardíaca). Los estudios bioquímicos de sangre y orina pueden detectar diversas sustancias tóxicas, así como deficiencias vitamínicas. Los métodos de investigación instrumental permiten detectar: 1) signos de cardiomegalia; 2) cambios en los indicadores de la hemodinámica central; 3) alteraciones del ritmo y la conducción. No hay cambios característicos en el ECG o los cambios son inespecíficos. Estos son signos de un aumento del tamaño del corazón, alteraciones de la conducción en forma de bloqueo de la rama anterior de la rama izquierda del haz auriculoventricular (haz de His) o bloqueo completo de la rama izquierda (15% de los casos). ); así como taquicardia sinusal persistente (la frecuencia cardíaca a menudo supera los 100 latidos por minuto). El fonocardiograma confirma los datos auscultatorios en forma de ritmo de galope, una detección bastante frecuente de soplo sistólico (debido a insuficiencia relativa de la válvula mitral o tricúspide). Con congestión en la circulación pulmonar, se revela un acento del tono II. La radiografía revela un aumento significativo en los ventrículos (a menudo en combinación con un aumento moderado en la aurícula izquierda) y estasis de sangre en la circulación pulmonar (pequeña). Las violaciones en la circulación pulmonar se manifiestan por un aumento en el patrón vascular pulmonar, así como por la aparición de trasudado en las cavidades pleurales, que se forma debido al aumento de la presión en los vasos de los pulmones. El método de ecocardiografía es uno de los principales métodos en el diagnóstico de la enfermedad. La ecocardiografía ayuda a detectar dilatación de ambos ventrículos, hipocinesia de la pared posterior del ventrículo izquierdo, movimiento paradójico del tabique interventricular durante la sístole. Además, la ecocardiografía le permite aclarar el aumento en la amplitud de movimiento de las valvas de la válvula mitral sin cambios. Los estudios instrumentales adicionales no son obligatorios para hacer un diagnóstico, pero sus resultados nos permiten detallar el grado de trastornos hemodinámicos y la naturaleza de los cambios morfológicos en el miocardio. Se realiza un estudio con radioisótopos del corazón (gammagrafía miocárdica) para aclarar el estado de la función de bombeo del corazón, así como para determinar las zonas del miocardio muerto. El estudio de los indicadores de la hemodinámica central revela un minuto y un volumen sistólico bajos (índices minuto y sistólico), un aumento de la presión en la arteria pulmonar. Angiocardiográficamente, se detectan los mismos cambios que en el ecocardiograma. La biopsia de miocardio vivo no es informativa para determinar la etiología de la miocardiopatía. En algunos casos, la biopsia puede detectar un antígeno viral o un aumento en el contenido de LDH, así como un deterioro en la producción de energía por parte de las mitocondrias. Sin embargo, este método quirúrgico se puede utilizar para aclarar la etiología de la enfermedad y la terapia adicional. La manipulación se lleva a cabo de la siguiente manera: bajo anestesia local, se perforan (perforan) una arteria y una vena grandes, luego se pasa un instrumento especial con unas tijeras pequeñas al final a lo largo de su curso hasta el corazón. Cuando la biopsia de miocardio se combina con la angiografía coronaria (inyección de un agente de contraste en las arterias coronarias que irrigan el corazón), es posible excluir la enfermedad de las arterias coronarias en un paciente como una de las enfermedades que tiene síntomas similares a la DCM. Estos dos estudios se realizan bajo control de televisión de rayos X. Diagnóstico diferencial. Se realiza principalmente para miocarditis y distrofias miocárdicas, es decir, para aquellas afecciones que a veces se denominan irrazonablemente miocardiopatías secundarias. La biopsia de miocardio brinda una ayuda significativa en el diagnóstico diferencial de la miocardiopatía dilatada y la enfermedad cardíaca, que ocurre con un aumento pronunciado de la misma: 1) con miocarditis difusa severa, la infiltración celular del estroma se encuentra en combinación con cambios distróficos y necróticos en los cardiomiocitos; 2) con la amiloidosis primaria que ocurre con daño cardíaco (la denominada variante cardiopática de la amiloidosis primaria), hay un depósito significativo de amiloide en el tejido intersticial del miocardio, combinado con atrofia de las fibras musculares; 3) con hemocromatosis (una enfermedad causada por una violación del metabolismo del hierro), se encuentran depósitos de pigmento que contiene hierro en el miocardio, se observan varios grados de distrofia y atrofia de las fibras musculares, y se observa proliferación de tejido conectivo. Como variante de la MCD, se pueden considerar las miocardiopatías inducidas por fármacos y tóxicas. Numerosos agentes pueden causar daño tóxico al miocardio: etanol, emetina, litio, cadmio, cobalto, arsénico, isoproterenol y otros venenos. Los cambios histopatológicos en los tejidos del músculo cardíaco aparecen como distrofias focales. En el futuro, se produce el desarrollo de microinfartos, acompañados de una reacción inflamatoria periférica. El ejemplo más llamativo de miocardiopatía tóxica es la miocardiopatía, que ocurre en personas que consumen cerveza en exceso. Se debe a la presencia de cobalto en ella, que se añade a la cerveza para mejorar la espuma. El cobalto bloquea la acción de la vitamina B.1, y también afecta directamente el cambio en los procesos enzimáticos de la célula. En la etapa aguda del curso de la miocardiopatía por cobalto, se observa la presencia de degeneración hidrópica y grasa, destrucción de orgánulos intracelulares y necrosis focal de cardiomiocitos. En el futuro, se desarrolla fibrosis intersticial difusa o de foco pequeño, el resultado final es la formación de cicatrices extensas. La miocardiopatía por cobalto es más grave que la miocardiopatía alcohólica. Si el diagnóstico se realiza a tiempo, se observa una curación clínica de los pacientes. Miocardiopatía alcohólica. El etanol tiene un efecto tóxico directo sobre los cardiomiocitos. Además, con la intoxicación crónica por etilo, a menudo hay falta de nutrición. Se ha comprobado que el alcohol conduce a la conmutación de los ácidos grasos en los cardiomiocitos, ya que hay falta de energía, necesaria para su actividad. El acetaldehído, formado durante el metabolismo del alcohol, puede ser un factor en los efectos tóxicos directos sobre la síntesis de proteínas. El alcoholismo también se acompaña de la activación de virus latentes. Macroscópicamente, el miocardio es fofo, arcilloso, a veces se observan pequeñas cicatrices. Las arterias coronarias están intactas. El examen microscópico muestra una combinación de distrofia (hidrópica y grasa), atrofia e hipertrofia de cardiomiocitos, posiblemente la presencia de focos de lisis y esclerosis de cardiomiocitos. Las áreas afectadas del miocardio contrastan con las que no han cambiado. El examen con microscopio electrónico de muestras de biopsia de corazón muestra expansión quística del retículo sarcoplásmico y el sistema T de los cardiomiocitos, que es característico de la miocardiopatía alcohólica. Complicaciones de la miocardiopatía alcohólica: muerte súbita como resultado de fibrilación ventricular o insuficiencia cardíaca crónica, síndrome tromboembólico. tratamiento. La terapia de las miocardiopatías es una tarea difícil, ya que se desconocen las causas específicas de su aparición. Los principios generales del tratamiento de la MCD no difieren significativamente del tratamiento de la insuficiencia cardíaca crónica. En los casos de MCD secundaria, se trata adicionalmente la enfermedad previa (enfermedad de las válvulas cardíacas, etc.) y se toman todas las medidas para eliminar las causas de la MCD. En esencia, podemos hablar sobre el tratamiento de pacientes con miocardiopatía solo cuando aparecen signos clínicos. En la insuficiencia cardíaca, los glucósidos cardíacos son ineficaces. Los pacientes desarrollan rápidamente intolerancia a las drogas (intoxicación por glucósidos) y, por lo tanto, es necesario usar glucósidos que se excretan rápidamente del cuerpo (estrofantina, isolanida). Los vasodilatadores periféricos son bastante efectivos, especialmente con el síndrome anginoso concomitante (nitrong, sustak, nitrosorbide). Estos medicamentos deben prescribirse para la insuficiencia cardíaca grave, difícil de tratar con glucósidos y diuréticos. Con el síndrome anginoso, es necesario usar medicamentos antianginosos, preferiblemente nitratos prolongados (sustak, nitrong, nitrosorbid). Los adrenobloqueadores son efectivos (se prescriben en ausencia de signos de insuficiencia cardíaca). De los métodos modernos de tratamiento quirúrgico de DCMP, el más efectivo es el trasplante de corazón (trasplante). Sin embargo, las posibilidades de llevar a cabo esta operación son significativamente limitadas. Por esta razón, como alternativa al trasplante de corazón en el tratamiento moderno, para aumentar la esperanza de vida de los pacientes con DCMP, se han desarrollado y se están realizando cirugías reconstructivas, que tienen como objetivo eliminar la insuficiencia de las válvulas cardíacas mitral y tricúspide. La eliminación operativa de la insuficiencia de estas válvulas permite durante algún tiempo "ralentizar" el inicio de la etapa final de la enfermedad. Otra alternativa al trasplante cardíaco en pacientes con MCD era la extirpación parcial del ventrículo izquierdo para reducir su tamaño (operación de Baptiste). No hace mucho tiempo, para el tratamiento de pacientes con DCMP, se desarrollaron modelos especiales de marcapasos que le permiten sincronizar el trabajo de los ventrículos del corazón. Esto conduce a una mejora en el llenado de sangre de los ventrículos del corazón y un aumento en la función de bombeo del corazón. Se debe considerar un problema separado MCD en niños, que es de 5 a 10 casos por 100 niños por año. Es de destacar que la enfermedad puede desarrollarse en diferentes grupos de edad, incluidos los bebés. Los datos obtenidos en el estudio de un grupo de niños son los siguientes: los pacientes recibieron 000 opciones de tratamiento (monoterapia con prednisolona, monoterapia con digoxina o prednisolona + digoxina). La eficacia del tratamiento se evaluó según los siguientes criterios: se determinó la frecuencia cardíaca antes y después del tratamiento, la frecuencia respiratoria, el estado de la fracción de eyección y la fracción de contractilidad. El análisis de los resultados obtenidos muestra que el mayor efecto en el tratamiento de la miocardiopatía dilatada en niños pequeños se consigue con una combinación de corticoides y glucósidos (prednisolona y digoxina). Después de completar el ciclo principal de tratamiento (prednisolona administrada 3 mg/kg por día durante 2 días, digoxina), hubo una marcada disminución de la frecuencia cardíaca, una disminución de la dificultad para respirar. En el contexto de la monoterapia con prednisolona, se produce una disminución de la frecuencia cardíaca. La monoterapia con digoxina conduce a una disminución de la taquicardia y la disnea. Dada la desaconsejabilidad de prescribir citostáticos en niños pequeños, ya que se observó un número significativo de complicaciones del tratamiento, en pediatría es más óptimo utilizar glucósidos cardíacos de acción prolongada en combinación con hormonas corticoides en la miocardiopatía dilatada. Prevención. La prevención de la MCD implica evitar el alcohol, la cocaína y controlar cuidadosamente los parámetros cardíacos durante la quimioterapia tumoral. Es útil para endurecer el cuerpo desde una edad temprana. La abstinencia completa del alcohol en la DCM alcohólica mejora la contractilidad del corazón y puede eliminar la necesidad de un trasplante de corazón. El hecho de que en la mayoría de los casos el diagnóstico ocurra en la etapa de insuficiencia cardíaca también puede conducir a resultados negativos en el tratamiento. El diagnóstico temprano de la miocardiopatía dilatada se puede realizar con una ecocardiografía aleatoria (de detección), que se realiza durante el examen médico anual, así como cuando se examina a personas con herencia cargada por esta enfermedad. Es en este caso que es posible aumentar la eficacia del tratamiento farmacológico de la DCM. CONFERENCIA № 3. Enfermedades del sistema cardiovascular. Miocardiopatía hipertrófica La miocardiopatía hipertrófica (MCH) es una enfermedad no coronaria del miocardio ventricular (principalmente el izquierdo), caracterizada por una hipertrofia masiva de sus paredes con protrusión del tabique interventricular (SIV) hacia la cavidad del ventrículo derecho, que puede engrosarse significativamente , una disminución en el volumen interno de los ventrículos, contractilidad normal o aumentada del miocardio ventricular y relajación alterada (disfunción diastólica). La más frecuente es la hipertrofia aislada del tabique interventricular (estenosis subaórtica hipertrófica aislada - IHSS) o de la parte apical de los ventrículos. Clasificación. Clasificación de la MCH según la localización de la hipertrofia (ED Wigle et al., 1985 con adiciones). I. Hipertrofia del VI. 1) Hipertrofia asimétrica, en la que se produce hipertrofia miocárdica de paredes individuales o segmentos de los ventrículos (incluida hipertrofia IVS - 90% con o sin obstrucción del tracto de salida del ventrículo izquierdo, medioventricular - 1%, hipertrofia apical del ventrículo izquierdo - 3%, hipertrofia de la pared libre del ventrículo izquierdo y parte posterior del SIV - 1%). 2) La hipertrofia simétrica (concéntrica) del ventrículo izquierdo, cuando la hipertrofia miocárdica se extiende a todas las paredes de los ventrículos, ocurre en el 5% de los casos. II. Hipertrofia del páncreas. En el caso de que la hipertrofia miocárdica impida la salida normal de sangre de los ventrículos del corazón, se habla de una forma obstructiva de HCM. En otros casos, la HCM no es obstructiva. Etiología. La enfermedad puede ser congénita o adquirida. La MCH congénita se hereda de forma autosómica dominante. Dentro de una misma familia se pueden observar diversas formas y variantes de MCH. Muy a menudo, se hereda la hipertrofia asimétrica del tabique interventricular. La forma adquirida de MCH ocurre en pacientes de edad avanzada con antecedentes de hipertensión arterial. La prevalencia es de 0,02-0,05%. Las razones para el desarrollo de MCH adquirida no se entienden completamente. Según una de las hipótesis propuestas, los individuos con MCH adquirida en el período prenatal desarrollan un defecto en los receptores adrenérgicos del corazón implicados en la regulación de la actividad cardíaca, en particular de la frecuencia cardíaca. Como resultado, la sensibilidad a la norepinefrina y hormonas similares, que aumentan la frecuencia cardíaca, aumenta significativamente, lo que afecta el desarrollo de hipertrofia miocárdica en ellos y, finalmente, la MCH. Cuadro patohistológico. Disposición desorientada, incorrecta y caótica de los cardiomiocitos y miofibrillas en los cardiomiocitos, la fibrosis miocárdica es una violación de la arquitectura del músculo cardíaco. Patogenesia. Los trastornos hemodinámicos surgen debido a una alteración de la función diastólica del corazón. Durante la diástole, la sangre fluye insuficientemente hacia los ventrículos (especialmente el izquierdo) debido a su densidad y rigidez, lo que conduce a un rápido aumento de la presión telediastólica. Tanto el aumento de la rigidez del miocardio como el aumento de la presión intraventricular hacen que se expulse menos sangre del ventrículo durante la sístole. Para el suministro adecuado de oxígeno a los órganos y tejidos del cuerpo (con el funcionamiento normal del sistema cardiovascular), para la aplicación de cualquier carga, debe aumentar la liberación de sangre del corazón. En consecuencia, en respuesta a la carga, aumenta la frecuencia cardíaca. Con el desarrollo de HCM, el llenado del corazón con sangre sufre en reposo, y con un aumento en la frecuencia cardíaca durante el período de ejercicio, se ve aún más afectado negativamente. Como resultado de esto, no hay un aumento adecuado de la función de bombeo del corazón durante el ejercicio en la MCH. La actividad física en la MCH afecta el aumento de la presión intraventricular, lo que conduce a un aumento de la presión en la aurícula superior izquierda, así como en los vasos de la circulación pequeña (pulmonar). En estas condiciones, se desarrolla hiperfunción e hipertrofia de la aurícula izquierda y, más tarde, hipertensión pulmonar ("pasiva"). Como resultado, se produce dificultad para respirar, que es proporcional al grado de carga. Dado que durante el ejercicio la expulsión de sangre del ventrículo izquierdo no se corresponde con el aumento de la carga, el flujo de sangre en las arterias coronarias que alimentan al propio músculo cardíaco comienza a sufrir primero. Juega un papel importante y el hecho de que en la MCH existe una discrepancia entre una masa significativa de miocardio hipertrofiado y la posibilidad de irrigación coronaria, que sigue siendo la misma que en personas sanas. La disminución del flujo sanguíneo a través de las arterias coronarias conduce a la aparición de angina de pecho en la parte media y en la mitad izquierda del tórax, que se irradia hacia el brazo izquierdo, debajo del omóplato izquierdo. Al igual que la dificultad para respirar, la angina de pecho es provocada por el esfuerzo físico. En algunos casos de MCH durante el ejercicio, el riego sanguíneo cerebral también se deteriora, lo que provoca un síncope. Cabe señalar que para reducir el aumento de la presión intraventricular durante el ejercicio, existe un mecanismo compensatorio, cuyo funcionamiento se basa en el hecho de que la cavidad de la aurícula izquierda se expande y aumenta el grosor de sus paredes. Como resultado, hay un llenado adicional del ventrículo izquierdo con sangre durante el ejercicio. Sin embargo, esto es solo una compensación temporal debido al hecho de que la reserva de la aurícula izquierda como "bomba" es insignificante, y una expansión significativa de la cavidad de la aurícula izquierda conduce al desarrollo de fibrilación auricular. Cuadro clínico. La MCH se caracteriza por una variedad extrema de síntomas, lo que provoca un diagnóstico erróneo. La presencia y el momento de las quejas en la MCH están determinados principalmente por 2 factores: la forma de la MCH y la ubicación de la lesión. La cámara más poderosa del corazón es el ventrículo izquierdo, por lo tanto, con la hipertrofia de las paredes del miocardio, es posible que las quejas no aparezcan durante mucho tiempo. El daño aislado al ventrículo derecho del corazón es extremadamente raro. En la forma no obstructiva de MCH, cuando nada interfiere con la salida de sangre del ventrículo, el paciente puede no presentar ninguna queja. A veces puede haber dificultad para respirar (con un esfuerzo físico significativo), interrupciones en el trabajo del corazón, así como latidos cardíacos irregulares. En la forma obstructiva de la MCH, la eyección de sangre del corazón durante el ejercicio se reduce significativamente debido a la presencia de una obstrucción a la salida de sangre del ventrículo. En este caso, las quejas típicas son dificultad para respirar por el esfuerzo, angina de pecho y desmayos. La enfermedad se caracteriza por una progresión lenta de las quejas desde el momento de su aparición. Debido a la similitud de las molestias (dolor en la región del corazón y detrás del esternón) y los datos del estudio (soplo sistólico intenso), la cardiopatía reumática y la cardiopatía coronaria suelen diagnosticarse erróneamente. El cuadro clínico de la MCH es: 1) signos de hipertrofia miocárdica ventricular (principalmente izquierda); 2) un signo de función ventricular diastólica insuficiente; 3) signos variables de obstrucción del tracto de salida del ventrículo izquierdo. diagnósticos. En el proceso de búsqueda diagnóstica lo más significativo es la detección de soplo sistólico, pulso alterado e impulso apical desplazado. La imagen auscultatoria del corazón en pacientes con MCH obstructiva tiene una serie de características: el sonido máximo del soplo sistólico (soplo de eyección) se determina en el punto de Botkin y en el vértice del corazón, la gravedad del soplo es proporcional a el grado de obstrucción, su intensificación ocurre cuando el paciente se levanta bruscamente, así como durante la prueba de Valsalva; II tono siempre se conserva; el ruido no se realiza en los vasos del cuello. El pulso suele ser alto y rápido. Esto se debe a la ausencia de estrechamiento en las vías de salida del ventrículo izquierdo al comienzo de la sístole, pero luego, con la contracción de músculos poderosos, aparece un estrechamiento "funcional" de las vías de salida, como resultado de lo cual el pulso la onda disminuye prematuramente. El latido del vértice en aproximadamente 1/3 de los casos tiene un carácter "doble": al principio, a la palpación, se siente un golpe por la contracción de la aurícula izquierda, luego por la contracción del ventrículo izquierdo. Para facilitar la identificación de esta propiedad del latido del vértice, la palpación se realiza mejor con el paciente acostado sobre su lado izquierdo. Para el diagnóstico de MCH, los datos ecocardiográficos son de la mayor importancia, ya que permiten aclarar las características anatómicas de la enfermedad, la gravedad de la hipertrofia miocárdica, la obstrucción del tracto de salida del ventrículo izquierdo. Se revelan los siguientes signos: hipertrofia asimétrica del IVS, más pronunciada en el tercio superior, su hipocinesia; movimiento sistólico de la valva anterior de la válvula mitral en dirección anterior; contacto de la valva anterior de la válvula mitral con el IVS en diástole. Los signos inespecíficos son: hipertrofia de la aurícula izquierda, hipertrofia de la pared posterior del ventrículo izquierdo, disminución de la velocidad promedio de la cubierta diastólica de la valva anterior de la válvula mitral. En el ECG, cualquier cambio específico se encuentra solo con hipertrofia ventricular izquierda suficientemente desarrollada. Mediante el registro de un ECG durante 24 horas (monitorización Holter), se detectan las alteraciones del ritmo cardíaco existentes. Una prueba de ECG con una actividad física dosificada utilizando una bicicleta ergométrica o cinta de correr permite evaluar la gravedad de los síntomas de la enfermedad, su pronóstico y desarrollar el tratamiento adecuado. La hipertrofia aislada del IVS provoca un aumento de la amplitud de la onda Q en las derivaciones torácicas izquierdas (V5-6), lo que complica el diagnóstico diferencial con cambios focales por infarto de miocardio. Sin embargo, un pequeño ancho de la onda Q permite excluir un infarto de miocardio En el proceso de desarrollo de sobrecarga hemodinámica de la aurícula izquierda, el ECG puede mostrar signos de hipertrofia de la aurícula izquierda: ensanchamiento de la onda P por más de 0,10 s, un aumento en su amplitud, la aparición de una onda P bifásica en la derivación V1 con la segunda fase aumentada en amplitud y duración. El diagnóstico por rayos X es importante solo en la etapa avanzada de la enfermedad, cuando se puede determinar un aumento en el ventrículo izquierdo y la aurícula izquierda, una expansión de la parte descendente de la aorta. En el fonocardiograma se conservan las amplitudes de los tonos I y II, que es un signo diferencial de la MCH de la estenosis del orificio aórtico, y también se detecta un soplo sistólico de gravedad variable. Los métodos de investigación invasivos (sondeo de las partes izquierdas del corazón, angiografía de contraste) actualmente no son obligatorios, ya que la ecocardiografía proporciona información bastante confiable para hacer un diagnóstico. Sin embargo, a veces estos métodos se utilizan en casos controvertidos para aclarar el diagnóstico o preparar a los pacientes para la cirugía. El sondeo cardíaco se utiliza bajo control de televisión de rayos X. Técnica para realizar el método: al pinchar una arteria grande bajo anestesia local con la introducción adicional de un catéter especial en la cavidad del corazón, se mide el gradiente de presión (diferencia) entre el ventrículo izquierdo y la aorta saliente. Normalmente, este gradiente no debería ser. Sin embargo, la HCM revela una diferencia de presión entre el ventrículo izquierdo y la aorta de 50 a 150 mm Hg. Art., un aumento de la presión diastólica final en la cavidad del ventrículo izquierdo hasta 18 mm Hg. Arte. El gradiente de presión disminuye después de la introducción de bloqueadores β. Además, durante el sondeo del corazón, se inyecta un agente de contraste en la cavidad del ventrículo (ventriculografía) para estudiar sus características anatómicas. En varios pacientes (por regla general, se trata de personas mayores de 40 años), la angiografía de las arterias coronarias (angiografía coronaria) se usa simultáneamente antes de la cirugía cardíaca para aclarar la etiología de la angina de pecho y excluir la enfermedad arterial coronaria concomitante. tratamiento. La base del tratamiento farmacológico de la MCH son los fármacos que mejoran el flujo sanguíneo a los ventrículos del corazón en diástole. Estos fármacos son un grupo de betabloqueantes (anaprilina, atenolol, metoprolol y propranolol, 160-320 mg/día, etc.) y un grupo de antagonistas de los iones calcio (verapamilo, pero con precaución). La novokinamida y la disopiramida también reducen la frecuencia cardíaca y tienen un efecto antiarrítmico. Al comienzo del tratamiento, se utilizan pequeñas dosis de estos medicamentos y luego la dosis se aumenta gradualmente hasta el máximo tolerado por el paciente. Los bloqueadores β se usan con precaución en la diabetes mellitus, el asma bronquial y algunas otras enfermedades. Cuando se trata con estos medicamentos, es necesario un control constante de la presión arterial y la frecuencia del pulso. Peligroso es una disminución de la presión por debajo de 90/60 mm Hg. Arte. y frecuencia cardíaca por debajo de 55 por minuto. Si un paciente tiene alteraciones del ritmo peligrosas que no pueden tratarse con bloqueadores β o antagonistas de iones de calcio, entonces se usan adicionalmente otros medicamentos antiarrítmicos en el tratamiento de dichos pacientes. Se recomienda el nombramiento de anticoagulantes para arritmias paroxísticas y fibrilación auricular, así como en presencia de coágulos de sangre en las cámaras del corazón (warfarina, etc.). Durante el período de tratamiento con estos medicamentos, es necesario controlar regularmente una serie de indicadores del sistema de coagulación de la sangre. Con una sobredosis significativa de anticoagulantes, es posible el sangrado externo (nasal, uterino, etc.) e interno (hematomas, etc.). El tratamiento quirúrgico se realiza en pacientes con MCH obstructiva cuando el tratamiento médico no es eficaz o cuando el gradiente entre el ventrículo izquierdo y la aorta es superior a 30 mmHg. Arte. (Se realiza la operación de miotomía o miectomía: escisión o extirpación de una parte del miocardio hipertrofiado del ventrículo izquierdo). También se realizan el reemplazo de la válvula mitral y la ablación IVS no quirúrgica. Prevención. Todos los pacientes con MCH, especialmente aquellos con forma obstructiva, están contraindicados en deportes que puedan aumentar significativamente la actividad física en un corto período de tiempo (atletismo, fútbol, hockey). La prevención de la enfermedad radica en el diagnóstico precoz, lo que permite iniciar el tratamiento temprano de la enfermedad y prevenir el desarrollo de hipertrofia miocárdica grave. Es obligatoria la realización de ecocardiografía en familiares genéticos del paciente. También son importantes para el diagnóstico el ECG y el EchoCG, que se realizan durante un examen médico anual. En pacientes con una forma obstructiva de MCH, es necesario prevenir la endocarditis infecciosa (profilaxis antibiótica, etc.), ya que la presencia de obstrucción crea las condiciones para el desarrollo de esta afección potencialmente mortal. CONFERENCIA № 4. Enfermedades del sistema cardiovascular. Miocardiopatía restrictiva Miocardiopatía restrictiva (RCMP) - (de la palabra latina restrictio - "restricción") - un grupo de enfermedades del miocardio y el endocardio, en las que, como resultado de una fibrosis pronunciada y pérdida de elasticidad, debido a varias razones, hay una restricción fija en el llenado de los ventrículos en diástole. El llenado de los ventrículos se lleva a cabo en la fase de llenado temprano, seguido de estabilización de la presión intraventricular. La enfermedad se acompaña de un llenado insuficiente de sangre del corazón, lo que conduce además al desarrollo de insuficiencia cardíaca crónica. La miocardiopatía restrictiva es la menos estudiada y menos común de todas las miocardiopatías. RCMP incluye: endocarditis fibroplástica parietal de Lefler (encontrada en países con clima templado, descrita por W. Loffler et al., 1936) y fibrosis endomiocárdica (encontrada en países de África tropical, descrita por D. Bedford et E. Konstman). Anteriormente, se consideraban como dos procesos patológicos independientes. Sin embargo, el cuadro patomorfológico en estas enfermedades difiere poco. Causas de la MCR. La MCR primaria es muy rara y la única causa comprobada de su aparición es el llamado síndrome hipereosinofílico (enfermedad de Leffler, endocarditis fibroplástica parietal de Leffler). Ocurre principalmente en hombres de entre 30 y 40 años. Con el síndrome hipereosinofílico, se produce inflamación del endocardio, que eventualmente culmina en una compactación significativa del endocardio y su adhesión rugosa al miocardio adyacente, lo que conduce a una fuerte disminución de la extensibilidad del músculo cardíaco. El síndrome de Lefler también se caracteriza por eosinofilia persistente durante 6 meses o más (1500 eosinófilos por 1 mm3), daño a los órganos internos (hígado, riñones, pulmones, médula ósea). En la gran mayoría de los casos, el origen de la RCMP es secundario, debido a otras razones, entre las cuales las más comunes son: 1) amiloidosis: una enfermedad asociada con una violación del metabolismo de las proteínas en el cuerpo; al mismo tiempo, en los tejidos de varios órganos, se forma una proteína anormal (amiloide) y se deposita en grandes cantidades; cuando el corazón está dañado, el amiloide provoca una disminución de su contractilidad y extensibilidad; 2) hemocromatosis: una violación del metabolismo del hierro en el cuerpo, acompañada de un mayor contenido de hierro en la sangre, su exceso se deposita en muchos órganos y tejidos, incluido el miocardio, lo que provoca una disminución en su extensibilidad; 3) sarcoidosis: una enfermedad de etiología desconocida, caracterizada por la formación de grupos de células (granulomas) en órganos y tejidos; los pulmones, el hígado, los ganglios linfáticos y el bazo son los más afectados; y el desarrollo de granulomas en el miocardio conduce a una disminución de su extensibilidad; 4) enfermedades endocárdicas (fibrosis endocárdica, fibroelastosis endocárdica, etc.), cuando se produce un engrosamiento y compactación importante del endocardio, lo que conduce también a una fuerte limitación de la extensibilidad miocárdica. La fibroelastosis del endocardio, en particular, solo puede ocurrir en bebés; esta enfermedad no es compatible con la vida debido al desarrollo temprano de insuficiencia cardíaca severa. Patogenesia. Con la MCR, la distensibilidad miocárdica se ve afectada por varias razones. Como resultado, el llenado de sangre de los ventrículos disminuye y la presión intraventricular aumenta significativamente. Sin embargo, a diferencia de la MCH, la posibilidad de desarrollar hipertrofia miocárdica compensatoria en la miocardiopatía restrictiva es pequeña. Así, después de un tiempo, se produce un estancamiento en la circulación pulmonar y la función de bombeo del corazón disminuye, lo que conduce a una retención gradual de líquidos en el cuerpo, al desarrollo de hinchazón persistente de las piernas, hepatomegalia y ascitis. Si la compactación del endocardio se extiende a las válvulas auriculoventriculares (mitral y tricúspide), ésta se agrava por el desarrollo de su insuficiencia, y también conduce a la trombosis de las cavidades cardíacas por su reducida contractilidad y extensibilidad. La propagación de fragmentos de estos coágulos de sangre con el torrente sanguíneo puede causar tromboembolismo y bloqueo de grandes vasos, ataques al corazón de órganos internos. Con la propagación de inclusiones patológicas del miocardio a la zona del sistema de conducción del corazón, pueden aparecer diversas alteraciones en la conducción del impulso cardíaco, acompañadas del desarrollo de bloqueos. Con RCMP, también se observan con bastante frecuencia varios tipos de arritmias. Con base en lo anterior, podemos concluir que la enfermedad desde el punto de vista patogénico procede en 3 etapas. Etapa I - necrótica - infiltración eosinofílica del miocardio y otros órganos. Etapa II - trombótico - la formación de coágulos de sangre en las cavidades de los ventrículos izquierdo y derecho, el desarrollo de complicaciones tromboembólicas y el engrosamiento gradual del endocardio principalmente en las regiones apicales y cerca de las válvulas auriculoventriculares. Etapa III: fibrosa, caracterizada por un engrosamiento del endocardio de hasta varios milímetros, se expresa fibrosis miocárdica, principalmente áreas subendocárdicas. La cavidad está parcialmente obliterada debido a trombos organizados, se observa fibrosis de las cúspides de la válvula mitral, regurgitación mitral. Dilatación auricular pronunciada. Se observa disfunción diastólica restrictiva. Cuadro clínico. Las manifestaciones de la enfermedad son extremadamente polimórficas y están determinadas por síntomas de trastornos circulatorios en el círculo pequeño o grande (dependiendo del daño predominante en los ventrículos derecho o izquierdo). Las quejas pueden estar ausentes o pueden deberse a congestión en la circulación pulmonar o sistémica. Los pacientes suelen quejarse de dificultad para respirar, que aparece por primera vez durante el ejercicio y, a medida que avanza la enfermedad, se observa dificultad para respirar en reposo. Debido a una disminución en la función de bombeo del corazón, el paciente se queja de fatiga y poca tolerancia a cualquier carga. Con el tiempo, se unen la hinchazón de las piernas, el agrandamiento del hígado y la hidropesía del abdomen. Periódicamente, aparece un latido cardíaco irregular y, con el desarrollo de bloqueos persistentes, puede haber desmayos. La primera etapa del desarrollo de la enfermedad (necrótica) se caracteriza por la aparición de fiebre, pérdida de peso, tos, erupción cutánea y taquicardia. diagnósticos. Reconocer RCM es extremadamente difícil. Se puede hablar con confianza sobre esta patología solo después de excluir una serie de enfermedades similares (como la miocarditis idiopática del tipo Abramov-Fiedler, pericarditis exudativa, defectos valvulares del corazón). Al examinar a pacientes con RCMP, se encuentran síntomas característicos de insuficiencia cardíaca congestiva (edema, hepatomegalia y ascitis), así como una pulsación pronunciada de las venas del cuello. Esto último se debe a la dificultad de aporte sanguíneo al corazón por la escasa extensibilidad miocárdica. Durante la auscultación, la detección de un corazón agrandado, un soplo sistólico tardío suave y un tono III temprano fuerte (debido al llenado rápido de los ventrículos durante la diástole) es de gran importancia. Los soplos en el corazón también se detectan en pacientes con insuficiencia de la válvula auriculoventricular. Un estudio de ECG revela hipertrofia moderada del miocardio ventricular, así como diversas alteraciones del ritmo y la conducción del impulso cardíaco, cambios inespecíficos en la onda T en el ECG. La ecocardiografía es uno de los métodos más informativos para diagnosticar la enfermedad, con su ayuda, el engrosamiento del endocardio, un cambio en la naturaleza del llenado de los ventrículos del corazón, una disminución en la función de bombeo del corazón, un movimiento rápido de la valva anterior de la válvula mitral durante la diástole y se detecta un rápido movimiento temprano de la pared posterior del ventrículo izquierdo hacia afuera. La resonancia magnética le permite obtener información sobre la anatomía del corazón, determinar inclusiones patológicas en el miocardio y medir el grosor del endocardio. Al examinar los parámetros de la hemodinámica central, se determina un aumento de la presión de llenado en ambos ventrículos, y la presión final en el izquierdo supera la del ventrículo derecho. La ventriculografía revela aumento de la contracción del ventrículo izquierdo, contornos suaves de sus paredes, a veces con un defecto de llenado en el vértice (evidencia de obliteración). En algunos casos, se determinan depresiones en la región de los músculos papilares. Hay signos de insuficiencia valvular, en particular la válvula mitral o tricúspide. Diagnóstico diferencial. En el diagnóstico diferencial de la MCR, es muy importante tener en cuenta la similitud de la enfermedad en las manifestaciones externas con la pericarditis constrictiva, pero el método de tratamiento de estas enfermedades es diametralmente opuesto. La biopsia intravital de miocardio y endocardio generalmente se usa simultáneamente con el sondaje cardíaco, lo que permite obtener mayor información para aclarar la naturaleza de la enfermedad y el tratamiento posterior. En casos extremadamente raros, cuando los métodos de diagnóstico anteriores no permiten distinguir la RCM de la pericarditis constrictiva, se realiza una inspección directa del pericardio en la mesa de operaciones. Todos los pacientes con RCMP necesitan un examen clínico, bioquímico y adicional completo para determinar las causas no cardíacas de la enfermedad. tratamiento. El tratamiento de la enfermedad presenta importantes dificultades. La mayoría de los medicamentos que se utilizan para tratar la insuficiencia cardíaca pueden no producir los resultados deseados debido a que, debido a las características de la enfermedad, es imposible obtener una mejora significativa en la distensibilidad del miocardio (en algunos casos, se prescriben antagonistas de los iones de calcio para estos fines). Los diuréticos (aldactona) se utilizan para eliminar el exceso de líquido en el cuerpo. Para eliminar los trastornos de conducción persistentes, puede ser necesario instalar (implantar) un marcapasos permanente. Esto es causado por enfermedades como la sarcoidosis y la hemocromatosis, que conducen al desarrollo de RCMP secundaria, están sujetas a autotratamiento. En el tratamiento de la sarcoidosis, se usan medicamentos hormonales (prednisolona, etc.), y en la hemocromatosis, sangría regular (para reducir la concentración de hierro en el cuerpo). El tratamiento de la amiloidosis miocárdica depende directamente de las causas de su aparición. Es recomendable usar medicamentos anticoagulantes para la trombosis en las cámaras del corazón. Se recurre al tratamiento quirúrgico en casos de RCMP causada por daño endocárdico. Durante la operación, si es posible, se extirpa la parte del endocardio que ha sufrido cambios. En algunos casos, si hay insuficiencia de las válvulas auriculoventriculares, se realiza su prótesis. Algunas formas de daño miocárdico amiloide se tratan con un trasplante de corazón. Prevención de la RCMP. Lamentablemente, las medidas preventivas para esta enfermedad son limitadas. Principalmente, es necesaria la identificación temprana de causas potencialmente prevenibles de amiloidosis, sarcoidosis, hemocromatosis, etc.. Para lograr estos objetivos es de gran importancia el examen médico anual de la población. CONFERENCIA N° 5. Enfermedades del sistema cardiovascular. endocaditis infecciosa Endocarditis infecciosa (EI) - una enfermedad que consiste en una poliposis-lesión ulcerosa del aparato valvular del corazón (a menudo con el desarrollo de insuficiencia valvular) o endocardio parietal (con menos frecuencia, se ve afectado el endotelio de la aorta o la arteria grande más cercana). La enfermedad es causada por varios microorganismos patógenos y se acompaña de una lesión sistémica de los órganos internos (riñones, hígado, bazo) en el contexto de una reactividad alterada del organismo. Hasta el momento, en diversas publicaciones impresas se pueden encontrar los términos anteriormente utilizados “endocarditis bacteriana”, “endocarditis séptica prolongada” para referirse a este proceso patológico. Sin embargo, es el término "endocarditis infecciosa" que los reemplazó el que refleja mejor la causa de la enfermedad causada por una amplia variedad de microorganismos: agentes bacterianos, rickettsias, virus y hongos. El número de pacientes con EI está aumentando en todo el mundo. Esto se debe a la presencia de los denominados grupos de riesgo (pacientes con lesiones valvulares ateroscleróticas, reumáticas, traumáticas, defectos cardíacos o valvulares, comunicación interventricular, coartación aórtica) como consecuencia de que la infección se produce con mayor facilidad en un cuerpo patológicamente alterado. válvula o endocardio. Etiología. Los agentes patógenos causantes de la enfermedad suelen ser el grupo de microorganismos cocos: estreptococos (previamente se aisló estreptococo viridans en el 90% de los casos), estafilococos (dorados, blancos), enterococos, neumococos. En los últimos años, debido al uso generalizado de antibióticos, la gama de patógenos microbianos ha cambiado. La enfermedad puede ser causada por flora gramnegativa (Escherichia coli, Pseudomonas aeruginosa, Proteus, Klebsiella); ha surgido evidencia del importante papel de los hongos patógenos, Sarcinus, Brucella y virus. Las enfermedades causadas por estos patógenos son más graves, especialmente la endocarditis causada por una infección por hongos (generalmente ocurre debido al uso irracional de antibióticos). Sin embargo, en varios pacientes no se detecta el verdadero agente causante de la enfermedad (la frecuencia de resultados negativos de hemocultivos es del 20-50%). A menudo, la infección ocurre en el sitio de una válvula protésica, la llamada EI protésica, que se desarrolla principalmente dentro de los 2 meses posteriores a la cirugía de reemplazo de válvula cardíaca. En este caso, el agente causal de la enfermedad a menudo tiene una naturaleza estreptocócica. Así, los focos de infección y bacteriemia en la EI son muy diferentes (cirugías en la cavidad oral, operaciones y procedimientos diagnósticos en el área urogenital, intervención quirúrgica en el sistema cardiovascular (incluyendo recambio valvular), permanencia prolongada del catéter en una vena, infusiones intravenosas frecuentes y métodos de investigación endoscópicos, hemodiálisis crónica (derivación arteriovenosa), administración de fármacos por vía intravenosa). Existen los llamados EI primarios, que se desarrollaron en válvulas intactas, así como EI en el contexto de cambios congénitos y adquiridos en el corazón y su aparato valvular: endocarditis secundaria. Estos cambios permiten distinguir a los pacientes en grupos de riesgo separados: defectos cardíacos (congénitos y adquiridos), prolapso de la válvula mitral, aneurismas arteriovenosos, aneurismas post-infarto, derivaciones, condición después de cirugía en el corazón y grandes vasos. Patogenesia. El mecanismo de desarrollo de la EI es complejo y no está suficientemente estudiado; sin embargo, se pueden identificar los puntos principales en el desarrollo de la enfermedad. Si hay un foco de infección en el cuerpo bajo la influencia de la inmunidad humoral y local (celular) alterada con una perversión de las reacciones inmunológicas, varios factores endógenos y exógenos, se desarrolla la bacteriemia. Desde la sangre, los microorganismos ingresan a las válvulas del corazón, creando allí un foco secundario de infección. La fijación y reproducción de microorganismos en el endocardio se ve facilitada por una serie de factores: un cambio previo en el tejido y la superficie de la válvula, la presencia de masas trombóticas en ella, que surgen bajo la influencia del efecto dañino directo del torrente sanguíneo. cuando su circulación intracardíaca cambia en condiciones de enfermedad cardíaca existente. Al mismo tiempo, varias células sanguíneas (plaquetas, etc.) se “pegan” al sitio de la lesión traumática, formando crecimientos celulares que se asemejan a carámbanos que cuelgan de la válvula. Estas vegetaciones quedan disponibles para la infección que ha entrado en el lecho vascular. La deformación de las válvulas debido a la aparición de un gran gradiente de presión, la estrechez del orificio y los cambios en la velocidad del flujo sanguíneo también contribuyen a la introducción de agentes infecciosos en el endocardio con la formación de un foco infeccioso. Cuando una válvula previamente intacta se daña, ocurren cambios que alteran las propiedades normales de las secciones individuales de esta válvula (aparece hinchazón), procesos exudativos o proliferativos ("valvulitis intersticial" - fase preclínica). En el desarrollo de la enfermedad se puede distinguir el estadio III. La etapa I (infecciosa-tóxica) procede con diversos grados de severidad de intoxicación. Hay un crecimiento de bacterias, la destrucción de válvulas, lo que lleva al desarrollo de enfermedades del corazón; en la misma etapa, a menudo se produce una generalización del proceso debido a la propagación hematógena de la infección: los pedazos de cúspides o colonias de microorganismos pueden separarse de la válvula, las cúspides pueden romperse. El desprendimiento de trozos de vegetación microbiana de la válvula contribuye a la introducción de émbolos infectados en diversas partes del lecho vascular y exacerba las manifestaciones sépticas. Trozos de la válvula o vegetaciones microbianas circulan por el cuerpo con flujo sanguíneo, al entrar en el cerebro provocan infartos cerebrales, que se acompañan de parálisis, paresias y otros diversos trastornos neurológicos. La válvula, que ha sufrido destrucción, no puede realizar su función, y pronto hay una insuficiencia cardíaca que se desarrolla a la velocidad del rayo. Etapa II: inmunoinflamatoria, en la que los microorganismos fijados en las válvulas causan autosensibilización prolongada y daño hiperérgico a los órganos y tejidos del cuerpo (generalización inmune del proceso). Durante este período, los complejos inmunes circulan en la sangre y se fijan en los tejidos (corazón, riñones, hígado, vasos sanguíneos). Los trastornos inmunológicos y autoinmunes provocan el desarrollo de vasculitis y visceritis (nefritis por inmunocomplejos, miocarditis, hepatitis, capilaritis, etc.). La etapa III, distrófica, ocurre con la progresión del proceso patológico: se alteran las funciones de varios órganos, se produce insuficiencia cardíaca y renal, lo que agrava aún más el curso de la enfermedad. Clasificación. Actualmente se utiliza la clasificación y nomenclatura de la EI, que refleja la forma clínica, variante de curso, grado de actividad, fase patogénica y forma clínica y morfológica de la enfermedad (ver Tabla 6). Tabla 6 Clasificación de la EI
También se hace una distinción entre IE activa e inactiva (curada). También existe una clasificación quirúrgica, en la que se distinguen: 1) la lesión se limita a las valvas; 2) la lesión se extiende más allá de la válvula. La EI aguda (rápidamente progresiva, se desarrolla a lo largo de 8-10 semanas) es rara, generalmente en individuos que no han tenido previamente una enfermedad cardiaca, y se manifiesta clínicamente por un cuadro de sepsis general. Con los métodos modernos de tratamiento, es posible traducirlo a subagudo. La EI subaguda (más común) dura de 3 a 4 meses, con una terapia farmacológica adecuada, puede ocurrir una remisión. Sin embargo, las recaídas de la enfermedad son posibles. La EI prolongada dura muchos meses con períodos de exacerbación y remisión, se caracteriza por manifestaciones clínicas leves, parámetros de laboratorio menores y alteraciones generales. La enfermedad suele responder bien al tratamiento. Con un curso desfavorable, ocurren complicaciones graves y los pacientes mueren por insuficiencia cardíaca progresiva, lo que aumenta la intoxicación séptica. Cuadro clínico. Dependiendo del agente causante de la infección, la EI puede ocurrir repentinamente y desarrollarse rápidamente (Staphylococcus aureus, enterococos) o tener un inicio latente (estreptococo viridans). Las manifestaciones de EI se presentan en forma de síndromes. 1) Síndrome de cambios inflamatorios y septicemia (fiebre, escalofríos, erupciones hemorrágicas, cambios en los parámetros sanguíneos de fase aguda: leucocitosis con desviación a la izquierda, aumento de la VSG, aparición de proteína C reactiva, aumento del fibrinógeno, α2-globulinas. 2) Síndrome de intoxicación general del cuerpo (debilidad, sudoración, dolores de cabeza, mialgias y artralgias, pérdida de apetito, palidez de la piel con tinte ictérico). 3) Síndrome de daño valvular (formación de enfermedades del corazón). 4) Síndrome de trastornos inmunitarios "de laboratorio" (presencia de inmunocomplejos circulantes en sangre o fijados en riñones, miocardio, vasos sanguíneos; hipergammaglobulinemia; aparición de factor reumatoide; detección de anticuerpos antitejidos). 5) Síndrome de complicaciones tromboembólicas (nefritis focal, infarto de miocardio, bazo, intestinos, tromboembolismo en el cerebro, vasos de las extremidades inferiores, etc.). 6) Síndrome de generalización de lesiones (glomerulonefritis difusa, miocarditis, hepatitis, vasculitis, etc.). La gravedad de estos síndromes es diferente. Depende de la naturaleza del curso de EI, etapa, tipo de patógeno. Por ejemplo, la EI estafilocócica se caracteriza por una alta actividad del proceso, síntomas graves de intoxicación general y el desarrollo de complicaciones purulentas. La endocarditis fúngica suele acompañarse de oclusión embólica de grandes arterias, especialmente de las extremidades inferiores. Un cuadro típico de la enfermedad es característico de la EI causada por Streptococcus viridans. El inicio de la enfermedad a menudo se asocia con una infección aguda o la exacerbación de una infección crónica, así como con una serie de manipulaciones médicas. Es especialmente característica la combinación de un aumento de la temperatura corporal en diversos grados (desde fiebre prolongada hasta estado subfebril o temperatura normal) con escalofríos y sudoración. El paciente presenta quejas simultáneas debido a la presencia de un proceso infeccioso e intoxicación, así como complicaciones tromboembólicas del daño cardíaco. Los pacientes pueden tener antecedentes de episodios de tratamiento antibiótico a largo plazo (esto ocurre cuando la EI recurre en pacientes previamente tratados). diagnósticos. De gran importancia para realizar un diagnóstico correcto es la detección de daños en las válvulas cardíacas mediante cambios en el patrón de auscultación de defectos cardíacos preexistentes; la aparición de ruido “adicional”. Se revelan lesiones características de la piel y las membranas mucosas: color de piel café con leche, hemorragias, síntomas positivos de Hecht (pellizco) y Konchalovsky-Rumpel-Leede (torniquete), así como nódulos de Osler: nódulos densos hiperémicos dolorosos en la superficie palmar y yemas de los dedos , signo de Lukin-Libman (manchas de Lukin): hemorragia en el pliegue de transición de la conjuntiva. En la IE se observa a menudo esplenomegalia. Es muy típica una pérdida de peso significativa (a veces de 15 a 20 kg). En casos raros, se desarrolla pericarditis (un leve ruido de fricción pleural causado por depósitos fibrinosos en el pericardio). El examen físico puede revelar un aumento de la presión arterial, lo que indica el desarrollo de glomerulonefritis difusa. A veces se determinan signos de disfunción del sistema nervioso central (paresia, hipercinesia, reflejos patológicos, etc.) como resultado de la embolia de los vasos cerebrales. En este caso, el error de diagnóstico más común es la evaluación de un síndrome particular como manifestación de una enfermedad independiente (por ejemplo, con signos pronunciados de daño hepático, se diagnostica hepatitis, etc.). Sin embargo, el diagnóstico de la EI se basa principalmente en la detección precoz del agente causal de la enfermedad. Para ello se utilizan los siguientes estudios de laboratorio e instrumentales. 1) La obtención de un hemocultivo positivo es el signo diagnóstico más importante de la EI. El análisis también es necesario para seleccionar el antibiótico más efectivo en este caso. Se requieren al menos 2-3 de ellos para confirmar el diagnóstico. De gran importancia son la técnica de muestreo y cultivo de sangre, el momento de la inoculación (preferiblemente en el punto álgido de la fiebre), el uso de medios enriquecidos. 2) Realización de NBT (prueba de nitrobluttetrazolio) - diagnóstico de infecciones bacterianas sistémicas, que permite diferenciar las infecciones bacterianas de otras enfermedades inflamatorias. El método se basa en la reducción del colorante NBT soluble por los neutrófilos en un precipitado de formazán insoluble. Si el número de células NBT positivas es superior al 10 %, la prueba se considera positiva. 3) Análisis de sangre clínico para detectar indicadores de fase aguda: se puede detectar un aumento de la ESR a 50 mm / h o más, leucocitosis con un cambio de la fórmula leucocitaria hacia la izquierda o (en la etapa II) leucopenia y anemia hipocrómica. Se atribuye valor diagnóstico a la detección de histiocitos en la sangre extraída del lóbulo de la oreja. Su contenido de más de 6 en el campo de visión puede indicar a favor de IE. Un análisis de sangre bioquímico muestra un aumento en el contenido de fibrinógeno, α2-globulinas y α-globulinas - hasta 30-40%. 4) Identificación de cambios inmunológicos: hipergammaglobulinemia, inmunocomplejos circulantes, disminución del título del complemento, aparición de factor reumatoide (antiglobulina), aumento de la reacción de transformación imperiosa de linfocitos con PHA (fitohemaglutinina) y antígenos bacterianos, detección de anticuerpos antitejidos. 5) Se realiza análisis de orina para esclarecer las lesiones de diversos órganos y sistemas, cuando se detecta glomerulonefritis, manifestada por proteinuria, cilindruria y hematuria. Un aumento en el contenido de bilirrubina, transaminasas indica daño hepático. 6) Un signo de diagnóstico directo de EI, la presencia de vegetación en las válvulas del corazón, se detecta mediante ecocardiografía. Por lo tanto, de toda la variedad de síntomas, se deben distinguir los principales y los adicionales. Los principales criterios para el diagnóstico de EI: 1) fiebre con temperatura superior a 38 ° C con escalofríos; 2) manchas de Lukin; 3) nódulos de Osler; 4) endocarditis en válvulas sin cambios (primarias) o en el contexto de defectos cardíacos reumáticos y congénitos. miocarditis infecciosa; 5) tromboembolismo arterial múltiple, rupturas de aneurismas micóticos con hemorragias; 6) esplenomegalia; 7) hemocultivo positivo; 8) un efecto positivo pronunciado del uso de antibióticos. Criterios adicionales para el diagnóstico de EI: 1) un aumento de la temperatura corporal hasta 38 ° C, escalofríos; 2) hemorragias en la piel; 3) pérdida de peso rápida; 4) la artritis asimétrica de las articulaciones menudas de las manos, los pies; 5) anemización; 6) VSG superior a 40 mm/h; 7) SRV marcadamente positivo; 8) la presencia de factor reumatoide; 9) α-globulinas por encima del 25%; 10) aumento en el contenido de inmunoglobulinas M, E y A. Diagnóstico diferencial. Aunque el tromboembolismo se observa con mayor frecuencia en la EI, no deben excluirse otras causas de embolismo en la arteria de la circulación sistémica: infarto de miocardio transmural y aneurisma cardíaco, miocarditis idiopática de Abramov-Fiedler y fibrilación auricular de diversos orígenes, pero que se observa principalmente en la estenosis reumática. del orificio auriculoventricular izquierdo. La endocarditis reumática e infecciosa son de la mayor importancia para el diagnóstico diferencial (Tabla 7). Tabla 7 Criterios diagnósticos diferenciales para endocarditis reumática e EI prolongada
Los síntomas característicos de la EI incluyen agrandamiento del bazo. Sin embargo, en la amiloidosis se observa un bazo grande, firme e indoloro; suave, indoloro indica su hiperplasia séptica. El dolor se nota con infarto del bazo, localizado subcapsularmente. La esplenomegalia puede ser una de las manifestaciones de la hipertensión portal en la insuficiencia cardíaca derecha. En este caso, se combina con ascitis y hepatomegalia. El agrandamiento del hígado con EI prolongada se observa con bastante frecuencia. La hiperplasia séptica se caracteriza por un agrandamiento relativamente pequeño y una consistencia blanda del hígado. Hay degeneración grasa y, muy raramente, infartos de hígado. Muy a menudo, un aumento en el hígado se asocia con congestión venosa con insuficiencia cardíaca derecha. En ausencia de ascitis, la congestión se reconoce retrospectivamente por una disminución del tamaño del hígado después del tratamiento con glucósidos cardíacos y diuréticos. tratamiento. El tratamiento de la EI debe ser lo más temprano y etiotrópico posible, teniendo en cuenta los datos bacteriológicos. Antes de que los medicamentos antibacterianos encontraran su uso generalizado en la práctica médica, la mayoría de los pacientes con EI morían a causa de la infección y sus complicaciones. Ahora más del 80% se curan con éxito. Pero para casi el 20%, el tratamiento farmacológico es ineficaz y pronto desarrollan insuficiencia cardíaca, que es casi intratable. En este sentido, es aconsejable una combinación de tratamiento conservador y quirúrgico. Para el tratamiento de la EI en cualquier grupo de edad se utilizan principalmente antibióticos que tienen un efecto bactericida sobre los microorganismos, preferiblemente en dosis individualizadas según la concentración del antibiótico en la sangre y la sensibilidad del patógeno al mismo. El fármaco de primera elección sigue siendo la penicilina. Tiene baja toxicidad, lo que permite su uso durante mucho tiempo en dosis relativamente altas. La dosis diaria - hasta 20 UI se administra por vía intravenosa e intramuscular. Sin embargo, no se debe excluir el hecho de que en pacientes ancianos y seniles, cuando se tratan con penicilina y otros antibióticos en dosis altas, a menudo se observa un efecto cardiotóxico: aparición o intensificación de insuficiencia cardíaca, dolor en el corazón, taquicardia. Cuando se reduce la dosis o se cambia el fármaco, estos fenómenos cesan. De etiología desconocida, se inicia tratamiento con dosis altas de bencilpenicilina por vía intramuscular o intravenosa hasta 18-000 unidades o más, combinación con estreptomicina hasta 000 g/m al día o aminoglucósidos (gentamicina, tobramicina a razón de 20-000 mg / día) se utiliza. kg por día). En ausencia de efecto o tras determinar el patógeno, se utilizan penicilinas semisintéticas (oxacilina, meticilina o ampicilina por vía intramuscular hasta 000 g/día). Las cefalosporinas también son los fármacos básicos utilizados en el tratamiento de la EI: los más utilizados son el claforan, la cefamisina (1-4 g/día, por vía intramuscular e intravenosa), así como la zeporina (6-12 g/día) y el kefzol (hasta 4 -10 g por vía intravenosa), etc.). Fusidin tiene un buen efecto antiestafilocócico, en algunos casos es efectivo en la resistencia de microorganismos a otros antibióticos (10-16 g / día). El tratamiento con antibióticos se prescribe durante mucho tiempo en un curso de 1,5 a 2 meses, hasta que la infección se elimine por completo. Después de la eliminación de la infección, el estado general del paciente mejora, la vegetación desaparece según la ecocardiografía y la confirmación microbiológica. Con inmunorreactividad reducida del organismo, los agentes antibacterianos se combinan con inmunoterapia pasiva (por ejemplo, con endocarditis estafilocócica, con plasma antiestafilocócico o α-globulina antiestafilocócica), utilizando inmunomoduladores (timalina, T-activina, etc.). Para prevenir la trombosis, por ejemplo, con endocarditis que se ha desarrollado en el contexto de la sepsis angiogénica, se crea una hipocoagulación controlada con heparina (20-000 UI por vía intravenosa o subcutánea). Para la inhibición de las enzimas proteolíticas, se utiliza contrical (hasta 25 000-40 000 UI por vía intravenosa). Cuando la EI valvular contribuyó a la formación de la valvulopatía o las manifestaciones de la enfermedad no desaparecen a pesar de la antibioterapia masiva, es recomendable realizar el tratamiento quirúrgico. Un argumento adicional a favor de la intervención quirúrgica es la embolia repetida de las valvas de la válvula cardíaca destruidas por la infección. A veces, la infección va más allá de los límites del anillo de la válvula, formando abscesos, lo que también es una indicación para el tratamiento quirúrgico. El objetivo principal de la operación es preservar la propia válvula del paciente. A veces se limitan a eliminar vegetaciones, suturar rupturas de las válvulas, etc. Si la válvula se destruye casi por completo bajo la influencia de la infección, se reemplaza por una artificial (prótesis) mediante prótesis mecánicas y biológicas. Prevención. La prevención de la EI consiste en el saneamiento oportuno de focos crónicos de infección en la cavidad bucal, amígdalas, nasofaringe, senos paranasales y el uso de terapia antibacteriana activa para enfermedades agudas estreptocócicas y estafilocócicas (angina de pecho, etc.). Se recomienda endurecer el cuerpo. Todos los pacientes con cardiopatía valvular, así como con prótesis valvulares, deben tomar antibióticos de forma profiláctica el día anterior y poco después de cualquier intervención, tras lo cual puede entrar una infección en el torrente sanguíneo. Es necesaria la observación en el dispensario de las personas que han tenido infecciones agudas por estreptococos y estafilococos. CONFERENCIA N° 6. Enfermedades del aparato respiratorio. Asma bronquial Hasta la fecha no existe una definición exhaustiva de asma, sin embargo, la definición más completa de esta enfermedad fue dada por G. B. Fedoseev en 1982. El asma bronquial (AB) es una enfermedad independiente, crónica, recurrente, con una lesión predominante de las vías respiratorias, cuyo mecanismo patogénico principal y obligatorio es una reactividad bronquial alterada por mecanismos específicos (inmunológicos) y (o) inespecíficos, congénitos o adquiridos, y cuyo signo clínico principal (obligatorio) es un ataque de asma y (o) una enfermedad asmática condición (estado asmático) debido a espasmo de los músculos lisos bronquiales, hipersecreción, discrina y edema de la mucosa bronquial. Etiología. Una combinación de varios factores juega un papel importante en la aparición del asma. En este sentido, existen 2 formas de asma: atópica (del latín athopia - "predisposición hereditaria") y alérgica infecciosa. La predisposición hereditaria se debe a la asociación de ciertos antígenos de histocompatibilidad (HLA) con la gravedad del asma, y un aumento de la gravedad de la enfermedad se observa especialmente en portadores de antígenos B.35 y B40. Los factores internos en el desarrollo de la enfermedad son defectos biológicos en los sistemas inmunológico, endocrino, sistema nervioso autónomo, sensibilidad y reactividad bronquial, aclaramiento mucociliar, endotelio vascular pulmonar, sistema de respuesta rápida (mastocitos, etc.), metabolismo del ácido araquidónico, etc. Los factores externos incluyen: 1) alérgenos infecciosos (virus, bacterias, hongos, levaduras, etc.); 2) alérgenos no infecciosos (polen, polvo, industriales, medicinales, alimentarios; alérgenos de garrapatas, insectos y animales); 3) irritantes mecánicos y químicos (metal, madera, silicato, polvo de algodón; vapores de ácidos, álcalis; humos, etc.); 4) factores meteorológicos y físico-químicos (cambios en la temperatura y humedad del aire, fluctuaciones en la presión barométrica, campo magnético terrestre, esfuerzo físico, etc.); 5) efectos estresantes, neuropsíquicos y actividad física. Los agentes infecciosos pueden tener no solo un efecto alergénico, sino también reducir el umbral de sensibilidad del cuerpo a los alérgenos no infecciosos (atópicos), aumentar la permeabilidad de la mucosa respiratoria para ellos; para formar un cambio en la reactividad de las células diana (mastocitos, basófilos, monocitos, etc.) y sistemas efectores. Patogenesia. La reactividad bronquial alterada es un vínculo central en la patogénesis de la enfermedad y puede ser primaria o secundaria. En el primer caso, los cambios en la reactividad pueden ser congénitos o adquiridos debido a la exposición directa a factores químicos, mecánicos, físicos e infecciones. Los cambios secundarios en la reactividad bronquial son una manifestación de cambios en la reactividad de los sistemas inmunológico, endocrino y nervioso del cuerpo. Así, hablando de la patogénesis de la EA, podemos distinguir 2 grupos de mecanismos: inmunológicos y no inmunológicos. Los mecanismos inmunológicos en la gran mayoría de los casos son dominantes en el curso de la enfermedad. Las violaciones del sistema inmunocompetente en la membrana mucosa del tracto respiratorio, que ocurren según los tipos I, III y IV de reacciones de hipersensibilidad, es decir, con un cambio en las inmunidades humoral y celular, conducen a un cambio en la reactividad bronquial. Al mismo tiempo, hay una disminución de la IgA secretora, se altera el sistema de fagocitosis, disminuye la función supresora de T de los linfocitos, disminuye la producción de interferón, lo que finalmente conduce a una disminución de la defensa antiviral del cuerpo. Tipo I (atópico, reagínico o anafiláctico). En respuesta a la ingestión de antígenos exoalérgenos (polen, proteínas animales y vegetales, bacterias y fármacos) en el organismo, se produce un aumento de la producción de IgE (reaginas), que se fijan y acumulan en los mastocitos (células efectoras primarias). Esta es la etapa inmunológica de la EA. Después de esto, se desarrolla la etapa patoquímica del proceso: desgranulación de los mastocitos con liberación de sustancias vasoactivas, broncoespásticas y quimiotácticas (histamina, serotonina, diversos factores quimiotácticos, etc.). Estos son mediadores primarios que actúan sobre los vasos y las células diana (células efectoras secundarias): eosinófilos, neutrófilos, plaquetas, monocitos macrófagos. Estos últimos, cuando se exponen a mediadores primarios, secretan mediadores secundarios (leucotrienos, prostaglandinas, tromboxanos, factor activador de plaquetas y otras sustancias pertenecientes al grupo de los eicosanoides). Bajo la influencia de sustancias biológicamente activas, comienza la etapa fisiopatológica de la patogénesis: aumenta la permeabilidad del lecho microcirculatorio, lo que conduce al desarrollo de edema, inflamación serosa y broncoespasmo. Clínicamente, esto se manifiesta por una violación aguda de la permeabilidad bronquial y el desarrollo de un ataque de asma. La reacción de tipo III (tipo inmunocomplejo o fenómeno de Arthus) se desarrolla bajo la influencia de exoalérgenos y endoalérgenos (autoalérgenos, que se forman por la desnaturalización de las proteínas de los bronquiolos y alvéolos como resultado de una inflamación infecciosa o alérgica y la acción de varios irritantes). La reacción ocurre en la zona de exceso de antígeno con la participación de anticuerpos precipitantes que pertenecen a las inmunoglobulinas de las clases O y M. El efecto dañino del complejo antígeno-anticuerpo formado se realiza a través de la activación del complemento, la liberación de enzimas lisosomales. Hay daño a las membranas basales, espasmo de los músculos lisos de los bronquios, vasodilatación y aumenta la permeabilidad de la microvasculatura. El tipo IV (hipersensibilidad celular de tipo retardado) se caracteriza por el hecho de que los linfocitos sensibilizados tienen un efecto dañino. En este caso, los mediadores de la reacción alérgica son las linfocinas (actúan sobre los macrófagos, las células epiteliales), las enzimas lisosomales y un sistema de cininas activado. Bajo la influencia de estas sustancias, se produce el desarrollo de edema, hinchazón de la membrana mucosa, broncoespasmo, hiperproducción de secreciones bronquiales viscosas. La consecuencia es una violación aguda de la permeabilidad de los bronquios, que se manifiesta por un ataque de asfixia. Los mecanismos no inmunológicos son el cambio primario en la reactividad bronquial como resultado de defectos biológicos congénitos y adquiridos. Los mecanismos no inmunológicos actúan sobre las células efectoras primarias o secundarias o sobre los receptores de los músculos lisos de los bronquios, los vasos sanguíneos, las células de las glándulas bronquiales. Esto modifica la reactividad de las células diana y, sobre todo, de los mastocitos, lo que va acompañado de una producción excesiva de sustancias biológicamente activas (histamina, leucotrienos, etc.). En respuesta a su liberación, se desarrolla broncoespasmo, hinchazón de la membrana mucosa, hiper y discrinia de las glándulas bronquiales. Todo esto cambia drásticamente la permeabilidad de los bronquios y provoca un ataque de asma. La resistencia bronquial puede cambiar condicional e incondicionalmente como un reflejo. Por ejemplo, la obstrucción derivada de la exposición al aire frío, la inhalación de gases y polvo irritantes y la actividad física son causadas por broncoespasmo a través del reflejo vagal. Las causas del broncoespasmo también pueden ser el daño a las zonas efectoras del reflejo broncoconstrictor vagal o el bloqueo de los receptores β-adrenérgicos. Recientemente, hablan sobre un papel especial en la patogenia de las violaciones de la permeabilidad bronquial de la insuficiencia de glucocorticoides y los trastornos disováricos. La insuficiencia de glucocorticosteroides conduce al desarrollo de hiperreactividad de los mastocitos, una disminución en la síntesis de catecolaminas y la activación de prostaglandinas F2a, así como una violación del sistema inmunocompetente (aquí hablamos de la participación compleja en la patogenia de la EA y los mecanismos inmunológicos y no inmunológicos). La hiperestrogenemia y la hipoprogesteronemia actúan sobre los receptores adrenérgicos α y β, aumentando la actividad de los primeros y reduciendo la actividad de los segundos. Clasificación. El predominio de uno u otro mecanismo en la patogénesis del asma nos permite identificar sus diversas características patogénicas. Actualmente se utiliza la clasificación propuesta por G. B. Fedoseev (1982). Etapas del desarrollo de la EA. I - preasma (condiciones que amenazan el desarrollo: bronquitis aguda y crónica, neumonía aguda y crónica con elementos de broncoespasmo en combinación con rinitis vasomotora, urticaria). II - BA clínicamente formada (considerada como tal después del primer ataque o aparición inmediata del estado asmático). Formas BA: 1) inmunológico; 2) no inmunológico. Mecanismos patogenéticos (variantes clínicas y patogenéticas) de la EA: 1) atópico; 2) dependiente de infección; 3) autoinmune; 4) deshormonal; 5) desequilibrio neuropsíquico; 6) desequilibrio adrenérgico; 7) desequilibrio colinérgico; 8) reactividad bronquial alterada primaria. En un paciente, es posible una combinación de varias variantes clínicas y patogénicas. En tal situación, es necesario en el momento del examen resaltar la variante principal para este paciente, que es importante para una terapia adecuada. En el curso de un curso largo de BA, es posible un cambio en el mecanismo patogénico. La gravedad del curso de BA: 1) curso leve (las exacerbaciones son raras, 2-3 veces al año, los ataques de asma a corto plazo se detienen al tomar varios medicamentos broncodilatadores en el interior); 2) moderado (exacerbaciones más frecuentes 3-4 veces al año, los ataques de asma son más graves y se detienen con inyecciones de medicamentos); 3) curso severo (caracterizado por exacerbaciones frecuentes y prolongadas, ataques severos, que a menudo se convierten en un estado asmático). La división de BA según la gravedad del curso es condicional. Entonces, con un curso leve de BA, el paciente puede morir de un estado asmático desarrollado repentinamente. Fases del curso de BA: 1) exacerbación (la presencia de ataques recurrentes de asma o condición asmática); 2) empeoramiento de la exacerbación (los ataques se vuelven más raros y leves, los signos físicos y funcionales de la enfermedad son menos pronunciados que en la fase de exacerbación); 3) remisión (las manifestaciones típicas del asma desaparecen: no ocurren ataques de asma; la permeabilidad bronquial se restaura total o parcialmente). complicaciones: 1) pulmonares: enfisema, insuficiencia pulmonar, atelectasias, neumotórax, estado asmático, etc.; 2) extrapulmonares: cor pulmonale (compensado y descompensado con el desarrollo de insuficiencia cardiaca derecha), distrofia miocárdica, etc. Cuadro clínico. El signo más característico del asma son las quejas de ataques de asfixia (dificultad para respirar principalmente durante la exhalación), dificultad para respirar y tos de varios tipos (seca, paroxística o con liberación de esputo viscoso). El desarrollo de una infección broncopulmonar provoca un aumento de la temperatura corporal. La dificultad resultante en la respiración nasal es una manifestación de rinosinusopatía alérgica (rinitis vasomotora, poliposis), que suele aparecer durante la fase previa al asma. Los datos de la historia ayudan a establecer una conexión entre el desarrollo de convulsiones y la exposición a ciertos alérgenos y otros factores. La mayoría de las veces es una infección del tracto respiratorio, especialmente en una exacerbación de la enfermedad. A partir de la anamnesis, aprenden sobre la influencia del esfuerzo físico (como la marcha rápida, la risa, etc.), los cambios en los factores meteorológicos (como el frío, la humedad elevada, etc.), los trastornos disováricos, los factores profesionales en la aparición del asma. ataques El estudio de una historia alérgica contribuye al diagnóstico de una variante atópica de BA. En tales casos, las exacerbaciones de la enfermedad son estacionales (más a menudo en primavera y verano), acompañadas de rinitis y conjuntivitis. Tales pacientes tienen urticaria, edema de Quincke; intolerancia alimentaria, se detectan una serie de sustancias medicinales; existe una predisposición hereditaria a las enfermedades alérgicas. Los datos de la anamnesis a menudo permiten establecer la presencia del llamado asma por aspirina. En este caso, no existe una forma hereditaria de enfermedades alérgicas. Estos pacientes están preocupados por la alteración de la respiración nasal (crecimientos de pólipos), y el síntoma más característico es la intolerancia a los antiinflamatorios no esteroideos (ácido acetilsalicílico, indometacina, etc.), que provocan ataques de asma. En este caso, ya es posible suponer un mecanismo prostaglandínico de la EA. Los datos sobre el desarrollo del estado asmático en el pasado indican la gravedad del curso de la enfermedad e indican la necesidad de terapia con corticosteroides. diagnósticos. De gran importancia es la identificación de manifestaciones extrapulmonares de alergias, signos de broncoobstrucción, complicaciones del asma y otras enfermedades acompañadas de ataques de broncoespasmo. Al examinar la piel, se pueden detectar manifestaciones alérgicas: urticaria, erupciones eritematosas papulares, lo que indica una variante inmunológica de BA. La combinación de asma con eccema, neurodermatitis, psoriasis predispone al asma grave. A menudo es posible identificar una violación de la respiración nasal. La rinitis y los pólipos se consideran preasma. La sinusitis y otras sinusitis pueden causar asfixia. El examen físico de los pulmones, a menudo debido a una bronquitis crónica subyacente, puede revelar signos de enfisema que conducen al desarrollo de insuficiencia respiratoria crónica y cor pulmonale. Se detectan signos auscultatorios de obstrucción bronquial: alteración de la respiración (espiración larga, seca, sobre todo sibilante, sibilante), espiración forzada, que revela broncoespasmo latente (aparición o aumento de sibilancias secas). La auscultación de los pulmones debe realizarse en la posición del paciente acostado: el número de estertores secos aumenta con su mecanismo "vagal". Escuchados constantemente en un área determinada, los estertores burbujeantes finos de voz húmeda ("crepitantes") pueden indicar una neumoesclerosis desarrollada. Un examen objetivo del paciente revela síntomas de otras enfermedades ("mariposa" en la piel de la cara, linfadenopatía en combinación con un aumento en el hígado y el bazo, un aumento persistente de la presión arterial, fiebre persistente, etc.), en el que ocurren ataques de broncoespasmo, manifestados por asfixia (lupus eritematoso sistémico, periarteritis nodular). Entonces el presunto diagnóstico de AD se vuelve improbable. La espirografía revela los signos característicos de la obstrucción bronquial obstructiva: disminución del volumen espiratorio forzado en el primer segundo (FEV1), disminución del coeficiente de Tiffno (FEV1 a VC como porcentaje) y el porcentaje de FEV1 a FZhEL. Durante la exacerbación de BA, el volumen pulmonar residual (RLV) y la capacidad residual funcional (FOC) superan el nivel inicial en un 100 % o más. Al analizar el espirograma, se encuentran signos de discinesia traqueobronquial, contribuyendo a la violación de la permeabilidad bronquial, por la presencia de una muesca en la parte superior del color descendente del espirograma (síntoma de Kolbet-Wyss). La neumotacometría muestra el predominio de la potencia inspiratoria sobre la espiratoria, lo que es característico de la obstrucción bronquial. De acuerdo con la neumotacografía con la construcción de la curva de "flujo - volumen", una violación de la permeabilidad bronquial se diagnostica por separado a nivel de los bronquios grandes, medianos y pequeños. La aparición de resistencia bronquial aumentada, registrada mediante espirografía, neumotacometría y neumotacografía, en respuesta a la actividad física, la inhalación de aire frío, gases irritantes y acetilcolina, indica una reactividad bronquial alterada. Las pruebas alergológicas se llevan a cabo utilizando un conjunto de varios alérgenos no infecciosos e infecciosos, se llevan a cabo solo fuera de la exacerbación de la enfermedad. Para evaluar el efecto provocador del alérgeno, se realizan pruebas alérgicas en la piel (aplicación, escarificación y métodos intradérmicos para aplicar el alérgeno), el alérgeno se puede aplicar a la conjuntiva del ojo, la mucosa nasal. El más confiable es el diagnóstico específico de asma: la identificación de hiperreactividad bronquial específica con la ayuda de pruebas de provocación por inhalación. Sin embargo, no se debe perder de vista que esta vía de administración puede provocar un ataque severo de asma o el desarrollo de un estado asmático. Para el diagnóstico específico de la EA, por ejemplo, cuando no es posible realizar una prueba alergológica, también se utiliza una prueba de radioinmunoabsorción, que permite cuantificar los anticuerpos IgE. Los estudios de laboratorio ayudan a confirmar el diagnóstico propuesto, evaluar la evolución de la enfermedad y la efectividad del tratamiento. El principal criterio de diagnóstico para la EA es la aparición de eosinófilos en el esputo, pero este es un signo inespecífico, puede servir como manifestación de una reacción alérgica general del cuerpo. También tiene importancia diagnóstica la detección de espirales de Kurshman y cristales de Charcot-Leiden en el esputo. Los estudios de laboratorio demuestran la presencia de un proceso inflamatorio activo y el grado de su gravedad en términos de un aumento de los indicadores de fase aguda. Con un aumento de la insuficiencia respiratoria en caso de exacerbación del asma y estado asmático, es importante estudiar el estado ácido-base y la composición de gases en sangre. El examen de rayos X diagnostica focos de infección (en los senos paranasales, dientes, vesícula biliar) y la presencia de agudo (neumonía) o exacerbación de un proceso inflamatorio crónico en los pulmones, enfisema y neumoesclerosis. Los datos del ECG demuestran signos del desarrollo de cor pulmonale compensado: hipertrofia del corazón derecho. Diagnóstico diferencial. La BA se diferencia del asma cardíaca (ver Tabla 8). Tabla 8 Diagnóstico diferencial de la EA
También es necesario diferenciar asma infecciosa-alérgica y atópica (ver tabla 9). Tabla 9 Asma infecciosa-alérgica y atópica
tratamiento. En el tratamiento del asma se recomienda un enfoque gradual, lo que se explica por la gravedad variable de su curso en diferentes personas y en el mismo paciente. La etapa 1 es el asma menos grave, la etapa 4 es la más grave. Paso 1: un curso intermitente leve en el que los síntomas de asma aparecen por la exposición a un desencadenante (p. ej., polen o pelo de animales) o debido al ejercicio. No está indicado el uso a largo plazo de medicamentos antiinflamatorios en el tratamiento de tales pacientes. El tratamiento consiste en medicación profiláctica si es necesario (β inhalado2agonistas, cromoglicato, nedocromil o anticolinérgicos). En ocasiones, las exacerbaciones más graves y prolongadas requieren un curso corto de corticosteroides orales. Si el asma se manifiesta con síntomas más frecuentes, un aumento en la necesidad de broncodilatadores, entonces es necesario pasar a la siguiente etapa. Etapa 2. Curso persistente leve. La terapia primaria incluye medicamentos antiinflamatorios, corticosteroides inhalados, cromoglicato de sodio o nedocromilo sódico. La dosis de corticosteroides es de 200-500 microgramos de dipropionato de beclometasona o budesonida por día. Para el tratamiento sintomático, β inhalado2-agonistas, pero no más de 3-4 veces al día. Para las exacerbaciones más graves y prolongadas, se administra un curso corto de corticosteroides orales. Si los síntomas persisten a pesar de una dosis inicial de corticosteroides inhalados, la dosis de dipropionato de beclometasona debe aumentarse a 750-800 microgramos por día. Sin embargo, una alternativa al aumento de la dosis de hormonas inhaladas, especialmente para controlar los ataques de asma nocturnos, es la adición de broncodilatadores de acción prolongada tomados por la noche (a una dosis de corticoides inhalados de al menos 500 mcg). La etapa 3 se caracteriza por una gravedad moderada de BA. Dichos pacientes requieren la ingesta diaria de medicamentos antiinflamatorios profilácticos. La dosis de corticoides inhalados es de 800-2000 mcg en combinación con broncodilatadores de acción prolongada. Puede usar teofilinas de acción prolongada (con un control constante de su concentración no más de 5-15 µg / ml), β oral e inhalada2agonistas de acción prolongada. Designar sintomáticamente β2-agonistas de acción corta o fármacos alternativos (etapa 2). Etapa 4. Asma severa, cuando no está completamente controlada. En este caso, el objetivo del tratamiento es lograr los mejores resultados posibles. El tratamiento primario consiste en corticosteroides inhalados en dosis altas (entre 800 y 2000 microgramos por día de dipropionato de beclometasona) en combinación con broncodilatadores de acción prolongada. Si es necesario, el β inhalado está indicado para aliviar los síntomas.2-agonistas de acción corta (no más de 3-4 veces al día). Una exacerbación más grave puede requerir un curso de tratamiento con corticosteroides orales, que se prescriben en dosis mínimas o en días alternos. Para prevenir el desarrollo de efectos secundarios, se administran altas dosis de corticosteroides inhalados a través de un espaciador. El paso 5 consiste en reducir la medicación de apoyo. Esto es posible si el asma se mantiene bajo control durante al menos 3 meses, lo que ayuda a reducir el riesgo de efectos secundarios y aumenta la susceptibilidad del paciente al tratamiento planificado. La "reducción" del tratamiento se lleva a cabo bajo el control constante de los síntomas, las manifestaciones clínicas y los indicadores de las funciones respiratorias mediante la reducción (cancelación) gradual de la última dosis o de medicamentos adicionales. Detener ataques. Un ataque leve se puede tratar en casa con broncodilatadores de acción corta. El tratamiento se lleva a cabo hasta que los síntomas desaparezcan por completo. Los ataques moderados y graves requieren no sólo dosis adecuadas de broncodilatadores de acción corta (β inhalados2-agonistas de acción corta), sino también el nombramiento de corticosteroides sistémicos. Si el paciente tiene hipoxemia, se debe administrar oxígeno. Para el tratamiento de ataques de asma en un centro médico u hospital, altas dosis de β inhalado2agonistas a través de un nebulizador. El uso de un inhalador de aerosol de dosis medida a través de un espaciador es muy eficaz. Preferiblemente, los corticosteroides se administran por vía oral, no por vía intravenosa. Cuando se usa teofilina o aminofilina en combinación con altas dosis de β2-agonistas no se proporciona efecto broncodilatador adicional, pero aumenta el riesgo de efectos secundarios. Las teofilinas solo pueden usarse en ausencia de β2-agonistas, sin embargo, pueden administrarse por vía intravenosa a razón de 6 mg/kg de aminofilina (o 5 mg/kg de teofilina) con una dosis constante de 0,5-1,0 mg/kg por hora durante 24 horas.2Los agonistas de acción corta también pueden usar epinefrina, pero son posibles efectos secundarios significativos con su uso. Los mucolíticos inhalados, los sedantes y los antihistamínicos, el sulfato de magnesio, la fisioterapia torácica, la hidratación con grandes volúmenes de líquidos para adultos y niños mayores no se recomiendan para el tratamiento de los ataques de asma para evitar el aumento de la tos. Prevención. La prevención primaria del asma incluye el tratamiento de pacientes en estado de preasma, la identificación de defectos biológicos en personas prácticamente sanas con antecedentes familiares que representan una amenaza para la aparición de asma, la eliminación de alérgenos, irritantes y otros factores potencialmente peligrosos del entorno de los pacientes que pueden conducir al desarrollo de la enfermedad. En el tratamiento de pacientes en estado de preasma, es necesario desinfectar los focos de infección, tratar la rinosinusopatía alérgica, aplicar varios métodos de tratamiento no farmacológico, que incluyen acupuntura y psicoterapia, terapia de ejercicios, baroterapia y tratamiento de spa. Es mostrada la realización de la hiposensibilización específica e inespecífica. CONFERENCIA N° 7. Enfermedades del aparato respiratorio. bronquitis crónica La bronquitis obstructiva crónica es una lesión inflamatoria difusa no alérgica del árbol bronquial, causada por los efectos irritantes prolongados sobre los bronquios de diversos agentes, que tiene un curso progresivo y se caracteriza por la ventilación pulmonar obstructiva, la formación de moco y la función drenante de los bronquios. árbol, que se manifiesta por tos, esputo y dificultad para respirar. Según la definición de la OMS, si un paciente expectora esputo la mayoría de los días durante al menos 3 meses consecutivos durante más de 2 años consecutivos, la enfermedad se considera bronquitis crónica (CB). La bronquitis crónica se divide en primaria y secundaria. La bronquitis crónica primaria es una enfermedad independiente que no se asocia a otros procesos broncopulmonares ni a daños en otros órganos y sistemas, en la que existe una lesión difusa del árbol bronquial. La CB secundaria se desarrolla en el contexto de otras enfermedades, tanto pulmonares (tuberculosis, bronquiectasias, etc.) como extrapulmonares (uremia, insuficiencia cardíaca congestiva, etc.). La mayoría de las veces es de naturaleza local (segmentaria). Considere HB primaria. Etiología. Tanto factores exógenos (humo de tabaco, contaminación del aire, condiciones profesionales desfavorables, factores climáticos e infecciosos) como factores endógenos (patología de la nasofaringe, dificultad para respirar por la nariz, enfermedades respiratorias agudas repetidas, bronquitis aguda e infección focal del tracto respiratorio superior). desempeñan un papel en el desarrollo de las vías CB., predisposición hereditaria, trastornos metabólicos (obesidad)). Patogenesia. Bajo la influencia de factores exógenos y con la participación de factores endógenos en el árbol traqueobronquial, las propiedades estructurales y funcionales de la membrana mucosa y la capa submucosa cambian, se desarrolla inflamación de la membrana mucosa y se altera la permeabilidad y la función de drenaje de los bronquios. Los cambios estructurales y funcionales en la membrana mucosa y la capa submucosa se expresan en hiperplasia e hiperfunción de las células caliciformes, glándulas bronquiales, hipersecreción de moco espeso y viscoso, lo que conduce a la interrupción del sistema de transporte mucociliar. Se reduce la cantidad de lisozima IgA secretora y lactoferrina producida. Se desarrolla edema de la membrana mucosa, y luego - atrofia y metaplasia del epitelio. La inflamación de la membrana mucosa es causada por varios irritantes en combinación con una infección (viral y bacteriana). Las sustancias químicas (contaminantes) contenidas en el aire tienen un efecto dañino en el tracto respiratorio, se produce hinchazón de la membrana mucosa y se produce una inhibición de la actividad del epitelio ciliado. Esto conduce a una violación de la evacuación y una disminución de la función de barrera de la mucosa bronquial. Los contenidos catarrales se reemplazan por catarral-purulentos y luego purulentos. La propagación del proceso inflamatorio a las secciones distales del árbol bronquial interrumpe la producción de surfactante y reduce la actividad de los macrófagos alveolares que fagocitan partículas extrañas. Si el broncoespasmo que ocurre en caso de inflamación es pronunciado, se desarrolla un componente broncoespástico (no alérgico). La infección asociada durante la exacerbación de la inflamación contribuye al desarrollo de un componente asmático (alérgico), lo que permite atribuir tal CB al preasma. El síndrome obstructivo se desarrolla debido a una combinación de varios factores: 1) espasmo de los músculos lisos de los bronquios como resultado de los efectos irritantes de factores exógenos y cambios inflamatorios en la membrana mucosa; 2) hipersecreción de moco, cambios en sus propiedades reológicas, que conducen a la interrupción del transporte mucociliar y bloqueo de los bronquios con un secreto viscoso; 3) metaplasia del epitelio de cilíndrico a escamoso estratificado y su hiperplasia; 4) violaciones de la producción de surfactante; 5) edema inflamatorio e infiltración mucosa; 6) colapso de pequeños bronquios y obliteración de bronquiolos; 7) cambios alérgicos en la membrana mucosa. Si los bronquios de gran calibre están involucrados en el proceso (bronquitis proximal), la obstrucción bronquial no se expresa. Pero en caso de daño a los bronquios pequeños y medianos, se produce una violación pronunciada de la permeabilidad bronquial. Sin embargo, con una lesión aislada de bronquios pequeños (bronquitis distal), desprovista de receptores para la tos, la dificultad para respirar puede ser la única evidencia de bronquitis desarrollada, y la tos aparece cuando los bronquios más grandes están involucrados en el proceso. Varias proporciones de cambios en la membrana mucosa causan la formación de una determinada forma clínica: 1) con bronquitis catarral no obstructiva, prevalecen cambios superficiales en las propiedades estructurales y funcionales de la membrana mucosa; 2) con bronquitis mucopurulenta (purulenta), predominan los procesos de inflamación infecciosa. Sin embargo, también es posible una situación en la que la bronquitis catarral a largo plazo debido a la adición de una infección puede volverse mucopurulenta, etc. En la variante no obstructiva de todas las formas clínicas de bronquitis crónica, los trastornos de ventilación son ligeramente pronunciados; 3) los trastornos obstructivos aparecen inicialmente solo en el contexto de una exacerbación de la enfermedad y son causados por cambios inflamatorios en los bronquios, hiper y discrinia, broncoespasmo (componentes reversibles de la obstrucción), pero luego persisten constantemente, mientras crece el síndrome obstructivo despacio. En la bronquitis crónica obstructiva, predominan el engrosamiento de la membrana mucosa y la capa submucosa, el edema y la hipersecreción, y también son característicos los trastornos persistentes de la ventilación. La obstrucción desarrollada de los bronquios pequeños conduce al enfisema. En su curso, HB sufre una cierta evolución. Como resultado del desarrollo de enfisema y neumoesclerosis, se observa una ventilación desigual de los pulmones, se forman áreas hiper e hipoventiladas. En combinación con cambios inflamatorios locales, esto conduce a alteración del intercambio gaseoso, insuficiencia respiratoria, hipoxemia arterial e hipertensión pulmonar, seguido del desarrollo de la principal afección potencialmente mortal: insuficiencia ventricular derecha. Clasificación. Actualmente no existe una clasificación generalmente aceptada de CB. Es importante dividir CB en variantes obstructivas y no obstructivas, en cada una de las cuales se puede desarrollar un proceso inflamatorio catarral (mucoso), catarral-purulento o purulento. La clasificación también incluye formas raras: CB hemorrágica y fibrinosa. Según el nivel de daño bronquial, se distinguen: con lesión predominante, bronquios grandes (bronquitis proximal) y con lesión predominante de bronquios pequeños (bronquitis distal) (N. R. Paleev, 1985). Cuadro clínico. Los principales síntomas de la CB son tos, producción de esputo y dificultad para respirar. Durante una exacerbación de la enfermedad o debido a hipoxia con desarrollo de insuficiencia pulmonar y otras complicaciones, se identifican síntomas generales (sudoración, debilidad, aumento de la temperatura corporal, fatiga, etc.). La tos es la manifestación más típica de la enfermedad. Según la naturaleza y consistencia del esputo, se puede suponer una variante del curso de la enfermedad. En la versión no obstructiva de la bronquitis catarral, la tos se acompaña de la liberación de una pequeña cantidad de esputo acuoso y mucoso (generalmente por la mañana, después del ejercicio o debido al aumento de la respiración). Al inicio de la enfermedad, la tos no molesta al paciente; la aparición de tos paroxística indica el desarrollo de obstrucción bronquial. La tos adquiere un tono de ladrido y es de naturaleza paroxística con colapso espiratorio pronunciado de la tráquea y los bronquios grandes. Con bronquitis purulenta y mucopurulenta, los pacientes están más preocupados por toser esputo. En caso de exacerbación de la enfermedad, el esputo adquiere un carácter purulento, su cantidad aumenta, a veces el esputo se excreta con dificultad (debido a la obstrucción bronquial durante la exacerbación). En la variante obstructiva de la bronquitis, la tos es improductiva y áspera, acompañada de dificultad para respirar, con una pequeña cantidad de esputo. La dificultad para respirar ocurre en todos los pacientes con bronquitis crónica en varios momentos. La aparición de dificultad para respirar en pacientes con "tos prolongada" inicialmente con un esfuerzo físico significativo indica la adición de una obstrucción bronquial. A medida que avanza la enfermedad, la dificultad para respirar se vuelve más pronunciada y constante, es decir, se desarrolla insuficiencia respiratoria (pulmonar). En la variante no obstructiva, la BC progresa lentamente, la dificultad para respirar suele aparecer 20-30 años después del inicio de la enfermedad. Dichos pacientes casi nunca corrigen la aparición de la enfermedad, sino que solo indican la aparición de complicaciones o exacerbaciones frecuentes. La anamnesis revela hipersensibilidad al enfriamiento y la mayoría de los pacientes informan haber fumado durante mucho tiempo. En varios pacientes, la enfermedad está asociada con los riesgos laborales en el trabajo. Al analizar un antecedente de tos, es necesario asegurarse de que el paciente no presente otra patología del aparato broncopulmonar (tuberculosis, tumores, bronquiectasias, neumoconiosis, enfermedades sistémicas del tejido conjuntivo, etc.), acompañada de los mismos síntomas. A veces, una historia indica hemoptisis debido a una leve vulnerabilidad de la mucosa bronquial. La hemoptisis recurrente indica una forma hemorrágica de bronquitis. Además, la hemoptisis en la bronquitis crónica a largo plazo puede ser el primer síntoma de cáncer de pulmón o bronquiectasias. diagnósticos. La auscultación revela respiración difícil (con el desarrollo de enfisema puede debilitarse) y sibilancias secas de naturaleza dispersa, cuyo timbre depende del calibre de los bronquios afectados (las sibilancias, claramente audibles al exhalar, son características del daño a los bronquios pequeños ). Los cambios en los datos de auscultación serán mínimos en la bronquitis crónica no obstructiva en remisión y más pronunciados durante la exacerbación del proceso (estertores húmedos de varios calibres que pueden desaparecer después de una buena tos y producción de esputo). Con una exacerbación de la bronquitis obstructiva, aumenta la dificultad para respirar, aumentan los fenómenos de insuficiencia respiratoria. Un secreto viscoso purulento complica aún más la permeabilidad de los bronquios. El componente obstructivo que se ha sumado a las formas de bronquitis catarral y mucopurulenta, y durante el período de exacerbación o en el curso de su evolución, agrava significativamente el curso de la bronquitis. Signos de obstrucción bronquial: prolongación de la fase espiratoria con respiración tranquila y sobre todo forzada; sibilancias al espirar (mejor auscultadas con respiración forzada y en decúbito supino); Síntomas de enfisema pulmonar obstructivo. En casos avanzados de bronquitis crónica y con el agregado de complicaciones, aparecen signos de enfisema de los pulmones, insuficiencia respiratoria y cardiaca (ventrículo derecho) - corazón pulmonar descompensado: acrocianosis, pastosidad o hinchazón de piernas y pies, cambios en las uñas de la forma de vidrios de reloj y las falanges terminales de las manos y los pies, en forma de baquetas, hinchazón de las venas cervicales, pulsación en la región epigástrica debido al ventrículo derecho, acento del tono II en el espacio intercostal II a la izquierda del esternón, agrandamiento del hígado. Afecta el cuadro de la enfermedad y la adición de un componente asmático (alérgico), cuando existe un parecido con el asma bronquial. Los indicadores de laboratorio e instrumentales tienen diferente grado de significación dependiendo de la etapa del proceso. En el período inicial de la enfermedad o en la fase de remisión, puede no haber cambios. Sin embargo, estos indicadores son de gran importancia para identificar la actividad del proceso inflamatorio; aclaración de la forma clínica de la enfermedad; identificar complicaciones; diagnóstico diferencial con enfermedades que tienen síntomas clínicos similares. El examen de rayos X de los órganos del tórax se realiza en todos los pacientes con bronquitis crónica; sin embargo, como regla general, no hay cambios en los pulmones en las radiografías simples. Puede haber una deformación de malla del patrón pulmonar, debido al desarrollo de neumoesclerosis. Con un largo curso del proceso, se revelan signos de enfisema. Con el desarrollo del corazón pulmonar, aparece un abultamiento del tronco de la arteria pulmonar en el contorno izquierdo de la sombra del corazón, expansión de las arterias basales, seguida de su estrechamiento en forma de cono y una disminución del diámetro de las arterias periféricas. sucursales. El examen de rayos X juega un papel importante en el diagnóstico de complicaciones (neumonía aguda, bronquiectasias) y en el diagnóstico diferencial con enfermedades con síntomas similares. La broncografía se usa solo para diagnosticar bronquiectasias. La broncoscopia es de gran importancia en el diagnóstico de la bronquitis crónica y su diferenciación de enfermedades que manifiestan un cuadro clínico similar. Confirma la presencia de un proceso inflamatorio; aclara la naturaleza de la inflamación (el diagnóstico de bronquitis hemorrágica o fibrinosa se realiza solo después de este estudio); revela trastornos funcionales del árbol traqueobronquial (es especialmente importante identificar el colapso espiratorio: discinesia de la tráquea y los bronquios grandes); ayuda en la identificación de lesiones orgánicas del árbol bronquial. Además, la broncoscopia permite obtener el contenido de los bronquios o lavados para estudios microbiológicos, parasitológicos y citológicos. El estudio de la función de la respiración externa se realiza para identificar trastornos restrictivos y obstructivos de la ventilación pulmonar. De acuerdo con el espirograma, se calcula el índice de Tiffno (la relación entre el volumen espiratorio forzado en 1 s - FEV1 a la capacidad vital de los pulmones - VC como porcentaje) y un indicador de la velocidad del aire - PSV (la relación de ventilación máxima de los pulmones - MVL a VC). Con el desarrollo del síndrome obstructivo, hay una disminución en los indicadores de velocidad absoluta de la respiración externa (MVL y FEV1) superando el grado de reducción de VC; el índice de Tiffno disminuye y la resistencia bronquial a la espiración aumenta. Según la neumotacometria, el predominio de la potencia inspiratoria sobre la espiratoria se revela como un signo precoz de obstrucción bronquial. La identificación de violaciones de la permeabilidad bronquial en diferentes niveles del árbol bronquial es posible con la ayuda de neumotacógrafos especiales, que permiten obtener una curva de "flujo - volumen". La obstrucción periférica se caracteriza por una disminución significativa de la curva flujo-volumen en la zona de bajo volumen. La evaluación conjunta de la resistencia bronquial y los volúmenes pulmonares también ayuda a determinar el nivel de obstrucción. En el caso de obstrucción a nivel de los grandes bronquios, se produce un aumento del volumen residual de los pulmones (RLV), y no aumenta la capacidad pulmonar total (TLC). Con la obstrucción periférica, se observa un aumento más significativo de TRL y un aumento de TRL. Para identificar la proporción de broncoespasmo en la proporción total de obstrucción bronquial, se estudia la ventilación y la mecánica respiratoria tras una serie de pruebas farmacológicas. Después de la inhalación de aerosoles broncodilatadores, el rendimiento de la ventilación mejora en presencia de un componente espástico de obstrucción de las vías respiratorias. Se realiza una radiopulmonografía con el isótopo radiactivo 133Xe para detectar una ventilación irregular asociada con la obstrucción de los bronquios pequeños. Este es el signo diagnóstico más temprano de este tipo de obstrucción bronquial. La electrocardiografía es necesaria para detectar la hipertrofia del ventrículo derecho y la aurícula derecha que se desarrolla en la hipertensión pulmonar. Se detecta una desviación pronunciada del eje QRS hacia la derecha, un cambio de la zona de transición hacia la izquierda (R / S < 1 en V4-V6), ECG tipo S; onda P alta y aguda en las derivaciones VF, III, II. Un análisis de sangre clínico revela eritrocitosis secundaria resultante de la hipoxia crónica con el desarrollo de insuficiencia pulmonar grave. Los indicadores de "fase aguda" se expresan moderadamente: la VSG es normal o aumenta moderadamente, la leucocitosis es pequeña, así como el cambio de la fórmula de leucocitos hacia la izquierda. Como evidencia de manifestaciones alérgicas, es posible la eosinofilia. El estudio del esputo y del contenido bronquial ayuda a establecer la gravedad de la inflamación. Con inflamación severa, los contenidos son purulentos o mucosos purulentos, contienen muchos neutrófilos y macrófagos individuales, las células alteradas distróficamente del epitelio ciliado y escamoso están mal representadas. Para la inflamación moderada, los contenidos están más cerca de mucopurulentos; se reduce el número de neutrófilos, aumenta el número de macrófagos, moco y células epiteliales bronquiales. Con inflamación leve, el contenido bronquial es mucoso, predominan las células descamadas del epitelio y los bronquios; los macrófagos y los neutrófilos son escasos. El examen microbiológico del esputo y el contenido bronquial es importante para identificar la etiología de las exacerbaciones de la bronquitis crónica y la elección de la terapia antimicrobiana. Diagnóstico diferencial. Tabla 10 Criterios diagnósticos diferenciales para CB
tratamiento. Incluye un conjunto de medidas que se diferencian durante el período de exacerbación y remisión de la enfermedad. Durante la exacerbación de una enfermedad crónica, se distinguen dos direcciones de tratamiento: etiotrópica y patogénica. El tratamiento etiotrópico tiene como objetivo eliminar el proceso inflamatorio en los bronquios: está indicada la terapia con antibióticos, sulfanilamidas, antisépticos, fitoncidas, etc.. El tratamiento se inicia con antibióticos de la serie de las penicilinas (penicilina, ampicilina) o un grupo de cefalosporinas (cefamesina , tseporina), y en ausencia de efecto, se usan antibióticos del grupo de reserva (gentamicina, etc.). La vía de administración más preferida es la intratraqueal (aerosol o relleno con una jeringa laríngea a través de un broncoscopio). El tratamiento patogenético está dirigido a mejorar la ventilación pulmonar; restauración de la permeabilidad bronquial; control de la hipertensión pulmonar y de la insuficiencia ventricular derecha. La restauración de la ventilación pulmonar, además de la eliminación del proceso inflamatorio en los bronquios, se ve facilitada por la oxigenoterapia y la terapia de ejercicios. Lo principal en el tratamiento de la bronquitis crónica, la restauración de la permeabilidad bronquial, se logra mejorando su drenaje y eliminando el broncoespasmo. Para mejorar el drenaje bronquial, se prescriben expectorantes (bebida alcalina caliente, decocciones de hierbas, mukaltin, etc.), medicamentos mucolíticos (acetilcisteína, bromhexina; con secreción viscosa purulenta - aerosoles de enzimas proteolíticas - quimopsina, tripsina); se utiliza la broncoscopia terapéutica. Para eliminar el broncoespasmo, se usa eufillin (por vía intravenosa, en supositorios, tabletas), efedrina, atropina; Son posibles las citas individuales en un aerosol de medicamentos simpaticomiméticos: fenoterol, sulfato de orciprenalina (asthmopenta) y una nueva droga doméstica "Soventol", medicamentos anticolinérgicos: atrovent, troventol. Preparaciones efectivas de aminofilina prolongada (teopec, teodur, theobelong, etc.) - 2 veces al día. En ausencia del efecto de dicha terapia, se administran pequeñas dosis de corticosteroides por vía oral (10-15 mg de prednisolona por día) o por vía intratraqueal (suspensión de hidrocortisona - 50 mg). Como terapia adicional, designe: 1) medicamentos antitusivos: con tos improductiva: libexina, tusuprex, bromhexina, con tos seca: codeína, dionina, stoptussin; 2) medicamentos que aumentan la resistencia del cuerpo: vitaminas A, C, grupo B, estimulantes biogénicos. Actualmente, en el tratamiento de la bronquitis crónica, se utilizan cada vez más fármacos inmunocorrectores: T-activina o timalina (100 mg por vía subcutánea durante 3 días); adentro - catergen, nucleinato de sodio o pentoxil (dentro de 2 semanas), levamisol (decaris). Tratamiento de fisioterapia: prescribir diatermia, electroforesis en cloruro cálcico, cuarzo en la zona pectoral, masaje torácico y ejercicios respiratorios. Con bronquitis moderada y severa, junto con tratamiento anti-recaída y sanatorio, muchos pacientes se ven obligados a recibir constantemente medicamentos de apoyo. La terapia de mantenimiento tiene como objetivo mejorar la permeabilidad bronquial, reducir la hipertensión pulmonar y combatir la insuficiencia ventricular derecha. Se prescriben los mismos medicamentos que en el período de exacerbación, solo en dosis más pequeñas, en cursos. Pronóstico. El pronóstico de recuperación completa es desfavorable. El pronóstico menos favorable es para el CB obstructivo y el CB con daño predominante a los bronquios distales, lo que conduce rápidamente al desarrollo de insuficiencia pulmonar y la formación de cor pulmonale. El pronóstico más favorable es para el CB superficial (catarral) sin obstrucción. CONFERENCIA N° 8. Enfermedades del aparato respiratorio. Neumonía La neumonía es una enfermedad infecciosa e inflamatoria aguda de naturaleza focal, en la que las secciones respiratorias y el tejido conectivo intersticial de los pulmones están involucrados en el proceso patológico. Clasificación de E. V. Gembitsky (1983). Por etiología: 1) bacteriano (que indica el patógeno); 2) viral (que indica el patógeno); 3) cornitico; 4) rickettsias; 5) micoplasma; 6) hongos; 7) mixto; 8) infeccioso-alérgico; 9) etiología desconocida. Por patogenia: 1) primario (proceso inflamatorio agudo independiente); 2) secundario (complicación de enfermedades del sistema cardiovascular con trastornos circulatorios en la circulación pulmonar, enfermedades crónicas de los riñones, sistemas sanguíneos, metabolismo, enfermedades infecciosas o desarrollarse en el contexto de enfermedades respiratorias crónicas). Características clínicas y morfológicas: 1) parenquimatoso (para neumonía neumocócica): crupous; focal; 2) intersticial. Por localización y extensión: unilateral; bilateral. Por gravedad: extremadamente grave; pesado; moderado; leve y abortivo. Aguas abajo: fuerte; prolongada (resolución radiológica y clínica de la neumonía). Etiología. La mayoría de las neumonías son de origen infeccioso. Las neumonías alérgicas y las causadas por factores físicos o químicos son raras. La neumonía bacteriana se diagnostica con mayor frecuencia en personas de mediana edad y ancianas; neumonía viral - en jóvenes. En la etiología de la neumonía bacteriana primaria, el papel principal lo desempeñan los neumococos. Durante una epidemia de influenza, aumenta el papel de las asociaciones virales y bacterianas (generalmente estafilococos), así como de los microorganismos oportunistas. En la neumonía secundaria, el papel etiológico principal lo desempeñan las bacterias gramnegativas (klebsiella pneumoniae y el bacilo de la influenza); en la aparición de neumonía por aspiración, la importancia de la infección por anaerobios es grande. Patogenesia. El patógeno infeccioso ingresa desde el exterior a las secciones respiratorias de los pulmones a través de los bronquios: inhalación y aspiración (desde la nasofaringe o la orofaringe). Por vía hematógena, el patógeno ingresa a los pulmones principalmente durante la neumonía secundaria o durante la génesis trombótica de la neumonía. La propagación linfogénica de la infección con aparición de neumonía se observa solo en caso de heridas en el pecho. También existe un mecanismo endógeno para el desarrollo de la inflamación en el tejido pulmonar, debido a la activación de la microflora en los pulmones. Su papel es grande en la neumonía secundaria. El desarrollo de la neumonía se ve facilitado por factores desfavorables del entorno externo e interno, bajo cuya influencia hay una disminución de la resistencia general inespecífica del cuerpo (supresión de la fagocitosis, producción de bacteriolisinas, etc.) y supresión de local mecanismos de defensa (deterioro del aclaramiento mucociliar, disminución de la actividad fagocítica de los macrófagos alveolares y neutrófilos, etc.) . También se atribuye una importancia significativa en la patogenia de la neumonía a las reacciones alérgicas y autoalérgicas. Los saprófitos y los microorganismos patógenos, al convertirse en antígenos, contribuyen a la producción de anticuerpos que se fijan en las células de la membrana mucosa del tracto respiratorio, donde se produce la reacción antígeno-anticuerpo, lo que conduce al daño tisular y al desarrollo del proceso inflamatorio. En presencia de determinantes antigénicos comunes de microorganismos y tejido pulmonar, o cuando el tejido pulmonar es dañado por virus, microorganismos, toxinas y sustancias tóxicas, lo que conduce a la manifestación de sus propiedades antigénicas, se desarrollan procesos autoalérgicos. Estos procesos contribuyen a una existencia más prolongada de cambios patológicos y un curso prolongado de la enfermedad. Cuadro clínico. Principales síndromes: 1) intoxicación (debilidad general, fatiga, dolores de cabeza y musculares, dificultad para respirar, palpitaciones, palidez, pérdida de apetito); 2) un síndrome de cambios inflamatorios generales (sensación de calor, escalofríos, fiebre, cambios en los recuentos sanguíneos de fase aguda: leucocitosis con un cambio de la fórmula de leucocitos hacia la izquierda, un aumento en la VSG, nivel de fibrinógeno, α2-globulinas, la aparición de proteína C reactiva); 3) un síndrome de cambios inflamatorios en el tejido pulmonar (aparición de tos y esputo, acortamiento del sonido de percusión), aumento de la voz temblorosa y broncofonía, cambios en la frecuencia y naturaleza de la respiración, aparición de estertores húmedos, cambios radiológicos; 4) síndrome de afectación de otros órganos y sistemas. La gravedad de estas manifestaciones caracteriza la gravedad del curso de la neumonía (ver Tabla 11). Tabla 11 Síntomas y curso de la neumonía.
En varias etapas del curso de la neumonía, el cuadro clínico puede cambiar debido a la adición de ciertas complicaciones: pulmonares y extrapulmonares. Pulmonar: formación de abscesos; pleuresía (para y metaneumónica), con menos frecuencia - empiema pleural; es posible la adhesión de un componente asmático, la formación de edema pulmonar y el desarrollo de insuficiencia respiratoria aguda. Complicaciones extrapulmonares: shock infeccioso-tóxico (con síntomas de insuficiencia vascular aguda, ventricular izquierda aguda y renal, ulceración de la membrana mucosa del tracto digestivo y sangrado, desarrollo de coagulación intravascular diseminada; miocarditis alérgica infecciosa; endocarditis infecciosa; pericarditis; meningitis o meningoencefalitis, nefritis, hepatitis En la neumonía cruposa grave, pueden desarrollarse psicosis por intoxicación, y en la neumonía total confluente, corazón pulmonar agudo. Las principales quejas de un paciente con neumonía: tos, producción de esputo, dolor en el pecho, agravado por la respiración y la tos, dificultad para respirar, alteración del bienestar general, fiebre. La tos puede ser seca o con expectoración (mucosa, mucopurulenta, purulenta-mucosa, sanguinolenta). El esputo "oxidado" es característico de la neumonía lobar, con sangre, para la neumonía causada por Klebsiella (bacilo de Fridlander) y neumonía viral; el esputo sanguinolento purulento indica neumonía de origen estreptocócico. La tos persistente con una pequeña cantidad de esputo mucopurulento se observa con neumonía por micoplasma, que también se caracteriza por una sensación de dolor en la garganta. El dolor en el costado, agravado por la respiración profunda y la tos, es característico de la neumonía neumocócica lobar, así como la participación de la pleura en el proceso patológico. Con la localización de la neumonía en las partes inferiores de los pulmones y la participación de la pleura diafragmática en el proceso, el dolor puede irradiarse a la cavidad abdominal, simulando un cuadro de abdomen agudo. Si el segmento de caña superior o inferior del pulmón izquierdo está involucrado en el proceso, los dolores se localizan en la región del corazón. En el 25% de los pacientes, la queja de dificultad para respirar es una de las principales, especialmente con neumonía que se desarrolló en el contexto de enfermedades respiratorias crónicas e insuficiencia cardíaca. La gravedad de la dificultad para respirar aumenta en paralelo con la violación del bienestar general. Los síntomas de intoxicación grave son más característicos de la neumonía cornítica y micoplásmica, y también se observan en la neumonía estafilocócica, gripal y neumocócica (crouposa). El paciente puede verse perturbado por escalofríos y un aumento de la temperatura corporal a febril. En el contexto general de intoxicación y temperatura febril, aparecen síntomas locales. diagnósticos. Para realizar un diagnóstico etiológico es importante una correcta valoración de los síntomas de la enfermedad desde su inicio. La ronquera o la incapacidad para hablar es característica de la neumonía causada por el virus de la parainfluenza. Lagrimeo, dolor en los ojos, dolor de garganta al tragar, secreción abundante de la nariz sin cambiar otras partes del tracto respiratorio ocurren con neumonía causada por adenovirus. Lo más significativo para el diagnóstico es la presencia de un síndrome de cambios inflamatorios en el tejido pulmonar. Este síndrome consta de los siguientes síntomas: 1) retraso en la respiración del lado afectado del tórax; 2) acortamiento del sonido de percusión en el área de proyección de la lesión en mayor o menor extensión; 3) aumento de la voz temblorosa y broncofonía en la misma zona; 4) cambio en la naturaleza de la respiración (dura, bronquial, debilitada, etc.); 5) la aparición de ruidos respiratorios patológicos (voz húmeda, estertores burbujeantes finos y crepitación). La naturaleza de la respiración puede cambiar de diferentes maneras. En la etapa inicial de la neumonía cruposa, la respiración puede debilitarse, con una exhalación prolongada; en la fase de hepatización, junto con un aumento en la sordera del sonido de percusión, se escucha la respiración bronquial; con la resolución del foco neumónico con una disminución de la matidez de la percusión, la respiración se vuelve difícil. En la neumonía focal, los síntomas más constantes son respiración dificultosa y estertores burbujeantes finos y húmedos. Sin embargo, con la neumonía hiliar central, los datos físicos se presentan muy mal y el reconocimiento de la neumonía solo es posible después de un examen de rayos X. Las neumonías por micoplasma se distinguen por la escasez de datos físicos. En la neumonía causada por Klebsiella pneumoniae se observa una intoxicación grave, combinada con un número muy reducido de sibilancias. En algunos casos, durante la auscultación, pueden aparecer una gran cantidad de estertores secos graves y agudos, no característicos del síndrome de infiltración inflamatoria. Esto ocurre con la neumonía que se ha desarrollado en el contexto de la bronquitis crónica; neumonía causada por la vara de Pfeiffer; en caso de adhesión a la neumonía de un componente alérgico. Los síntomas ayudan a hacer un diagnóstico etiológico: 1) la detección de una erupción de manchas pequeñas, como con la rubéola, en combinación con linfadenopatía es característica de la infección por adenovirus; 2) el agrandamiento local de los ganglios linfáticos indica neumonía perifocal; 3) neumonía fúngica combinada con lesiones de las membranas mucosas, piel y uñas; 4) el síndrome hepatolienal y la ictericia leve se encuentran en las neumonías corníticas y por Curickettsial; 5) para la neumonía cruposa típica, la apariencia del paciente es característica: una cara pálida con un rubor febril en el lado de la lesión, erupciones herpéticas, hinchazón de las alas de la nariz al respirar. El método más importante para aclarar la presencia de neumonía y el grado de participación del tejido pulmonar en el proceso es la fluorografía de gran marco y el examen de rayos X de los órganos del tórax. Las neumonías estafilocócicas se distinguen por una clara segmentación de las lesiones pulmonares con la participación de varios segmentos en el proceso. Su signo radiológico característico es la formación de múltiples cavidades en los pulmones del tipo neumocele en el día 5-7 desde el inicio de la enfermedad y, más tarde, cavidades necróticas con presencia de líquido. A diferencia de los verdaderos abscesos, la configuración y el número de cavidades cambian rápidamente. La lesión lobular es una manifestación de neumonía cruposa o neumonía causada por Klebsiella. El lóbulo superior, principalmente el pulmón derecho, es el más comúnmente afectado. El examen de rayos X revela un derrame en la cavidad pleural. A menudo, tal derrame ocurre con neumonía estreptocócica, con neumonía causada por el palo de Pfeiffer, que se localiza en el lóbulo inferior y en 2/3 de los pacientes captura más de un lóbulo del pulmón. Los datos del examen de rayos X son especialmente importantes para detectar neumonía con cambios auscultatorios leves (neumonía intersticial e hiliar). En algunos casos, para aclarar el diagnóstico, están indicadas la tomografía y la broncografía, que ayudan a aclarar el diagnóstico en casos de regresión tardía de cambios infiltrativos, con un curso complicado (absceso, derrame en la cavidad pleural). Se utilizan para excluir otros procesos patológicos con presentaciones clínicas y radiológicas similares. La broncografía revela cavidades en descomposición en el tejido pulmonar, así como la presencia de bronquiectasias, alrededor de las cuales son posibles los cambios infiltrativos (neumonía perifocal) durante la exacerbación. En el diagnóstico de neumonía por infarto, un estudio con radionúclidos del flujo sanguíneo pulmonar juega un cierto papel, revelando sus violaciones. El examen bacteriológico del esputo (o lavados bronquiales) antes de la designación de antibióticos ayuda a detectar el patógeno y determinar su sensibilidad a los antibióticos. No siempre identificado microorganismo es el agente causal de la neumonía. Se puede realizar un diagnóstico etiológico más preciso mediante estudios inmunológicos: reacción de fijación del complemento (RCC) y reacción de inhibición de la hemaglutinación (HITA) con antígenos virales y bacterianos. En el diagnóstico de neumonía viral y viral-bacteriana, los estudios virológicos y serológicos son importantes (los resultados de un estudio de cultivo de esputo, incluida una prueba biológica en ratones, un método de cultivo de virus en un embrión de pollo en desarrollo, un método de inmunofluorescencia, un método serológico que utiliza sueros emparejados contra virus, dan importancia a un aumento de solo 4 veces en el título de anticuerpos). El examen de esputo ayuda a aclarar la naturaleza de la neumonía. Una gran cantidad de eosinófilos indica procesos alérgicos, la presencia de células atípicas indica neumonía de origen canceroso; Mycobacterium tuberculosis se encuentra en la tuberculosis; fibras elásticas - evidencia del colapso del tejido pulmonar. Con la neumonía por micosis, junto con la detección de hongos, hay una falta de flora piógena debido al efecto inhibidor de los productos de desecho de los hongos. De acuerdo con la microscopía de frotis de esputo teñidos con Gram, podemos hablar de microorganismos Gram-negativos o Gram-positivos que viven en los bronquios ya en el primer día de la estadía del paciente en el hospital. La gravedad del proceso inflamatorio se juzga por la gravedad de los parámetros sanguíneos de fase aguda y su dinámica (leucocitosis con un cambio en la fórmula de leucocitos, un aumento en la ESR, un mayor contenido de α2-globulinas, fibrinógeno, la aparición de SRV, un aumento en el nivel de ácidos siálicos). Con un curso prolongado de neumonía y el desarrollo de complicaciones, se estudia la reactividad inmunológica del cuerpo. Una disminución de la inmunidad humoral (IgM) y celular (migración retardada de leucocitos, cambios en las pruebas que caracterizan el sistema de linfocitos T) requiere terapia inmunomoduladora. tratamiento. Inmediatamente después del diagnóstico, es necesario iniciar una terapia etiotrópica para la neumonía. Las ideas empíricas sobre un posible patógeno son de gran importancia, ya que el examen bacteriológico del esputo se lleva a cabo durante bastante tiempo y en la mayoría de los pacientes, incluso con un enfoque moderno de este estudio, se obtienen resultados inciertos y, a veces, erróneos. Actualmente, las penicilinas han perdido su importancia como fármaco de elección en el tratamiento de la neumonía. Esto se debe al hecho de que etiológicamente significativos para el desarrollo de neumonía, además del neumococo y Haemophilus influenzae, son microorganismos intracelulares obligados: Mycoplasma pneumoniae y Chlamydia pneumoniae, que son resistentes a los efectos bactericidas de los antibióticos del grupo de los betalactámicos. Es imposible perder de vista el hecho de que la hipersensibilidad a estos medicamentos se desarrolla rápidamente en los pacientes. En relación con lo anterior, en el tratamiento de la neumonía se presta mucha atención a los macrólidos, que han demostrado su eficacia no sólo contra el neumococo, sino también contra Mycoplasma pneumoniae, Chlarnydia pneumoniae. Sin embargo, es importante no perder de vista el hecho de que la eritromicina, que es el estándar de este grupo de fármacos debido a su baja estabilidad en un ambiente ácido (y por lo tanto su baja biodisponibilidad), así como la prevalencia generalizada de cepas de neumococo resistentes a la eritromicina, está perdiendo su valor clínico. Como fármacos de elección, fue reemplazado por otros fármacos de la clase de macrólidos: azitromicina, roxitromicina, rovamicina, etc. También se utilizan varios macrólidos para uso oral y parenteral (por ejemplo, rovamicina). Como resultado, su uso está justificado en el curso severo del proceso inflamatorio en el pulmón (por ejemplo, inicialmente se administra rovamicina por vía intravenosa durante 2-3 días y, posteriormente, con una dinámica positiva del proceso patológico, el paciente cambia a tomando esta droga adentro). La ventaja de la rovamicina es innegable, ya que no interactúa con las teofilinas, al tiempo que evita la posibilidad de una sobredosis de estos fármacos, ya que las teofilinas y la rovamicina se usan juntas en el tratamiento de pacientes con enfermedades pulmonares obstructivas crónicas. También se sabe que este subgrupo de macrólidos (macrólidos 16-mer) son fármacos con un nivel mínimo de efectos secundarios. En pacientes mayores de 65 años, debido a la heterogeneidad del espectro etiológico de la neumonía y con enfermedades pulmonares obstructivas crónicas concomitantes, las penicilinas semisintéticas pueden usarse para la terapia antibiótica inicial, y en ausencia de un efecto positivo después de esta terapia para 3-4 días, se justifica el uso de cefalosporinas. Es importante recordar que el espectro de acción de las cefalosporinas de I y algunas de II generación es sobre microorganismos grampositivos y gramnegativos, y las cefalosporinas de III generación actúan principalmente sobre patógenos gramnegativos. Las cefalosporinas de la generación I están representadas por cefalotina (keflin), cefazolina (kefzol), etc. Los medicamentos de la generación II incluyen cefuroxima (ketocef), cefoxitina (boncefin) y otros. Las cefalosporinas de la generación III: cefotaxima (claforan), cefoperazona (cefobid), ceftriaxona ( longacef). La neumonía por aspiración se asocia con microflora anaeróbica o gramnegativa, lo que determina el uso de aminoglucósidos o cefalosporinas de III generación en combinación con semisuccinato de metronidazol (500 mg por vía intravenosa 2-3 veces al día). Los estados de inmunodeficiencia también afectan la naturaleza de los fármacos seleccionados, que en este caso depende de la naturaleza del patógeno. En tales casos, el esquema aplicado consiste en aminoglucósidos y cefalosporinas modernas. La duración de la terapia antibiótica efectiva para un paciente con neumonía es de 7 a 10 días. Al prescribir el tratamiento, se debe tener en cuenta que en el 7-15% de los casos, esta terapia puede no tener efecto. Esto indica la necesidad de reemplazar los antibióticos, con base en los resultados de un estudio microbiológico. Otra opción es el uso de fármacos alternativos, los llamados antibióticos de segunda elección: modernas cefalosporinas, imipenem, monobactámicos, fluoroquinolonas. Las fluoroquinolonas (ofloxacina, pefloxacina, ciprofloxacina) son eficaces contra patógenos gramnegativos, incluida Pseudomonas aeruginosa y algunos cocos grampositivos (Staphylococcus aureus), pero son inactivas cuando se exponen a anaerobios. Las fluoroquinolonas pueden considerarse justificadamente como una alternativa a los macrólidos en las infecciones por clamidia, legionela y micoplasma. Los antibióticos monobactámicos en su forma moderna están representados por aztreonam (azactam), que es activo principalmente contra aerobios gramnegativos (Salmonella, Shigella, Proteus, Escherichia coli, Klebsiella, etc.); y también es estable bajo la acción de las β-lactamasas. Imipenem, un medicamento antibacteriano del grupo carbapenem, se prescribe solo en combinación con cilastatina, que inhibe el metabolismo de imipenem. El fármaco es muy eficaz contra muchos anaerobios, cocos grampositivos y bacilos gramnegativos. Dosificación de antibióticos utilizados en el tratamiento de la neumonía. 1) Penicilinas: bencilpenicilina (500-000 UI por vía intravenosa cada 1-000 horas o 000-6 UI cada 8 horas por vía intramuscular), ampicilina (500-000-1 g por vía intramuscular cada 000-000 horas o 4 g cada 0,5 horas por vía intravenosa), amoxicilina (1,0-2,0 g cada 6 horas por vía oral o 8-0,5 g cada 6-0,5 horas por vía intramuscular, intravenosa), oxacilina (1,0 g cada 8-0,5 horas por vía oral, intramuscular, intravenosa). 2) Cefalosporinas: I generación - cefalotina (keflin) (0,5-2,0 g cada 4-6 horas por vía intramuscular, por vía intravenosa), cefazolina (kefzol) (0,5-2,0 g, cada 8 horas por vía intramuscular, por vía intravenosa), II generación - cefuroxima (zinacef , ketocef) (0,75-1,5 g cada 6-8 horas por vía intramuscular, por vía intravenosa), III generación - cefotaxima (claforan) (1,0-2,0 g, máximo hasta 12 g / día cada 12 horas por vía intramuscular, por vía intravenosa), ceftriaxona (longacef, rocefin) (1,0-2,0-4,0 g cada 24 horas por vía intramuscular, intravenosa). 3) Aminoglucósidos: genetamicina (80 mg cada 12 horas por vía intramuscular, intravenosa), amikacina (10-15 mg/kg cada 12 horas por vía intramuscular, intravenosa), tobramicina (brulamicina) (3-5 mg/kg cada 8 horas por vía intramuscular, intravenosa) . 4) Macrólidos: eritromicina (0,5 g cada 6-8 horas por vía oral o 0,5-1,0 g cada 6-8 horas por vía intravenosa), rovamicina (3,0 millones de UI cada 8-12 horas por vía oral o 1,5-3,0 millones de UI cada 8-12 horas horas por vía intravenosa). 5) Fluoroquinolonas: pefloxacina (leflacina) (400 mg cada 12 horas por vía oral, IV), ciprofloxacina (cyprobay) (500 mg cada 12 horas por vía oral o 200-400 mg cada 12 horas por vía intravenosa), ofloxacina (zanocin, tarivid) (200 mg cada 12 horas por vía oral). 6) Tetraciclinas: doxiciclina (vibramicina) (200 mg el día 1, en los días posteriores - 100 mg cada 24 horas por vía oral), minociclina (minocina) (200 mg el día 1, en los días posteriores - 100 mg cada 12 horas por vía oral), aztreonam (azactam) (1,0-2,0 g cada 8-12 horas), imipenem/cilstatina (thienam) (500 mg cada 6-8 horas por vía intramuscular). También es significativo que, por regla general, un curso prolongado o progresivo de la enfermedad se debe a una terapia antibiótica inicial inadecuada. Sin embargo, además de esto, existen una serie de causas locales y sistémicas que conducen a un curso prolongado y persistente de inflamación en los pulmones: estas son la obstrucción local de las vías respiratorias (cáncer, adenoma, bloqueo mucoide, etc.); bronquiectasias (congénitas, adquiridas); fibrosis quística; defectos del sistema inmunitario (adquiridos); aspiración recurrente (acalasia, cáncer de esófago, etc.); activación de la infección tuberculosa latente; absceso pulmonar en desarrollo; terapia antibiótica inadecuada. CONFERENCIA N° 9. Enfermedades del aparato digestivo. Enfermedades del esófago. Esofagitis y úlcera péptica del esófago 1. Esofagitis aguda La esofagitis aguda es una lesión inflamatoria de la membrana mucosa del esófago que dura desde varios días hasta 2-3 meses. Etiología y patogénesis. Factores etiológicos: enfermedades infecciosas, lesiones, quemaduras, intoxicaciones, reacciones alérgicas, errores nutricionales. De los agentes infecciosos, los más característicos de la esofagitis aguda son la difteria, la escarlatina, la fiebre tifoidea y el tifus, la influenza, la parainfluenza, la infección por adenovirus, las paperas. Los factores dañinos físicos y químicos están representados por la radiación ionizante, las quemaduras químicas, los alimentos calientes y muy fríos y las especias. Clasificación. No existe una clasificación única. Es posible utilizar una clasificación funcional de esofagitis aguda. Morfológicamente, se distinguen los tipos enumerados de esofagitis aguda: catarral, edematosa, erosiva, pseudomembranosa, hemorrágica, exfoliativa, necrótica, flemonosa. Por etiología: infecciosa, química, física, alimentaria. Por etapas endoscópicas: 1º - edema e hiperemia de la mucosa, 2º - aparición de erosiones únicas en la parte superior de los pliegues de la mucosa edematosa, 3º - edema significativo e hiperemia de la mucosa con focos de mucosas erosionadas y sangrantes, 4º - " llanto "- membrana mucosa difusamente erosionada, sangra al menor toque del endoscopio. Cuadro clínico. La esofagitis catarral es la forma más común de esofagitis aguda. Ocurre en el contexto de errores en la nutrición: al comer alimentos picantes, fríos y calientes, con lesiones leves, quemaduras por alcohol. Se manifiesta clínicamente por ardor y dolor detrás del esternón, lo que obliga a los pacientes a rechazar alimentos durante varios días. Esofagitis observada endoscópicamente grado I-II, radiografía - hipercinesia del esófago. La esofagitis erosiva ocurre con enfermedades infecciosas (finn, tifus, sepsis, procesos fúngicos) y alergias. También aparece con quemaduras químicas y lesiones del esófago. De hecho, esta forma de esofagitis es una fase de la evolución de la esofagitis catarral. El cuadro clínico principal consiste en los síntomas de la enfermedad subyacente. Los síntomas clínicos son similares a los de la esofagitis catarral: dolor importante en el pecho durante el paso de los alimentos; acidez estomacal, eructos, hipersalivación, olor pútrido de la boca (cacosmia). Determinar endoscópicamente signos de esofagitis grado II-III. El examen histológico reveló hiperemia, edema de la mucosa, hemorragia, erosión. Un examen de rayos X muestra abundante mucosidad en el esófago, una reestructuración del relieve con la formación de depósitos planos de bario de forma longitudinal de hasta 1 cm de largo e hipercinesia de las paredes del esófago. La esofagitis hemorrágica es una forma clínica rara de esofagitis erosiva. La etiología es la misma que en la esofagitis erosiva. El síndrome de dolor intenso y la hematemesis son clínicamente típicos. La endoscopia revela inflamación grado III-IV con predominio del componente hemorrágico. Hay un desprendimiento de la membrana mucosa sangrante en forma de tiras delgadas y estrechas. Esofagitis fibrinosa (pseudomembranosa). Los factores etiológicos son la escarlatina, la difteria, las enfermedades de la sangre, las enfermedades fúngicas y los efectos de la radioterapia. La clínica está dominada por disfagia y dolor intenso, agravado después de comer, náuseas, vómitos. Con el vómito, se liberan películas de fibrina, puede haber hemoptisis. Endoscópicamente, en las áreas afectadas de la mucosa, se encuentran placas fibrinosas de color gris y amarillo grisáceo, formadas por capas de fibrina y detritus que cubren la superficie de la mucosa. Con el rechazo de las pseudomembranas, se forman erosiones planas que cicatrizan lentamente, a veces úlceras sangrantes. Después de un proceso infeccioso severo, quedan estenosis membranosas en el esófago, que desaparecen después de repetidos bougienage. La esofagitis membranosa (exfoliativa) por etiología es química (quemaduras del esófago), infecciosa (las causas son sepsis, culebrilla, viruela, infección generalizada por herpes). La clínica de la enfermedad es variable, desde formas leves, diagnosticadas por endoscopia, hasta formas graves. En la clínica de esofagitis membranosa severa, prevalecen la intoxicación, la disfagia y el síndrome de dolor. Posible sangrado, perforación del esófago, mediastinitis, que, por regla general, terminan en la muerte. En el examen endoscópico, se observa daño en todas las capas del esófago, cuyo epitelio es rechazado por capas. Cuando la enfermedad subyacente cede, a veces quedan en el esófago estenosis membranosas o cicatriciales rugosas simétricas y asimétricas. La esofagitis necrotizante es una forma rara de inflamación aguda del esófago. Su desarrollo se ve facilitado por la inmunidad reducida en enfermedades tan graves como la sepsis, la fiebre tifoidea, la candidiasis, la insuficiencia renal terminal. La clínica se caracteriza por disfagia dolorosa, vómitos, debilidad general, sangrado, desarrollo frecuente de mediastinitis, pleuresía, neumonía. Después del tratamiento de la enfermedad de base, quedan estenosis en el esófago, diagnosticadas como cambios precancerosos facultativos. La esofagitis séptica es una rara inflamación local o difusa de las paredes del esófago de etiología estreptocócica o que se presenta cuando la mucosa es dañada por un cuerpo extraño, con quemaduras, úlceras, y puede pasar de órganos vecinos. A veces, la esofagitis flemonosa aguda ocurre como una complicación de cualquier forma de esofagitis aguda, lo que lleva a la fusión purulenta de las paredes del esófago. El colapso de las paredes se acompaña de un avance de pus en el tejido del mediastino, el desarrollo de mediastinitis, pleuresía, bronquitis purulenta, neumonía, espondilitis, ruptura de la aorta u otros grandes vasos. El acceso de una infección por anaerobios puede conducir a enfisema mediastínico o neumotórax espontáneo. El cuadro clínico se caracteriza por intoxicación severa, fiebre alta, dolor detrás del esternón y en el cuello, vómitos. En el examen, hay hinchazón en el cuello, la movilidad en esta parte de la columna es limitada. La posición de la cabeza es forzada, con una inclinación hacia un lado. La enfermedad a menudo se transforma en mediastinitis purulenta. En análisis de sangre: hiperleucocitosis, VSG acelerada. El examen instrumental (rayos X, endoscópico) en la etapa aguda no está indicado. Durante el período de cicatrización, es obligatorio un examen de rayos X debido al riesgo de desarrollar deformidades graves y estenosis cicatricial del esófago. tratamiento. Principios del tratamiento de la esofagitis aguda: etiotrópico, patogénico y sintomático. Tratamiento etiotrópico: tratamiento de la enfermedad subyacente. En enfermedades infecciosas complicadas con esofagitis aguda, se usan antibióticos (por vía parenteral). Con cambios necróticos y hemorrágicos pronunciados en el esófago, se recomienda abstenerse de comer durante 2-3 semanas. Durante este período está indicada la nutrición parenteral, la administración intravenosa de hidrolizados de proteínas, mezclas de aminoácidos, intralípidos, vitaminas, terapia de desintoxicación. Después de reducir la inflamación, se prescriben alimentos que ahorran calor y químicamente: leche tibia, crema, sopas de verduras, cereales líquidos. Para reducir los síntomas locales de inflamación: soluciones internas de tanino al 1%, collargol al 2%, novocaína al 1-2% antes de las comidas. Los astringentes se toman en posición horizontal con la cabecera de la cama baja. En ausencia del efecto de la administración local de preparaciones astringentes, los analgésicos no narcóticos se prescriben por vía parenteral. Para reducir los efectos de la discinesia esofágica, los medicamentos procinéticos (cerucal, raglán, cisaprida) se usan por vía oral antes de las comidas. Con erosiones múltiples, están indicadas las preparaciones de bismuto (denol, vikair), las inyecciones de solcoserilo. Con esofagitis hemorrágica, complicada con sangrado, se usan preparaciones de ácido aminocaproico, vikasol, dicinona. Con sangrado masivo, se prescribe una transfusión de sangre o plasma. Con esofagitis necrótica purulenta, el paciente debe recibir nutrición parenteral durante mucho tiempo, se usa una terapia masiva con varios antibióticos y se drena el absceso. Las estenosis esofágicas se corrigen mediante bougienage. En casos raros, se coloca una gastrostomía. Pronóstico. El pronóstico para la esofagitis catarral y erosiva es favorable. La desaparición espontánea de los síntomas de la esofagitis es posible siempre que la enfermedad subyacente se corrija adecuadamente. El pronóstico de la esofagitis pseudomembranosa, ecfoliativa y flemonosa es grave. En todos los casos, siempre que la enfermedad subyacente se recupere, la esofagitis termina con la formación de estenosis cicatriciales, que posteriormente requieren corrección. Los pacientes con formas graves de esofagitis complicada por estenosis esofágicas no pueden trabajar. La prevención de la esofagitis aguda consiste en el diagnóstico y tratamiento adecuado y oportuno de la enfermedad de base. 2. Esofagitis crónica La esofagitis crónica es una inflamación crónica de la membrana mucosa del esófago que dura hasta 6 meses. La variante más común es la esofagitis péptica (esofagitis por reflujo), que puede complicarse con una úlcera péptica del esófago. Etiología y patogénesis. La causa principal de la enfermedad es el reflujo constante del contenido gástrico hacia el esófago, a veces la bilis y el contenido intestinal, es decir, la esofagitis péptica es una quemadura aséptica del esófago por el ácido del estómago. En la patogenia de la esofagitis por reflujo, son importantes la regurgitación de contenidos ácidos y una violación de la purificación y el vaciado del esófago. La tasa de eliminación del esófago por irritación química se denomina eliminación esofágica. Con una eliminación normal, los yesos únicos de secreciones agresivas no causan esofagitis por reflujo. La comida caliente, el alcohol, el tabaco y otros factores exógenos reducen el aclaramiento del esófago. Estos factores incluyen la comida rápida, en la que se ingiere una cantidad significativa de aire junto con la comida. La calidad de los alimentos también importa: la carne grasosa, la manteca de cerdo, la pasta, los condimentos picantes ayudan a retrasar la evacuación de los alimentos del estómago, seguida del reflujo del contenido hacia el esófago. Los medicamentos reducen significativamente el tono del esfínter esofágico inferior y promueven el reflujo: antagonistas del calcio, nitratos, analgésicos narcóticos, medicamentos anticolinérgicos, teofilina y sus análogos, medicamentos del grupo de las prostaglandinas. Hay cinco criterios para la patogenicidad del reflujo en la génesis de la esofagitis péptica: frecuencia, volumen, regurgitación, composición química, condición de la mucosa esofágica y sensibilidad a un factor químico (la inflamación de las paredes reduce la sensibilidad), tasa de vaciamiento (aclaramiento) , que depende principalmente del peristaltismo activo, acción alcalinizante de la saliva y las mucosidades. La aparición de esofagitis por reflujo es promovida por la hernia de la abertura esofágica del diafragma, la úlcera duodenal, los trastornos posteriores a la gastrorresección y las alergias. La predisposición alérgica también importa. El examen morfológico de pacientes con esofagitis péptica revela edema, hiperemia de la mucosa, infiltración de la submucosa del segmento supradiafragmático del esófago. Hay dos opciones para la propagación de la inflamación crónica: esofagitis por reflujo total y local. Con la participación en el proceso de más de 2/3 de la mucosa esofágica, es posible el desarrollo de traqueítis por reflujo, bronquitis por reflujo. En la parte superior de los pliegues esofágicos, se producen erosiones, pequeñas úlceras (en lugares de máxima irrigación con contenido gástrico). La inflamación crónica del esófago provoca contractura espástica y acortamiento del órgano. Cuadro clínico. Los signos típicos de la esofagitis por reflujo incluyen sensación de ardor detrás del esternón, acidez de estómago, regurgitación, que empeora al acostarse, disfagia y el efecto positivo de tomar antiácidos. Puede aparecer dolor en el pecho después de comer, que recuerda a la angina de pecho. La aparición de dolor en la esofagitis por reflujo se asocia con la irritación péptica de la pared esofágica y sus espasmos durante la regurgitación del contenido gástrico ácido, así como con la violación de la mucosa prolapsada. Características distintivas de este dolor: su carácter prolongado y ardiente, localización en el proceso xifoides, irradiación a lo largo del esófago, con menos frecuencia a la mitad izquierda del tórax, ningún efecto notable al tomar antiácidos, antiespasmódicos, aumentado en una posición horizontal, especialmente después comiendo. Se debe prestar especial atención en el diagnóstico clínico a los síntomas menores de disfagia, como la sensación de un bulto detrás del esternón, la sensación de que la comida caliente pasa por el esófago. Un signo de esofagitis que comienza gradualmente puede ser la salivación y el hábito de beber agua con la comida. El examen físico de los pacientes con esofagitis por reflujo no proporciona información significativa desde el punto de vista diagnóstico. Las complicaciones de la esofagitis por reflujo incluyen sangrado, ulceración, estenosis, acortamiento del esófago y malignidad. La esofagitis por reflujo crónico puede conducir al desarrollo de una hernia de hiato axial. Diagnóstico y diagnóstico diferencial. El método de investigación más valioso para esta patología es la endoscopia, durante la cual se observan hiperemia, edema y engrosamiento de los pliegues de la membrana mucosa. Es confiable una capa blanquecina que cubre la membrana mucosa, que en las etapas iniciales de la enfermedad puede ser delgada, apenas perceptible, pero con un proceso largo: blanco masivo o gris sucio. En algunas zonas, sobre un fondo de placa blanca, a menudo se ve la mucosa del esófago de color rojo brillante. En algunos casos se detectan defectos erosivos y ulcerativos en forma de rayas. Los cambios en la mucosa pueden corresponder a cualquiera de las cuatro etapas de la esofagitis: desde la hiperemia hasta el "llanto" de la mucosa. En la esofagitis grave, se acumula mucha saliva y moco en la luz. La pHmetría, a diferencia de la endoscopia, permite evaluar de forma más objetiva el aclaramiento esofágico. Las radiografías revelan reflujo gastroesofágico. Es necesario diferenciar la esofagitis por reflujo con la úlcera péptica del estómago y el duodeno, la enfermedad coronaria, la colecistitis crónica y la pancreatitis. El síntoma principal en el diagnóstico diferencial es el dolor. La diferenciación con la úlcera péptica se ve favorecida por la ausencia de dolores tardíos y "hambrientos" en la esofagitis, así como por los datos obtenidos de la endoscopia del esófago y el estómago. El dolor coronario, a diferencia de la esofagitis, se caracteriza por una conexión con el estrés físico y emocional, el efecto de los nitratos, signos de isquemia en el ECG, incluidos los de la bicicleta ergométrica. Los datos de ultrasonido de los órganos abdominales ayudan a excluir la patología de la vesícula biliar y el páncreas como causa del síndrome de dolor. tratamiento. La terapia para la esofagitis por reflujo incluye el tratamiento de las enfermedades que la causaron y la prescripción de terapia antirreflujo. Se aconseja a los pacientes que eviten levantar pesas, agacharse. Es necesario tomar la posición correcta durante el descanso y el sueño (la cabecera se eleva 15-20 cm, en un ángulo de 30-50 °). Se recomienda normalizar el peso corporal, comer fraccionadamente (la última comida, 3 horas antes de acostarse). El alcohol y los alimentos picantes están excluidos de la dieta. Asigne adsorbentes y medicamentos alcalinizantes que tengan un efecto protector sobre la membrana mucosa. Estas sustancias incluyen Venter, que se administra por vía oral a una dosis de 1 g (preferiblemente en forma de suspensión) 30-40 minutos antes de las comidas 3 veces al día y la cuarta vez con el estómago vacío antes de acostarse. El curso del tratamiento es de 4-8 semanas. Almagel, phosphalugel, maalox, gastal tienen un efecto similar. Estos fármacos se utilizan en el período interdigestivo (10/1-2 horas después de las comidas y por la noche) hasta que se produce la remisión completa. Phosphalugel y Maalox se prescriben 2-1 paquetes 2-2 veces al día, gastal - 3-2 tabletas al día. No se recomienda el uso de refrescos de té, una mezcla de Bourget, arcilla blanca debido a una eficiencia insuficiente. Acción envolvente y astringente tiene nitrato de bismuto 3 g 1-3 veces al día. Se observó una alta actividad antirreflujo de un nuevo antiácido, topalkan. Las aguas minerales: "Borjomi", "Essentuki No. 4", "Jermuk", "Smirnovskaya" tienen un efecto alcalinizante. Para reducir la secreción gástrica ácida, se recetan bloqueadores H.2receptores de histamina (cimetidina, ranitidina, famotidina), inhibidores de Ka-K-ATPasa (omeprazol), un bloqueador selectivo de los receptores M-colinérgicos de las células parietales, su análogo buscopan. La cimetidina se prescribe 400 mg 2 veces al día, ranitidina - 300 mg y famotidina - 40 mg una vez por la noche después de la cena. El omeprazol se recomienda para las formas resistentes de esofagitis por reflujo erosiva y ulcerosa. Se prescribe a 30-40 mg por día durante 3-4 semanas. Para normalizar los trastornos de evacuación motora en la enfermedad por reflujo, se prescriben metoclopramida (cerucal, raglan, perinorm, biomral), prepulsid (sizepride, motilium, domperidone, coordinax). La metoclopramida y sus análogos de segunda generación aumentan el tono del esfínter esofágico inferior, reducen la presión intragástrica y aceleran la evacuación del estómago. Asigne metoclopramida 2 tableta 1-3 veces al día antes de las comidas o 4 ml por vía intramuscular 2 veces al día. El fármaco suele ser bien tolerado. Al usarlo, es posible que se seque la boca, la somnolencia y el tinnitus, que disminuyen después de comer. Sizepride es un nuevo agente procinético gastrointestinal. Aumenta el tono del esfínter esofágico inferior, mejora el aclaramiento esofágico, potencia la función motora de evacuación del tubo digestivo y suprime los reflujos patológicos (gastroesofágico y duodenogástrico). El medicamento, a diferencia de la metoclopramida, no bloquea los receptores de donamina, no es un estimulante directo de los receptores anticolinérgicos y carece de efectos secundarios inherentes a cerucal y sus análogos. Se prescribe por vía oral a 5 o 10 mg 2-3 veces al día. El curso del tratamiento dura de 2-3 semanas a 2-3 meses. La cesaprida con esofagitis por reflujo se puede utilizar como monoterapia. Pronóstico y prevención. El pronóstico de vida y laboral es favorable. En casos complicados, el pronóstico está determinado por la puntualidad y la calidad de la atención médica. A los pacientes con enfermedad grave se les asigna un grupo de discapacidad. Los pacientes con esofagitis crónica por reflujo deben estar bajo la supervisión de un gastroenterólogo. Los estudios endoscópicos y morfológicos están indicados al menos 2 veces al año por posibilidad de malignidad. 3. Úlcera péptica del esófago La úlcera péptica del esófago es una enfermedad aguda o crónica caracterizada por la ulceración de la mucosa del segmento distal del esófago bajo la influencia del jugo gástrico activo. Etiología y patogénesis. Las úlceras pépticas crónicas del esófago son complicaciones de la esofagitis por reflujo y la hernia de hiato. Su aparición se ve facilitada por un esófago interno corto, metaplasia focal de la mucosa, heterotopía de la mucosa gástrica hacia el esófago, enfermedad por reflujo con insuficiencia cardiaca, enfermedades acompañadas de vómitos frecuentes (síndrome posvagotomía, síndrome del asa aferente, alcoholismo crónico). Las úlceras agudas del esófago son posibles con sequedad patológica de la mucosa esofágica (xerosis), alergias a medicamentos, uso de AINE, infecciones fúngicas, infecciones virales, quemaduras en la piel y enfermedades del sistema nervioso central. Estas úlceras se consideran sintomáticas. Cuadro clínico. Algunos pacientes tienen una lesión ulcerosa combinada de la membrana mucosa del esófago y la zona gastroduodenal. Los síntomas de una úlcera péptica del esófago se asemejan al cuadro clínico de la esofagitis péptica: se produce acidez estomacal persistente, empeoramiento después de comer, al doblar el cuerpo, en posición acostada, regurgitación, dolor al tragar y alteración del paso de alimentos sólidos. Complicaciones típicas de las úlceras esofágicas: perforación, sangrado, penetración, estenosis. El sangrado se manifiesta por hematemesis, melena, anemia hipocrómica y disminución de la actividad cardíaca. La perforación del esófago se diagnostica en muy raras ocasiones. Los síntomas clínicos de perforación son indistinguibles de los síntomas de lesión mecánica aguda penetrante y no penetrante por cuerpos extraños. Aproximadamente el 14% de las úlceras esofágicas penetran en los tejidos circundantes. Diagnóstico y diagnóstico diferencial. Es extremadamente difícil sospechar una úlcera péptica basándose en los síntomas clínicos. El diagnóstico se verifica durante estudios instrumentales y de laboratorio. El más informativo es el examen de rayos X y endoscópico. Radiológicamente, la úlcera aparece como un nicho en el esófago supracardíaco con ligero edema perifocal de la mucosa. El esófago en el área de la úlcera se contrae espasmódicamente y encima se detecta una ligera expansión supraestenótica. La úlcera se acompaña de signos de hipercinesia y esofagitis por reflujo, y los síntomas de hernia de hiato son muy comunes. A veces, la úlcera se asemeja a un pequeño divertículo epifrénico, pero este último no tiene un curso clínico típico y no se combina con insuficiencia cardíaca, hernia o esofagitis. Es más difícil distinguir una úlcera péptica del esófago del cáncer endofítico ulcerado, que se acompaña de rigidez de las paredes y relieve de la membrana mucosa, y un eje asimétrico, por signos radiológicos. La información más confiable en la verificación de la úlcera péptica del esófago la proporciona la endoscopia y la biopsia múltiple de los bordes de la úlcera. Al avanzar el endoscopio hasta la úlcera péptica, se revelan signos de esofagitis en estadio I-IV, disfunción motora del esófago, edema perifocal e hiperemia de la membrana mucosa. Una úlcera aguda suele ser redonda u ovalada, con bordes pronunciados, cubierta con una capa blanquecina o verde. Una úlcera crónica tiene un fondo plano con paredes densas y desiguales, bordes suaves, depósitos fibrinosos purulentos, focos de granulaciones y superposiciones cicatriciales. Para excluir malignidad, se toman de 4 a 6 biopsias de los bordes de la úlcera. El examen endoscópico revela defectos pépticos únicos, alargados a lo largo del eje del esófago. Su longitud varía entre 1 y 10 cm, pero con mayor frecuencia no supera 1 cm La úlcera suele ser poco profunda, su parte inferior está cubierta con una capa blanquecina. La hiperemia, el edema de la mucosa y las erosiones únicas a menudo reflejan una reacción inflamatoria perifocal moderada. Después de la cicatrización de una úlcera péptica, en el esófago queda una cicatriz rugosa lineal o estrellada o una deformidad de la pared parecida a un divertículo rugoso y un estrechamiento de la luz. Es necesario diferenciar las úlceras pépticas del esófago con ulceraciones de naturaleza específica (con tuberculosis, sífilis). En estas situaciones, las pruebas serológicas específicas, los resultados de los estudios histológicos y bacteriológicos ayudan significativamente. La combinación de la patología del esófago con daño a los pulmones y otros órganos hace que sea necesario examinar deliberadamente al paciente en relación con un proceso específico. tratamiento. El tratamiento incluye una dieta: se recomiendan alimentos mecánica y químicamente suaves, que se toman en pequeñas porciones de 5 a 6 veces al día. Para evitar el reflujo del contenido del estómago al esófago, la posición del paciente en la cama debe ser con la cabecera elevada. Los medicamentos se toman acostados. La monoterapia se prescribe con un medicamento de uno de los siguientes grupos farmacológicos: antisecretores, incluidos antiácidos y adsorbentes, estimulantes de la función de evacuación motora del estómago (procinéticos), medicamentos, simuladores de moco. La terapia se lleva a cabo durante mucho tiempo: 1,5 a 3 meses. Indicaciones para el tratamiento quirúrgico: falta de curación dentro de los 6 a 9 meses, curso complicado (perforación, penetración, estenosis, sangrado). Pronóstico y prevención. El curso de la enfermedad es recurrente. El pronóstico de vida y laboral es favorable. Se recomienda un examen periódico (1-2 veces al año) de forma ambulatoria por parte de un gastroenterólogo mediante endoscopia y biopsia. Se lleva a cabo la prevención estacional (primavera - otoño) de la esofagitis por reflujo. CONFERENCIA N° 10. Enfermedades del tubo digestivo. Enfermedades del estómago. Gastritis crónica La gastritis crónica es una enfermedad que se caracteriza clínicamente por dispepsia gástrica y, morfológicamente, por cambios inflamatorios y degenerativos en la mucosa gástrica, alteración de los procesos de renovación celular y aumento del número de células plasmáticas y linfocitos en la propia membrana mucosa. Etiología y patogénesis. En la etapa actual de desarrollo de la gastroenterología, se ha establecido que la aparición de gastritis crónica se ve facilitada por la expansión microbiana de Helicobacter pylori (HP), que provoca gastritis antral en el 95% de los casos y pangastritis en el 56% de los casos. A su vez, los denominados factores etiológicos para la aparición de gastritis crónica pueden atribuirse con un alto grado de certeza a factores de riesgo (dieta irregular desequilibrada, tabaquismo, consumo de alcohol, hipersecreción de ácido clorhídrico y pepsina). El papel principal en el desarrollo de la enfermedad también pertenece a los mecanismos autoinmunes, acompañados por la acumulación de anticuerpos contra las células parietales de la mucosa gástrica, la herencia agravada, así como el uso de medicamentos que tienen un efecto dañino sobre la mucosa gástrica. Clasificación. En 1990, en el IX Congreso Internacional de Gastroenterólogos celebrado en Australia, se adoptó una nueva sistematización de la gastritis crónica, denominada sistema de Sydney. Bases histológicas de clasificación. 1) Etiología: gastritis crónica asociada a HP, autoinmune, idiopática, gastritis aguda inducida por fármacos. 2) Topografía: antral, fúndica, pangastritis. 3) Morfología: formas agudas, crónicas, especiales. Base endoscópica de clasificación: 1) gastritis del antro del estómago; 2) gastritis del cuerpo del estómago; 3) pangastritis; 4) cambios en la mucosa gástrica: edema, eritema, vulnerabilidad mucosa, exudado, erosiones planas, erosiones elevadas, hiperplasia de pliegues, atrofia de pliegues, visibilidad del patrón vascular, hemorragias supramucosas. Cuadro clínico. La gastritis crónica es una de las enfermedades más frecuentes en la clínica de medicina interna. Su frecuencia entre los habitantes del mundo oscila entre el 28 y el 75%. La gastritis crónica se manifiesta con mayor frecuencia por síntomas de dispepsia gástrica y dolor en la región epigástrica. En raras ocasiones, es asintomático. El dolor generalmente se localiza en la región epigástrica. Existe una clara conexión entre su aparición con la ingesta de alimentos y la localización del proceso inflamatorio en el estómago. En pacientes con gastritis de las secciones subcardiaca y cardiaca del estómago, el dolor en la región epigástrica ocurre de 10 a 15 minutos después de una comida, con patología del cuerpo del estómago: 40 a 50 minutos después de una comida. Los dolores "tardíos", "hambrientos" son típicos de la gastritis de la sección de salida del estómago o duodenitis. El dolor de "dos ondas", después de comer y con el estómago vacío, se observa con gastritis del subcardiaco y el antro. Con un proceso difuso, el dolor se localiza en la región epigástrica, ocurre después de comer y es de carácter apremiante. Dicen sobre el curso asintomático de la gastritis cuando no es posible establecer la relación entre el dolor en la región epigástrica y la lesión, que ocurre cuando es de origen endógeno (la gastritis se vuelve secundaria a la patología de otros órganos y sistemas). Un lugar igualmente importante en el cuadro clínico de la gastritis crónica es el síndrome dispéptico: náuseas, eructos (agrios, amargos, podridos), acidez estomacal, estreñimiento o diarrea, heces inestables. Con gastritis antral aislada, las quejas de acidez estomacal y estreñimiento, que surgen de la hipersecreción de ácido clorhídrico y pepsina, se vuelven primordiales. Con pangastritis con signos de atrofia severa, predominan las náuseas, los eructos "podridos", las heces inestables o la diarrea, que es típica de la hiposecreción de ácido clorhídrico y pepsina. La náusea persistente es característica de la gastritis secundaria en la pancreatitis crónica, la colecistitis crónica, que ocurre con la discinesia hipomotora de la vesícula biliar. diagnósticos. La gastritis crónica dura mucho tiempo y los síntomas aumentan con el tiempo. Las exacerbaciones son provocadas por trastornos nutricionales. El cuadro físico de la gastritis crónica es bastante pobre. En el 80-90% de los pacientes durante una exacerbación de la enfermedad, un estudio objetivo determina solo dolor local en la región epigástrica. Cuando la gastritis crónica se combina con duodenitis, colecistitis o pancreatitis, se puede determinar la localización del dolor que no es típico de la gastritis, pero que es característico de la patología de otro órgano. Análisis generales de sangre y orina, los parámetros bioquímicos de la sangre en pacientes con gastritis crónica no difieren de los parámetros correspondientes en individuos sanos. En un estudio escatológico, no hay cambios en los análisis, o puede haber signos de un trastorno digestivo. Cuando se estudian los contenidos gástricos de secreción ácida por pH-metría, se observan tanto signos de hipersecreción ácida como una disminución en la producción de ácido. Los indicadores de formación de pepsina en la gastritis crónica son más persistentes y disminuyen en el contexto de la anacidez persistente en el daño orgánico difuso. Es más probable que un examen de rayos X excluya otras enfermedades del estómago (úlcera, cáncer), ayude en el diagnóstico de la enfermedad de Menetrier que confirme el diagnóstico de gastritis crónica. Debido a la escasez de manifestaciones clínicas de la enfermedad, así como a la inespecificidad de las pruebas de laboratorio, el diagnóstico de gastritis crónica se basa en los resultados de los estudios endoscópicos y morfológicos. La endoscopia revela cambios en la mucosa gástrica de gravedad variable: edema, eritema, vulnerabilidad de la mucosa, exudado, erosiones planas, erosiones sobreelevadas, hiperplasia o atrofia de los pliegues, visibilidad del patrón vascular, hemorragias submucosas. Se habla de gastritis crónica con aumento del número de células plasmáticas y linfocitos en la propia membrana de la mucosa (a diferencia de la gastritis aguda, cuando aparecen leucocitos polimorfonucleares). En relación con lo anterior, la identificación morfológica de la inflamación en la gastritis puede no coincidir con la interpretación de los datos del clínico. La actividad de los cambios inflamatorios en la mucosa gástrica se evalúa morfológica y morfométricamente según el grado de infiltración leucocitaria de la lámina propia o epitelio. No debemos perder de vista que la gastritis autoinmune no está activa. Se cuantifican los cambios morfológicos (débil, moderado y severo) -inflamación, actividad, atrofia, metaplasia- y el grado de contaminación por HP. Las manifestaciones clínicas características de la gastritis también se observan en otras enfermedades del sistema digestivo, por lo tanto, en el proceso de diagnóstico, se necesita una ecografía de la cavidad abdominal, un examen endoscópico y morfológico completo de los órganos digestivos. Diagnóstico diferencial. El más difícil es el diagnóstico diferencial de gastritis con enfermedades funcionales del estómago, úlcera péptica del estómago y duodeno, colecistitis crónica y pancreatitis y cáncer de estómago. Las enfermedades funcionales del estómago, similares a la gastritis crónica, pueden presentarse de forma latente o estar acompañadas de dolor y síntomas dispépticos. Se caracterizan por una corta duración, la presencia de síntomas neuróticos generales que prevalecen en el cuadro clínico de la enfermedad (como debilidad, fatiga, irritabilidad, dolor de cabeza, inestabilidad del estado de ánimo, sudoración). Con trastornos de la función del estómago, el dolor no depende de la calidad de los alimentos, o se produce después del uso de un producto estrictamente definido. A menudo hay un síndrome de acidez (ardor de estómago, eructos agrios, sabor agrio en la boca), que, a diferencia de la gastritis con aumento de la función secretora, no aumenta después de comer, sino con excitación, largas pausas para comer. Los vómitos en patologías funcionales del estómago se desarrollan de acuerdo con el mecanismo de un reflejo condicionado, brindan alivio al paciente y no conducen a un deterioro significativo en el estado general. En la gastritis crónica, generalmente ocurre durante una exacerbación y no brinda alivio al paciente. Un síntoma frecuente de disfunción del estómago es un fuerte eructo de aire. En la gastritis crónica, se asocia con alteración de la digestión de los alimentos o de la motilidad gástrica y puede ser ácida si se conserva la secreción, o con olor a huevos podridos si se reduce. En el estudio de la secreción gástrica en la gastritis, se detectan valores normales de secreción al inicio de la enfermedad y, en el futuro, una tendencia a la disminución de la secreción de jugo gástrico. Con enfermedades funcionales del estómago, a menudo se observa heterochilia. El examen de rayos X del estómago permite confirmar formas de gastritis como rígida, angraal, hiperplásica gigante, poliposis y, en caso de violaciones de la función de evacuación motora del estómago (gastroptosis, hipotensión), indica la naturaleza funcional de la enfermedad. El método de investigación más valioso para el diagnóstico diferencial de la gastritis crónica y las enfermedades funcionales del estómago es la gastroscopia, que permite, en casos controvertidos, conocer cambios en la mucosa gástrica característicos de gastritis o enfermedades funcionales del estómago. El diagnóstico diferencial de gastritis crónica con úlcera péptica se describe en la siguiente lección. El cáncer gástrico tiene un cuadro muy similar al de la gastritis con función secretora reducida. El diagnóstico precoz del cáncer gástrico sobre la base de los signos clínicos es difícil, especialmente en pacientes que padecen gastritis durante mucho tiempo. De gran importancia para el diagnóstico de cáncer son la aparición de dolor persistente persistente, poco dependiente de la ingesta de alimentos, debilidad y fatiga general inmotivada, perversión del apetito, así como una disminución progresiva del peso corporal del paciente. La detección de un tumor a la palpación se refiere a las últimas etapas del proceso del cáncer. Síntomas tales como un cambio en el bienestar del paciente, una rápida disminución de la acidez del jugo gástrico, una "deficiencia" de ácido clorhídrico, la aparición de células atípicas en el jugo gástrico, una reacción positiva a la sangre oculta en las heces deben hacer que el médico sospeche cáncer gástrico. De importancia decisiva en el diagnóstico diferencial son los estudios de rayos X y gastroscópicos con biopsia dirigida de la mucosa gástrica. En pacientes con gastritis crónica con función secretora reducida, el examen de rayos X revela atrofia de su membrana mucosa, que también se confirma por gastroscopia. Con una biopsia dirigida en tales casos, se revelan cambios estructurales y atrofia de la membrana mucosa. Para el cáncer gástrico, el examen de rayos X se caracteriza por la presencia de un defecto de llenado, la ausencia de pliegues mucosos o un cambio en su naturaleza y la ausencia de peristalsis en ciertas áreas. La endoscopia del estómago permite detectar un tumor en la etapa más temprana de su desarrollo, cuando el tumor aún se encuentra dentro de la mucosa gástrica, y el tratamiento quirúrgico conduce a la recuperación en más del 90% de los casos. Colecistitis crónica. En la colecistitis crónica, el dolor se localiza en el hipocondrio derecho y tiene un carácter sordo. En la colecistitis calculosa, el dolor es agudo, cólico y se irradia a la región subescapular derecha. La aparición del dolor se asocia con el consumo de alimentos grasos o con sacudidas al conducir. En la gastritis crónica, el dolor en el epigastrio es difuso, sordo, no hay irradiación, ocurre inmediatamente después de comer alimentos secos o en violación de la dieta. Con gastritis y colecistitis, el dolor se acompaña de síntomas dispépticos, pero una sensación de pesadez en el epigastrio, plenitud, eructos de comida o aire, un sabor metálico en la boca son más característicos de la gastritis. Los vómitos en la gastritis crónica son raros. Objetivamente, en la colecistitis crónica, especialmente calcárea, se encuentra tensión en la pared abdominal anterior, hiperestesia de la piel en el hipocondrio derecho, que no es característica de la gastritis crónica. A la palpación del abdomen en el caso de colecistitis crónica, se observa dolor en la localización de la vesícula biliar. La gastritis crónica se caracteriza por dolor difuso. En pacientes con colecistitis crónica, el examen de bilis revela un aumento en la cantidad de moco y leucocitos. La gastritis crónica se caracteriza por una imagen normal de la bilis en el contexto de cambios en la secreción y acidez del jugo gástrico, así como otras funciones del estómago (absorción, motor). Un examen de rayos X de la vesícula biliar en pacientes con colecistitis crónica revela un cambio en su función de evacuación, así como cálculos. La pancreatitis crónica. En la pancreatitis crónica, el dolor se localiza en la mitad izquierda del abdomen y se irradia a la región subescapular izquierda, a la zona lumbar y al área circundante. La aparición de dolor se asocia con el consumo de alimentos abundantes, a menudo grasos, y de alcohol. Si la gastritis crónica se caracteriza por un curso largo y monótono de la enfermedad, en la pancreatitis crónica es gradual. Un examen objetivo en el caso de pancreatitis crónica revela hiperestesia de la piel en el hipocondrio izquierdo, el dolor corresponde topográficamente a la ubicación del páncreas. En un estudio de laboratorio del jugo pancreático en la pancreatitis crónica, se encuentra un cambio persistente en la alcalinidad y las enzimas: el nivel de diastasa en la sangre y la orina puede cambiar, lo que no ocurre con la gastritis crónica. Radiológicamente, la pancreatitis crónica se caracteriza por un aumento de la inversión del anillo duodenal, un fuerte aumento de su papila mayor (síntoma de Frostberg) y, en ocasiones, la presencia de áreas de calcificación del páncreas. También se deben realizar diagnósticos intranosológicos de diversas formas de gastritis crónica. Así, la enfermedad asociada a HP cursa clínicamente con síntomas de úlceras duodenales, y en algunos casos puede cursar de forma latente. El examen endoscópico y morfológico revela antropilorroduodenitis. Las erosiones en la gastritis por Helicobacter pylori generalmente se localizan en el área de inflamación severa (zona antropopilórica del estómago). La gastritis crónica autoinmune se caracteriza clínicamente por una sensación de pesadez en la región epigástrica, un regusto desagradable en la boca, eructos podridos y náuseas. Debido a la producción insuficiente de ácido clorhídrico, aparece diarrea. En el 10% de los casos, en el contexto de la gastritis autoinmune, se encuentran síntomas B12- anemia carencial: debilidad, palidez de la piel y mucosas, uñas quebradizas, en análisis de sangre - anemia hipercrómica megaloblástica. Las formas especiales de la enfermedad incluyen gastritis granulomatosa, eosinofílica, hipertrófica (enfermedad de Menetrier), linfocítica. La gastritis granulomatosa actúa como una forma independiente de la enfermedad o, más a menudo, como uno de los componentes de una patología más grave (enfermedad de Crohn, tuberculosis, sarcoidosis). El diagnóstico siempre se confirma con los resultados del examen histológico de muestras de biopsia de la mucosa gástrica. La gastritis eosinofílica es extremadamente rara y está causada por una vasculitis sistémica. Un historial de reacciones alérgicas es obligatorio. El examen histológico revela infiltración eosinofílica de la mucosa gástrica. La gastritis hipertrófica (enfermedad de Menetrier) se manifiesta clínicamente por dolor en la región epigástrica y náuseas. Algunos pacientes pueden experimentar pérdida de peso debido a la diarrea. En los estudios endoscópicos, radiológicos y morfológicos se encuentran pliegues mucosos hipertrofiados gigantes que se asemejan a las circunvoluciones del cerebro. La gastritis linfocítica es clínicamente asintomática; morfológicamente, esta forma se caracteriza por una infiltración pronunciada de la mucosa gástrica por linfocitos. tratamiento. Los pacientes con gastritis necesitan medidas médicas generales: nutrición equilibrada regular, normalización de los horarios de trabajo y descanso, nivelación de situaciones estresantes en la vida cotidiana y el trabajo. La terapia con medicamentos está indicada solo en presencia de manifestaciones clínicas de gastritis crónica. Los pacientes con gastritis asociada con HP son tratados con un programa de úlcera péptica (ver la siguiente lección). Las personas con gastritis autoinmune necesitan suplementos de vitamina B12 (500 mcg una vez al día por vía subcutánea durante 1 días, seguido de una repetición de ciclos de tratamiento), ácido fólico (30 mg por día), ácido ascórbico (hasta 5 g por día). Si es necesario, la terapia de sustitución se lleva a cabo con preparaciones enzimáticas (mezim-forte, festal, enzistal, creon, pancitrate, acidin-pepsin). El síndrome de dolor generalmente se detiene con el nombramiento de antiácidos (maalox, almagel, gastal) o bloqueadores de los receptores de histamina H (ranitidina, famotidina) en dosis terapéuticas medias. Con formas especiales de gastritis, es necesario el tratamiento de la enfermedad subyacente. Pronóstico y prevención. El pronóstico de vida y laboral es favorable. Los pacientes con gastritis crónica deben registrarse con un gastroenterólogo. Se examinan clínica y endoscópicamente con una biopsia al menos una vez al año para excluir la transformación del tumor. Las más peligrosas en términos de degeneración cancerosa son la gastritis atrófica hipertrófica y difusa con displasia epitelial. En las formas erosivas de la enfermedad complicada con sangrado, así como en la forma descompensada de la enfermedad de Menetrier, el pronóstico está determinado por la oportunidad y la idoneidad del tratamiento quirúrgico. La prevención de la gastritis se reduce a una nutrición racional, el cumplimiento del régimen de trabajo y descanso, limitando la ingesta de AINE. CONFERENCIA N° 11. Enfermedades del aparato digestivo. Enfermedades del estómago. úlcera péptica La úlcera péptica (úlcera péptica) es una enfermedad crónica recurrente, clínicamente manifestada por una patología funcional de la zona gastroduodenal y morfológicamente, por una violación de la integridad de sus capas mucosas y submucosas, y por lo tanto, la úlcera siempre se cura con la formación de una cicatriz. Etiología. El principal factor etiológico de la úlcera péptica es la expansión microbiana de HP en la superficie del epitelio gástrico. La importancia de la agresión bacteriana en la etiología de la enfermedad se estudia desde 1983, cuando J. Warren y B. Marshall informaron del descubrimiento de un gran número de bacterias S-spiral en la superficie del epitelio del antro del estómago. Las helicobacterias pueden existir en un ambiente ácido debido a la producción de la enzima ureasa, que convierte la urea (del torrente sanguíneo) en amoníaco y dióxido de carbono. Los productos de la hidrólisis enzimática neutralizan el ácido clorhídrico y crean condiciones para cambiar el pH del ambiente alrededor de cada célula bacteriana, proporcionando así condiciones favorables para la actividad vital de los microorganismos. La colonización total de HP se produce en la superficie de las células epiteliales gástricas, que se acompaña de daños en el epitelio bajo la acción de las fosfolipasas. Estos últimos proporcionan la formación de lecitinas y proteinasas tóxicas a partir de la bilis, lo que provoca la destrucción de los complejos proteicos protectores y la mucosidad. En el contexto de la "alcalinización" de las membranas de las células epiteliales con amoníaco, el potencial de membrana de las células cambia, aumenta la difusión inversa de iones de hidrógeno, la muerte y la descamación del epitelio de la mucosa gástrica. Todos estos cambios conducen a la penetración de HP en la profundidad de la mucosa gástrica. No menos importantes en el desarrollo de las úlceras pépticas son los efectos neuropsíquicos, la predisposición hereditaria, los agentes infecciosos, los errores alimentarios y la ingesta de determinados medicamentos, y los malos hábitos. Por primera vez, el concepto neurogénico del inicio de la enfermedad fue formulado por Bergman, quien argumentó que los trastornos hereditarios-constitucionales del sistema nervioso autónomo conducen a espasmos de los músculos y vasos sanguíneos en la pared del estómago, isquemia y disminución. en la resistencia de la membrana mucosa a los efectos agresivos del jugo gástrico. Esta teoría fue desarrollada por K. N. Bykov e I. T. Kurtsin (1952). Justificaron la teoría corticovisceral de la ulcerogénesis, que se basa en datos sobre cambios en la actividad nerviosa superior como resultado de traumatización neuropsíquica crónica. Complementada y detallada por la doctrina de los vínculos bioquímicos y hormonales en la regulación de la secreción, la motilidad y el trofismo gástricos, esta teoría de la ulcerogénesis ha vuelto a ganar muchos adeptos en los últimos años. Los factores hereditarios son populares entre los investigadores: la inercia de los principales procesos nerviosos, las propiedades específicas de grupo de la sangre, las características inmunológicas y bioquímicas, el síndrome de carga hereditaria. En la aparición de la úlcera péptica, los trastornos nutricionales fueron de gran importancia. Sin embargo, los estudios clínicos y experimentales realizados en las últimas dos décadas en la mayoría de los casos no revelaron el efecto dañino de los productos alimenticios sobre la mucosa gastroduodenal. La prevalencia de la enfermedad de úlcera péptica entre contingentes significativos de personas con diferentes hábitos dietéticos también atestigua la importancia principal de los factores nutricionales. Las alteraciones en el ritmo y la regularidad de la nutrición, los descansos prolongados entre comidas y las comidas inoportunas son esenciales para la aparición de úlceras pépticas. Los investigadores han expresado puntos de vista relativamente contradictorios sobre el papel del alcohol en la ulcerogénesis. Se sabe que el alcohol causa cambios atróficos en la mucosa gástrica. Estas observaciones están en conflicto con el concepto general de formación de úlceras. Sin embargo, el uso frecuente de alcohol se acompaña de violaciones de la dieta, cambios cualitativos en la composición de los alimentos, que en última instancia pueden causar úlcera péptica del estómago y el duodeno. El papel de los efectos medicinales en la ulcerogénesis se está estudiando activamente. Los resultados de los estudios publicados en la literatura y nuestros propios datos indican que los fármacos antiinflamatorios no esteroideos y las hormonas glucocorticoides tienen las propiedades ulcerogénicas más pronunciadas. Patogenesia. La patogénesis de la úlcera péptica aún no se comprende completamente. Al considerar los procesos de ulcerogénesis, es necesario destacar una serie de postulados: 1) caracterizado por la estacionalidad de las exacerbaciones de la úlcera péptica; 2) existe una localización predominante de las úlceras pépticas en la zona antropiloroduodenal; 3) se notó la presencia de ácido clorhídrico y pepsina en el jugo gástrico; 4) se nota una alta frecuencia (hasta 70%) de curación espontánea de úlceras gástricas y duodenales; 5) existe gastritis antral crónica asociada a HP; 6) la parte antropilórica del estómago y la parte inicial del duodeno son el "hipotálamo" del tracto gastrointestinal; 7) existe una predisposición hereditaria a la aparición de úlceras pépticas; 8) la aparición de una úlcera, su recurrencia y remisión son posibles en presencia de todos los factores anteriores. Por lo tanto, el concepto unificado de ulcerogénesis es el siguiente. En un paciente con predisposición hereditaria a la úlcera péptica en presencia de gastritis bacteriana crónica durante el período de dishormonosis de otoño o primavera, solo se observa hiperplasia e hiperfunción de las células endocrinas que secretan gastrina, histamina, melatonina y serotonina. Las principales hormonas y aminas biogénicas producidas por la zona antropiloruduodenal están implicadas tanto en la estimulación de la secreción gástrica como en la modificación del trofismo y la proliferación celular, principalmente en esta zona. En el contexto de gastritis y duodenitis bacterianas activas, surgen condiciones favorables para la formación de úlceras. Con la formación de un defecto péptico, disminuye la actividad funcional de las células endocrinas. Esto conduce a una disminución de la agresión ácido-péptica, una mejora del trofismo tisular en la zona antropiloroduodenal y la creación de condiciones para la curación de úlceras gástricas y duodenales, incluso en el contexto de la expansión microbiana en curso de HP. En el período agudo de la úlcera péptica, se observa hiperplasia de las células productoras de endorfina α, que son citoprotectores universales. Actúan como los principales mecanismos protectores en las úlceras pépticas y facilitan el proceso de autolimitación de la úlcera y su cicatrización, tanto de forma directa como estimulando el sistema inmunitario. Al mismo tiempo, los anticuerpos contra HP, sintetizados en la submucosa del estómago y el duodeno, se unen eficazmente a las células bacterianas y neutralizan las toxinas HP y contribuyen a su muerte. Todo lo anterior contribuye a la creación de un equilibrio entre los llamados factores de agresión y factores de protección y la curación de un defecto péptico en la zona gastroduodenal. Clasificación. Clasificación (Panfilov Yu. A., Osadchuk M. A., 1991) Localización del defecto péptico: 1) úlcera gástrica (secciones subcardial y cardíaca, parte pilórica y canal pilórico, curvatura menor y mayor); 2) úlcera duodenal (sección bulbar y posbulbar); 3) úlceras de estómago y duodeno. El curso de la úlcera péptica. 1. Fácil. La exacerbación de la úlcera no es más de 1 vez en 1-3 años, la curación del defecto péptico finaliza a las 5-6 semanas desde el inicio de la terapia, la gravedad del dolor y los síndromes dispépticos son moderados. 2. Moderado. Recurrencia al menos 2 veces al año, epitelización de úlceras: dentro de 7 a 12 semanas, la gravedad del dolor y los síndromes dispépticos. 3. Pesado. Los períodos de remisión no superan los 3-4 meses. Además del dolor intenso, existen complicaciones. Fases de la enfermedad: 1) exacerbación de recurrencia de úlcera o trastornos funcionales del sistema gastroduodenal; 2) remisión completa (en aspectos clínicos, radiológicos, endoscópicos y funcionales); 3) incompleta (con la preservación de trastornos funcionales o estructurales en la zona gastroduodenal). La condición de la membrana mucosa del estómago y el duodeno: 1) gastritis crónica; 2) duodenitis crónica. Estado funcional del sistema gastroduodenal Secreción: normal, aumentada, reducida. Motilidad: normal, acelerada, lenta; evacuación: normal, acelerada, tardía, duodenostasis. Complicaciones: sangrado, perforación, penetración, perigastritis, periduodenitis, deformidad cicatricial del estómago y duodeno. Cuadro clínico. El cuadro clínico de la úlcera péptica es polimórfico. Los síntomas dependen del sexo y la edad del paciente, la época del año, la ubicación y el tamaño de la úlcera, las características personales y sociales del paciente y sus cualidades profesionales. La clínica está determinada por una combinación de signos: el curso crónico de la enfermedad desde el momento de su aparición, la presencia de signos de exacerbación y remisión de la enfermedad, curación del defecto en la mucosa gástrica y duodenal con la formación de un cicatriz. La úlcera péptica está representada por dos variantes clínicas y morfológicas: úlcera gástrica y úlcera duodenal. Tradicionalmente, se distinguen el dolor y los síndromes dispépticos. El signo clínico principal es el dolor en la parte superior del abdomen. Por la naturaleza del síndrome de dolor, es casi imposible distinguir entre la gastritis bacteriana crónica y la úlcera péptica. El dolor en la región epigástrica, en ayunas, principalmente en primavera y otoño, es igualmente frecuente tanto en la úlcera péptica como en la gastritis bacteriana crónica. El alivio del síndrome doloroso con alimentos y antiácidos medicinales se consigue tanto en la gastritis bacteriana crónica como en la úlcera péptica. Lo distintivo de la úlcera duodenal es solo la presencia de dolor en la región epigástrica durante la noche. Los vómitos con úlcera péptica son raros. Las náuseas son mucho más comunes con las úlceras estomacales y las úlceras duodenales. El estreñimiento acompaña a la úlcera duodenal crónica. Los síntomas de la enfermedad de úlcera péptica están determinados por la cantidad de defectos ulcerosos y su localización. Las úlceras estomacales múltiples son 3 veces más comunes en los hombres. El cuadro clínico en este caso depende de la localización de los defectos pépticos. Con úlceras en el cuerpo del estómago, dolor sordo en el epigastrio sin irradiación, que ocurre 20-30 minutos después de comer, y se notan náuseas. Con las úlceras de la región subcardial, son característicos los dolores sordos debajo del proceso xifoides, que se irradian hacia la mitad izquierda del tórax. Las úlceras gástricas y las úlceras duodenales combinadas son una combinación de una úlcera gástrica activa y una úlcera duodenal curada. Se caracterizan por la preservación a largo plazo del síndrome de dolor, curso persistente de la enfermedad, recaídas frecuentes de la enfermedad, cicatrización lenta de la úlcera y complicaciones frecuentes. Las úlceras extrabulbares incluyen úlceras localizadas en la región del esfínter bulboduodenal y distales a este. Su cuadro clínico tiene sus propias características y tiene mucho en común con las úlceras duodenales. Ocurren principalmente en pacientes de 40 a 60 años. Las úlceras posbulbares son graves y propensas a exacerbaciones frecuentes, acompañadas de sangrado masivo. El dolor localizado en el cuadrante superior derecho del abdomen, que se irradia hacia la espalda o debajo del omóplato derecho, ocurre en el 100% de los casos. La intensidad, la severidad del dolor, que desaparece solo después de tomar analgésicos narcóticos, lleva a los pacientes a una neurastenia severa. La estacionalidad de las exacerbaciones en úlceras extrabulbosas se registra en casi el 90% de los pacientes. En muchos pacientes, el sangrado gastrointestinal se convierte en un síntoma cardinal. Las úlceras del canal pilórico se caracterizan por un complejo de síntomas llamado síndrome pilórico: dolor epigástrico, náuseas, vómitos y pérdida de peso significativa. La exacerbación de la enfermedad es muy larga. En el contexto de la terapia antiulcerosa intensiva, la úlcera cicatriza en 3 meses. El abundante suministro de sangre al canal pilórico provoca una hemorragia gástrica masiva. diagnósticos. Con el curso no complicado de una úlcera péptica, no hay cambios en el análisis de sangre general, es posible una ligera disminución de la VSG y una ligera eritrocitosis. Cuando surgen complicaciones en los análisis de sangre, aparece anemia, leucocitosis, cuando el peritoneo está involucrado en el proceso patológico. No hay cambios en el análisis general de orina. En el análisis bioquímico de sangre en casos de curso complicado de úlcera péptica, son posibles cambios en los parámetros de la prueba siálica, proteína C reactiva, reacción DPA. El método tradicional de investigación en la patología del estómago es la determinación de la acidez del contenido gástrico. Son posibles varios indicadores: elevado y normal, en algunos casos incluso reducido. Una úlcera duodenal ocurre con alta acidez del jugo gástrico. En el examen de rayos X, una úlcera péptica es un "nicho", un depósito de suspensión de bario. Además de tal síntoma radiográfico directo, los signos indirectos de un defecto péptico son importantes en el diagnóstico: hipersecreción del contenido del estómago con el estómago vacío, trastornos de evacuación, reflujo duodenal, disfunción del cardias, espasmos locales, convergencia de pliegues mucosos, Deformidad cicatricial del estómago y el duodeno. La gastroduodenoscopia con biopsia es el método más fiable para el diagnóstico de úlcera péptica. Le permite evaluar la naturaleza de los cambios en la membrana mucosa en el borde de la úlcera, en la zona periulcerosa y garantiza la precisión del diagnóstico a nivel morfológico. En estudios endoscópicos y morfológicos, se encontró que la mayoría de las úlceras estomacales se encuentran en el área de la curvatura menor y el antro, con mucha menos frecuencia, en la curvatura mayor y en el área del canal pilórico. El 90% de las úlceras duodenales se localizan en la región bulbar. Una úlcera péptica suele tener una forma redonda u ovalada. Su fondo consiste en masas necróticas, debajo de las cuales hay tejido de granulación. La presencia de manchas oscuras en la base indica sangrado. La fase de curación de la úlcera se caracteriza por una disminución de la hiperemia de la membrana mucosa y un eje inflamatorio en la zona periulcerosa. El defecto se vuelve menos profundo y se elimina gradualmente de la placa fibrinosa. La cicatriz parece un área hiperémica de la mucosa con retracciones lineales o estrelladas de la pared. En el futuro, durante el examen endoscópico en el sitio de la úlcera anterior, se determinan varias violaciones del alivio de la membrana mucosa: deformaciones, cicatrices, estrechamiento. En la endoscopia, una cicatriz madura debido a la sustitución de un defecto por tejido de granulación tiene un aspecto blanquecino, no hay signos de inflamación activa. Un estudio morfológico de una muestra de biopsia obtenida del fondo y los bordes de la úlcera revela detritos celulares en forma de una acumulación de moco con una mezcla de leucocitos en descomposición, eritrocitos y células epiteliales descamadas con fibras de colágeno ubicadas debajo. Diagnóstico diferencial. Con el uso generalizado de la endoscopia, el diagnóstico diferencial de las ulceraciones del estómago y del duodeno (úlceras sintomáticas, ulceraciones específicas en tuberculosis, sífilis, enfermedad de Crohn, cáncer ulceroso primario, úlceras malignas secundarias) adquiere especial importancia. Para las úlceras sintomáticas, debe haber una causa que las haya provocado (exposición extrema, signos clínicos y morfológicos de enfermedades endocrinas, trastornos cardiovasculares y respiratorios, enfermedades reumáticas). Más que para la úlcera péptica, se caracterizan por una multiplicidad de lesiones, localización predominante en el estómago y tamaño significativo. Con úlcera péptica, prevalece el síndrome de dolor y con gastritis crónica, fenómenos dispépticos. En la gastritis crónica, el dolor es leve o ausente, no hay estacionalidad de la enfermedad y el dolor a la palpación es limitado; el agravamiento de la enfermedad a menudo depende de la naturaleza de los alimentos. El estado de la función secretora del estómago con gastritis puede ser diferente. De decisiva importancia son la gastroscopia y la gastrobiopsia, en las que se detectan cambios en la mucosa característicos de la gastritis y una úlcera en la úlcera péptica. La hernia de hiato (HH) también suele ir acompañada de dolor en el epigastrio. Sin embargo, a diferencia de la enfermedad de úlcera péptica, esta enfermedad se caracteriza principalmente por la edad avanzada de los pacientes, la relación del dolor con la posición del cuerpo (el dolor aumenta en la posición supina, se debilita en la posición vertical). El diagnóstico de HH se confirma con los resultados del examen de rayos X. La colecistitis crónica se caracteriza por dolor en el hipocondrio derecho y el epigastrio, que a menudo se irradia al omóplato derecho, al hombro, al ángulo de la mandíbula inferior derecha. Con la colecistitis calculosa, tienen un carácter sordo, monótono y apremiante, y con la colecistitis calculosa, adquieren el carácter de cólico. Se notan náuseas, estreñimiento, flatulencia. La condición subfebril persistente es posible. Con la obstrucción prolongada de los conductos biliares, la ictericia puede unirse. El diagnóstico de daños en el sistema biliar se verifica mediante los datos de la ecografía abdominal, el examen de rayos X (colecistografía), la colepancreatografía retrógrada endoscópica (CPRE), así como los resultados del sondeo duodenal, que está indicado solo para un proceso sin cálculos. En la pancreatitis aguda y la exacerbación del dolor crónico, se localizan en la mitad izquierda de la región epigástrica, son de naturaleza culebrilla, provocadas por la ingesta de cualquier alimento. En la anamnesis: patología del sistema biliar, abuso de alcohol, uso prolongado de medicamentos pancreáticos. Revelar objetivamente pérdida de peso, polifecal, esteatorrea, creadorrea. El diagnóstico se confirma con los resultados de un análisis de sangre bioquímico para enzimas pancreáticas, heces, para determinar la digestibilidad, así como con datos instrumentales. tratamiento. La terapia racional para las úlceras pépticas debe incluir un régimen, una nutrición adecuada, tratamiento farmacológico, psicoterapia, métodos de tratamiento físico y de spa. Durante el período de exacerbación de la úlcera péptica, es necesario observar estrictamente una dieta fraccionada (de 4 a 6 veces al día con un pequeño volumen de cada porción de alimento, ingerido a determinadas horas). Los productos alimenticios deben tener buenas propiedades tampón y contener una cantidad suficiente de proteínas (120-140 g). La psicoterapia es esencial para detener o reducir las reacciones psiconeuróticas derivadas del síndrome de dolor persistente y su expectativa. Los medicamentos utilizados para tratar las úlceras pépticas se dividen en 5 grupos: 1) medicamentos que afectan el factor ácido-péptico (antiácidos y H2bloqueadores de histamina, otros agentes antisecretores); 2) fármacos que mejoran la barrera de la mucosa gástrica; 3) fármacos que aumentan la síntesis de prostaglandinas endógenas; 4) agentes antibacterianos y antisépticos; 5) medicamentos que normalizan los trastornos de evacuación motora del estómago y el duodeno. Antiácidos: 1) soluble (absorbible): bicarbonato de sodio, carbonato de calcio (tiza) y óxido de magnesio (magnesia quemada); 2) insolubles (no absorbibles): trisilicato de magnesio e hidróxido de aluminio. Los antiácidos solubles tienen un efecto alcalinizante rápido, enérgico pero a corto plazo, pero a menudo provocan efectos secundarios, por lo que no se utilizan en el tratamiento de las úlceras pépticas. Los antiácidos insolubles a base de hidróxido de aluminio e hidróxido de magnesio (Almagel, Phosphalugel, Gelusillac, Topaal, Maalox, etc.) proporcionan una neutralización a largo plazo del ácido clorhídrico, envuelven la membrana mucosa y la protegen de los efectos dañinos del ácido y los alimentos. Además de neutralizar el ácido clorhídrico, ayudan a reducir la actividad proteolítica del jugo gástrico, se unen a la lisolecitina y los ácidos biliares y tienen un efecto citoprotector universal. Los antiácidos deben tomarse 1-2 horas después de las comidas y por la noche. Maalox se prescribe en suspensión (15 ml 4 veces al día) o tabletas (1-2 tabletas 4 veces al día), fosfalugel, en forma de gel (16 g 3-4 veces al día). Uno de los principales efectos secundarios de los antiácidos no absorbibles es la alteración de las heces. Las preparaciones de hidróxido de aluminio causan estreñimiento y las preparaciones de hidróxido de magnesio (Maalox) tienen un efecto laxante dependiente de la dosis. Una nueva era en el tratamiento de la úlcera péptica comenzó con el advenimiento de H2- bloqueadores de histamina. En condiciones fisiológicas, la histamina media los estímulos humorales y nerviosos extragástricos que provocan la producción de ácido. La estimulación de la producción de ácido clorhídrico por la histamina se debe a un aumento de la actividad del AMPc, que actúa sobre la enzima adenilciclasa, que se encuentra en la región productora de ácido del estómago, lo que potencia la secreción de iones de hidrógeno. Los datos obtenidos sirvieron de base para la síntesis de fármacos que interrumpen la participación de la histamina en el proceso secretorio a nivel celular, como cimetidina, ranitidina, famotidina, nizatidina, etc. Además, H2Los receptores de histamina previenen los trastornos de la microcirculación en la mucosa gástrica y, por lo tanto, previenen el desarrollo de úlceras. Además, reducen la producción de pepsina, aumentan la secreción de bicarbonatos, normalizan la motilidad gastroduodenal, aumentan el número de células epiteliales sintetizadoras de ADN, estimulan los procesos reparativos y aceleran la cicatrización de las úlceras gástricas y duodenales crónicas. Sin embargo, los fármacos de 1ª generación (cimetidina, cinamet, belomet, tagamet) pueden provocar alteraciones en el sistema nervioso, hepatitis tóxica, alteraciones del ritmo y la conducción en el sistema cardiovascular y alteraciones en los órganos hematopoyéticos. bloqueadores H2Las generaciones posteriores de receptores de histamina: ranitidina (zantak, ranisan, gistak), famotidina (kvamatel, lecedil, gastrosidin), nizatidina (roxatidina) difieren de la cimetidina en una buena tolerancia. La ranitidina se prescribe en una dosis de 150 mg 2 veces al día, famotidina, 20 mg 2 veces al día durante 4 a 6 semanas. Para prevenir el síndrome de abstinencia después de la cicatrización de la úlcera, se recomienda continuar tomando ranitidina (150 mg) o famotidina (20 mg) por la noche durante 2-3 meses. En los últimos años, ha aparecido un nuevo fármaco antisecretor, el omeprazol (omenrol, omez, losek), que pertenece a los derivados del benzimidazol. Bloquea la enzima H + -K + -ATPasa de la bomba de protones de la célula parietal. La vida media corta (alrededor de 1 hora) y la larga duración de la acción (18-24 horas) hacen posible tomar este medicamento una vez. El omeprazol se prescribe 20 mg por la noche 1 vez al día durante 2-3 semanas. El omeprazol ocupa el primer lugar en cuanto a la gravedad del efecto antisecretor entre los fármacos antiulcerosos modernos.Los efectos secundarios del fármaco no son muy pronunciados. El uso generalizado en el tratamiento de las úlceras pépticas ha encontrado gastrocepina (nirenzepina, gastrozepina), que pertenece a los fármacos anticolinérgicos. El medicamento bloquea selectivamente los receptores muscarínicos de acetilcolina ubicados en las células de la mucosa gástrica que producen ácido clorhídrico y pepsina. La gastrocepina tiene un efecto inhibidor sobre la secreción gástrica basal y estimulada, inhibe la producción de pepsina, ralentiza la evacuación del estómago, provoca la inhibición de la producción de gastrina, reduce el nivel de polipéptido pancreático, tiene un efecto citoprotector al aumentar la producción de glicoproteínas del moco gástrico. , así como mejorando el suministro de sangre a la membrana mucosa de la región gastroduodenal . Asignarlo a 50 mg 2 veces al día 30 minutos antes de las comidas. El curso del tratamiento es un promedio de 4 semanas. Los medicamentos que fortalecen la barrera mucosa del estómago incluyen preparaciones de bismuto coloidal (denol), que forma una película protectora en la membrana mucosa, reduce la actividad péptica del estómago, forma un compuesto insoluble con pepsina, mejora la formación de moco y tiene un efecto citoprotector. efecto, aumentando el contenido de prostaglandinas en la pared del estómago. Denol tiene la capacidad de inhibir la actividad de HP en la mucosa gástrica. El medicamento se prescribe 2 comprimidos (240 mg) 2 veces al día media hora antes de las comidas o 2 horas después de las comidas. Para evitar la acumulación de sales de bismuto en el organismo, no se recomienda realizar la terapia con estos medicamentos durante más de 8 semanas. Para el tratamiento antibacteriano de las úlceras gástricas y duodenales, se utilizan tetraciclina, amoxicilina y claritromicina. Se utilizan en combinación con otros fármacos antiulcerosos. Se han propuesto varios esquemas de terapia combinada (dos, tres, cuatro componentes). Terapia de dos componentes: amoxicilina 1000 mg 2 veces al día durante 2 semanas; omeprazol 40 mg dos veces al día. El esquema de tres componentes incluye la preparación de bismuto coloidal 2 mg 120 veces al día; tetraciclina 4 mg 250 veces al día; metronidazol 4 mg 250 veces al día. El ciclo de terapia es de 4 días. El esquema de cuatro componentes involucra omeprazol 20 mg 2 veces al día desde el día 1 hasta el día 10; de-nol 120 mg 4 veces al día del 4 al 10 día; tetraciclina 500 mg 4 veces al día del 4 al 10 día; metronidazol 500 mg 3 veces al día del 4 al 10 día. El esquema de cuatro componentes para el tratamiento de la úlcera péptica del estómago y el duodeno es reconocido como el más efectivo. A las 6 semanas se observa la curación del defecto péptico en el 93-96% de los pacientes. Después de la cicatrización de una úlcera péptica del estómago y el duodeno, tradicionalmente se utilizan dos tipos de tratamiento. 1) La terapia continua de mantenimiento se realiza con medicamentos antisecretores a la mitad de la dosis diaria por un período de hasta un año. 2) Terapia "a demanda", implica el uso de uno de los agentes antisecretores en la mitad de la dosis diaria durante dos semanas cuando aparecen los síntomas de la úlcera péptica. Pronóstico y prevención. Las formas no complicadas de la enfermedad tienen un pronóstico favorable para la vida y el trabajo. En caso de complicaciones de la úlcera péptica, el pronóstico está determinado por la oportunidad de la atención quirúrgica. La prevención de la recurrencia de la úlcera péptica incluye un control dinámico con exámenes de seguimiento obligatorios realizados por un médico 2 veces al año. Los exámenes deben incluir examen clínico y endoscópico y, si es necesario, morfológico. Como medida preventiva, se recomienda normalizar el sueño y el descanso, abandonar los malos hábitos, limitar la ingesta de medicamentos ulcerogénicos, racionalizar las cinco comidas al día y utilizar la terapia de dos o tres componentes durante una semana cada 3 meses. CONFERENCIA N° 12. Enfermedades del aparato digestivo. Enfermedades de los intestinos. Enfermedades del intestino delgado. enteritis crónica La enteritis crónica es una enfermedad del intestino delgado, caracterizada por una violación de sus funciones (digestión y absorción) en el contexto de cambios distróficos y desregenerativos, que culminan en el desarrollo de inflamación, atrofia y esclerosis de la membrana mucosa del intestino delgado. Etiología y patogénesis. Se trata de una enfermedad polietiológica que puede ser el resultado de una inflamación aguda del intestino delgado o de un proceso crónico primario. En los últimos años, Yersinia, Helicobacteria, Proteus, Pseudomonas aeruginosa, rotavirus, numerosos representantes de protozoos y helmintos (giardia, ascaris, tenias, opisthorchia, cryptosporidium) han adquirido gran importancia como factor etiológico en la enteritis crónica. De gran importancia en la aparición de enteritis crónica son los factores alimentarios: comer en exceso, comer alimentos secos, alimentos desequilibrados, predominantemente con carbohidratos, abuso de especias. La enteritis es causada por la radiación ionizante, la exposición a sustancias tóxicas y medicamentos. Entre los mecanismos patogénicos comunes de las enfermedades crónicas del intestino delgado, hay cambios en la microflora intestinal en el contexto de una disminución de la inmunidad local y general. Los cambios en el estado inmunológico (una disminución en el contenido de IgA secretora, un aumento en el nivel de IgE, una disminución en la transformación blástica de los linfocitos y la inhibición de la migración de leucocitos) conducen a la colonización del intestino delgado por representantes de microflora oportunista y un Disminución de la flora anaeróbica normal. La colonización bacteriana del intestino delgado mejora la secreción intestinal debido a la activación del AMPc de las células epiteliales, lo que aumenta la permeabilidad intestinal y mejora la producción de electrolitos y agua por parte de las células. La secreción de agua y electrolitos conduce a una violación del metabolismo del agua y la sal. Bajo la influencia de la flora microbiana, se altera la circulación enterohepática de la bilis. Los ácidos grasos se unen a los iones de calcio, formando jabones poco solubles que se excretan en las heces. La violación del metabolismo del calcio es promovida por cambios en el metabolismo de la vitamina D, lo que reduce la absorción de calcio. Bajo la influencia de los trastornos metabólicos de las vitaminas liposolubles, el contenido de microelementos en la sangre disminuye. La disbiosis prolongada promueve la sensibilización a los antígenos microbianos y alimentarios, causa inflamación inmune de la membrana mucosa, lo que resulta en la formación de antígenos tisulares. El aumento de la permeabilidad de la barrera mucosa se acompaña de la reabsorción de macromoléculas proteicas no divididas, que se convierten en alérgenos, y se altera la reactividad inmunológica. Con las alergias, se liberan sustancias biológicamente activas que aumentan la permeabilidad de la pared intestinal y cambian las propiedades funcionales de los enterocitos. Las violaciones de la microestructura de la membrana citoplasmática del enterocito conducen primero a la inhibición de la actividad de lactasa y luego a la actividad de maltasa y sacarasa. Con cambios distróficos y degenerativos en los epiteliocitos, se reduce la síntesis de enzimas y su adsorción en las membranas de los epiteliocitos (disacaridasas, peptidasas, enteroquinasa, fosfatasa alcalina), lo que provoca alteraciones en la digestión de la membrana y la cavidad. Todo esto se convierte en la base del síndrome de malabsorción. En las primeras etapas de la enfermedad, se desarrollan trastornos del metabolismo de los lípidos debido a una disminución en la absorción de grasas, su pérdida con las heces y cambios en la fase intestinal de la circulación de la bilis enterohepática. La violación del metabolismo de la bilis, a su vez, conduce a una violación del metabolismo de los lípidos, que afecta la estructura y función de las membranas celulares. En relación con la absorción insuficiente de grasa, se produce una violación de la síntesis de esteroides, lo que provoca una violación de las funciones de las glándulas endocrinas. Morfológicamente, la enteritis crónica se manifiesta por cambios inflamatorios y desregenerativos en la membrana mucosa del intestino delgado. Si el proceso progresa, se observa su atrofia y esclerosis. Clasificación (Zlatkina A. R., Frolkis A. V., 1985). 1) Etiología: infecciones intestinales, invasiones helmínticas, factores alimentarios, físicos y químicos, enfermedades del estómago, páncreas, vías biliares. 2) Fases de la enfermedad: exacerbación; remisión. 3) Grado de severidad: leve; moderado; pesado. 4) Corriente: monótona; recurrente; continuamente recurrente; latente. 5) Carácter de cambios morfológicos: eunit sin atrofia; jeunitis con atrofia parcial moderada de las vellosidades; jeunitis con atrofia parcial de las vellosidades; eunit con atrofia total de las vellosidades. 6) La naturaleza de los trastornos funcionales: trastornos de la digestión de la membrana (deficiencia de disacaridasa), malabsorción de agua, electrolitos, oligoelementos, vitaminas, proteínas, grasas, carbohidratos. 7) Complicaciones: solaritis, mesadenitis inespecífica. Cuadro clínico. El cuadro clínico de la enteritis crónica consta de síndromes entéricos locales y generales. El primero es causado por una violación de los procesos de digestión parietal (membrana) y de la cavidad (mala digestión). Los pacientes se quejan de flatulencia, dolor en la zona paraumbilical, hinchazón en forma de gorro, ruidos fuertes, diarrea y, con menos frecuencia, estreñimiento. La palpación revela dolor en el mesogastrio, así como a la izquierda y encima del ombligo (signo de Porges positivo), ruido de salpicaduras en la zona del ciego (signo de Obraztsov). Las heces adquieren un aspecto arcilloso, siendo característica la materia polifecal. El síndrome enteral general se asocia con una absorción deficiente de los ingredientes de los alimentos (malabsorción), lo que resulta en trastornos de todos los tipos de metabolismo, cambios en la homeostasis. Caracterizado por trastornos metabólicos multifacéticos, principalmente proteicos, que se manifiestan por una pérdida progresiva de peso corporal. Los cambios en el metabolismo de los carbohidratos son menos pronunciados, lo que se manifiesta por hinchazón, ruidos en el abdomen y aumento de la diarrea al tomar productos lácteos. En gran medida, la deficiencia de peso corporal en los pacientes se debe no solo a las proteínas, sino también al desequilibrio de los lípidos. Los cambios en el metabolismo de los lípidos están estrechamente relacionados con los trastornos metabólicos de las vitaminas y minerales liposolubles (calcio, magnesio, fósforo). Los signos característicos de la deficiencia de calcio son un síntoma positivo del rodillo muscular, convulsiones, fracturas óseas "no motivadas" recurrentes, osteoporosis, osteomalacia. También hay hinchazón de la cara, cianosis de los labios, glositis, irritabilidad, falta de sueño. Las violaciones del equilibrio de agua y electrolitos se manifiestan por debilidad general, inactividad física, hipotensión muscular, náuseas, vómitos y cambios en el sistema nervioso central. Los síntomas de polihipovitaminosis se vuelven típicos de enteritis crónica de gravedad moderada y grave. La hipovitaminosis C se manifiesta clínicamente por sangrado de las encías, sangrado nasal y uterino repetido, hematomas en la piel. La hipovitaminosis B se acompaña de palidez de la piel, glositis, estomatitis angular (cheilez). Signos de deficiencia de vitaminas liposolubles (A, O, E, K): mala visión crepuscular, sequedad de piel y mucosas, aumento del sangrado de las encías. Las formas graves de enteritis crónica se presentan con síntomas de disfunción endocrina (insuficiencia pluriglandular). El hipocorticismo se manifiesta por hipotensión arterial, arritmias cardíacas, anorexia y pigmentación de la piel. Una disminución en la actividad de las gónadas se acompaña de disfunción ovárica, trastornos menstruales, en los hombres: impotencia, ginecomastia, pérdida de cabello. La disfunción tiroidea se caracteriza por debilidad general, piel seca, bradicardia, disminución del rendimiento y trastornos mnésticos intelectuales. Diagnóstico y diagnóstico diferencial. Un análisis de sangre general revela anemia micro y macrocítica, un aumento de la VSG y, en casos graves, linfo y eosinopenia. Si la enfermedad es de origen parasitario, se puede observar linfocitosis y eosinofilia en la sangre. Un examen escatológico revela un tipo intestinal de esteatorrea por ácidos grasos y jabones, creadorrea, amilorrea. El contenido de enteroquinasa y fosfatasa alcalina en las heces aumenta. La masa diaria de heces aumenta significativamente. El análisis bacteriológico de las heces revela disbacteriosis de diversos grados. Hay una disminución de lacto y bifidobacterias, aparecen enterococos, cepas de Escherichia coli con propiedades enzimáticas alteradas. En el análisis general de orina en enteritis crónica severa, se observan microalbuminuria y migrohematuria. En un análisis de sangre bioquímico, se detectan hipoproteinemia, hipoalbuminemia, hipoglobulinemia, hipocalcemia, disminución del nivel de magnesio, fósforo y otros microelementos, trastornos del metabolismo de electrolitos en forma de disminución del nivel de sodio y potasio. Los trastornos del metabolismo de los lípidos se acompañan de cambios en el espectro de lípidos: el nivel de colesterol, los fosfolípidos disminuyen y el espectro de ácidos biliares, fosfolípidos y triglicéridos también cambia. Los resultados de un estudio de rayos X nos permiten aclarar la función motora del intestino delgado y el alivio de los cambios de la mucosa, distónicos y discinéticos en forma de ralentización o aceleración del paso de una suspensión de sulfato de bario a través del pequeño intestino, y el relieve de la mucosa cambia en forma de engrosamiento desigual, deformación y alisado de los pliegues. La gastroduodenoscopia revela gastritis atrófica y duodenitis. El cuadro morfológico de una forma leve de enteritis crónica se caracteriza por engrosamiento de las vellosidades, su deformación, disminución de la profundidad de las muescas, disminución del tono de los músculos lisos, edema subepitelial, cambios degenerativos en la superficie del epitelio. , adelgazamiento del borde en cepillo de las células, disminución del número de células caliciformes en la región de las vellosidades, aumento del número de criptas, infiltración de la propia capa mucosa con elementos linfoplasmocitarios, disminución de las células de Paneth en la zona del fondo de las criptas. Para la forma moderada, son típicas la atrofia parcial de las vellosidades, la disminución del número de criptas, el adelgazamiento de la membrana mucosa, la disminución del borde en cepillo y la infiltración linfoplasmocitaria de las capas submucosa y muscular. La forma grave de la enfermedad se caracteriza por una atrofia progresiva de las vellosidades, diagnosticada por criterios histológicos, histoquímicos y morfométricos. El proceso de proliferación de enterocitos prevalece sobre su diferenciación, aparece una gran cantidad de células inmaduras y defectuosas. El diagnóstico diferencial en enteritis crónica se realiza con enfermedad celíaca, enfermedad de Crohn, enfermedad de Whipple, amiloidosis intestinal, enfermedad diverticular, linfoma, tumores del intestino delgado. Comunes a todas estas condiciones son los síndromes clínicos de indigestión, absorción y disbacteriosis. El diagnóstico final se confirma mediante el examen morfológico de la membrana mucosa del intestino delgado. Entonces, para la enteropatía celíaca, es típica una indicación anamnésica de la relación de las exacerbaciones de la enfermedad con el uso de productos que contienen gliadina. La clínica de la enteropatía celíaca se parece a la enteritis crónica. Muy a menudo, los intestinos superiores se ven afectados y no hay cambios en el íleon. El sitio óptimo para tomar muestras de biopsia es el área de la membrana mucosa cerca del ligamento de Treitz. El examen morfológico revela una disminución en el número de células caliciformes y un aumento en el número de linfocitos interepiteliales, atrofia subtotal de las vellosidades e infiltración de células inflamatorias en su propia capa. En la enteropatía celíaca, los cambios morfológicos en el contexto de una dieta sin gluten son reversibles, a diferencia de la enteritis crónica banal, en la que los cambios morfológicos son irreversibles. En la enfermedad de Crohn se observa polimorfismo clínico, debido a la génesis autoinmune de la enfermedad y sus manifestaciones sistémicas características (como tiroiditis autoinmune, poliartritis, iritis, hepatitis, combinación frecuente de enteritis y colitis distal). Las pruebas endoscópicas y morfológicas tienen una alta resolución en la verificación de la enfermedad de Crohn, revelando el carácter mosaico de la lesión intestinal, cambios típicos del tipo "pavimento empedrado", que alternan con áreas de mucosa intacta. La radiografía, el examen endoscópico pueden detectar estenosis intestinales, a veces se forman fístulas intestinales. El diagnóstico morfológico establece la infiltración de células inflamatorias en todas las capas de la pared intestinal con daño máximo en la capa submucosa y cambios mínimos en la mucosa. En la capa submucosa se encuentran granulomas linfocíticos sarcoideos, patognomónicos de esta enfermedad. Para la enfermedad de Whipple, además de los signos de enteritis, son características las manifestaciones extraintestinales en forma de fiebre, artritis, linfadenopatía, hipotensión arterial y pigmentación de la piel. Los criterios morfológicos más informativos de la enfermedad. Las muestras de biopsia tomadas del intestino delgado revelan acumulación de grasa intracelular y extracelular en la mucosa del intestino delgado y los ganglios linfáticos mesentéricos; infiltración de su propia capa por grandes micrófagos que contienen gránulos libres de grasa positivos para CHIC y presencia de bacilos en la mucosa. tratamiento. El tratamiento de la enteritis crónica debe ser integral e incluir agentes que afecten los factores etiológicos, los mecanismos patogénicos, así como los síntomas locales y generales de la enfermedad. La base es la nutrición dietética, que ayuda a reducir el aumento de la presión osmótica en la cavidad intestinal, reduce la secreción y normaliza el paso del contenido intestinal. Excluya los productos que contienen fibra vegetal gruesa (verduras crudas, frutas, pan de centeno, nueces, pasteles, alimentos enlatados, especias, platos picantes, leche entera, cerveza, kvas, bebidas carbonatadas y alcohólicas). El uso de sal de mesa es limitado. Se necesitan comidas fraccionadas, hasta 5-6 veces al día. Durante el período de remisión, se introducen en la dieta algunas verduras y frutas, hasta 100-200 g por día. Asigne lechuga, tomates maduros pelados, peras tiernas, manzanas dulces, naranjas, mandarinas, frambuesas, fresas, fresas silvestres. Los alimentos deben hervirse o cocerse al vapor. La terapia con medicamentos debe ser etiotrópica, patogénica y sintomática. Tratamiento etiotrópico: para la disbiosis de grado II-IV, se prescriben medicamentos antibacterianos: metronidazol (0,5 g 3 veces al día), clindamicina (0,5 g 4 veces al día), cefalexina (0,5 g 2 veces al día), biseptol ( 0,48 g 2 veces al día), sulgin (1 g 3-4 veces al día), furazolidona (0,1 g 4 veces al día). Después de usar medicamentos antibacterianos, se prescriben eubióticos: bifidumbacterina o bificol 5 dosis 3 veces al día 30 minutos antes de las comidas, coli-bacterina o lactobacterina 3 dosis 3 veces al día antes de las comidas, hilakforte 40 gotas 3 veces al día antes de las comidas. El tratamiento con preparaciones bacterianas se lleva a cabo durante mucho tiempo: 3 cursos de 3 meses cada año. Para la disbacteriosis estafilocócica, se prescribe un bacteriófago antiestafilocócico (20 ml 3 veces al día durante 15 a 20 días), para la disbacteriosis proteus: bacteriófago coliproteus por vía oral, 20 ml 3 veces al día, el curso de tratamiento es de 2 a 3 semanas. Como agente sintomático antidiarreico, se prescribe imodium (loperamida) 1 cápsula 2-3 veces al día antes de las comidas durante 3-5 días. Para mejorar el proceso de digestión, se recomiendan las enzimas: pancreatina, panzinorm forte, festal, digestal, pankurmen, mezim forte, trienzyme, cuyas dosis se seleccionan individualmente (desde 1 tableta 3 veces al día hasta 3-4 tabletas 4 veces al día ) y que se prescriben directamente antes o durante las comidas durante 2-3 meses. Si es necesario, la terapia de reemplazo enzimático se continúa durante más tiempo. Para normalizar el estado general de los pacientes con enteritis y eliminar los trastornos metabólicos, está indicada la terapia de sustitución. Para compensar la deficiencia de vitaminas, se prescriben vitaminas B y B durante 4-5 semanas.6 50 mg cada uno, PP - 10-30 mg, C - 500 mg cada uno. Para la esteatorrea está indicada la administración parenteral de vitamina B.2 (100-200 mcg) en combinación con vitaminas liposolubles. En el interior se recetan riboflavina 0,02 g, ácido fólico 0,003 g una vez al día, vitamina E 3300 UI 2 veces al día. En la enteritis crónica que cursa con déficit proteico grave, junto con una dieta, administración parenteral de plasma, 150-200 ml de hidrolizados de proteínas y mezclas de aminoácidos (aminopéptido, alvesina, poliamina, intrafusina, 250-500 ml por vía intravenosa durante 20 días) en combinación con hormonas anabólicas (retabolil 2,0 ml 1 vez en 7-10 días durante 3-4 semanas) y mezclas grasas como intralipid. El nombramiento de esteroides está indicado solo con una deficiencia significativa de proteínas, hipoproteinemia, la presencia de insuficiencia suprarrenal. Para corregir los trastornos de agua y electrolitos, la administración intravenosa de panangin 20-30 ml, gluconato de calcio al 10% 10-20 ml en 200-400 ml de solución isotónica o solución de glucosa, las soluciones poliiónicas "Disol", "Trisol", "Quartasol" son indicado. Las soluciones de electrolitos se administran por vía intravenosa durante 10 a 20 días bajo el control del estado ácido-base y el nivel de electrolitos en sangre. Pronóstico y prevención. El pronóstico de vida y de capacidad laboral es favorable en la mayoría de los casos. Los signos de pronóstico desfavorable son un curso de la enfermedad con recaídas continuas, pérdida de peso significativa y repentina, anemia, síndrome de trastorno endocrino (disminución de la libido, dismenorrea, infertilidad). La prevención de la enteritis crónica consiste en el tratamiento oportuno de infecciones intestinales agudas y enfermedades concomitantes de la zona gastroduodenal, en la observación de la dieta, en la administración profiláctica de preparaciones bacterianas durante la radiografía y la radioterapia. CONFERENCIA N° 13. Enfermedades del tubo digestivo. Enfermedades de los intestinos. enfermedad de Crohn La enfermedad de Crohn es una enfermedad intestinal crónica con manifestaciones sistémicas; cuya base morfológica es la inflamación granulomatosa autoinmune del tracto gastrointestinal. Etiología y patogénesis. La etiología y patogénesis de la enfermedad no se han estudiado suficientemente. Los más populares son los conceptos infecciosos e inmunológicos de la aparición de la enfermedad. En los últimos años han aparecido informes sobre el papel etiológico de los microorganismos del género Yersinia. Sin embargo, es difícil determinar si estos agentes microbianos son patógenos o comensales. Al mismo tiempo, los cambios en la microflora intestinal juegan un papel importante en la patogénesis de la enfermedad. Típicamente, una disminución de bacterias de tipo bífido con un aumento simultáneo de enterobacterias con signos de patogenicidad. Los mecanismos autoinmunes juegan un papel en el desarrollo de la enfermedad. En la enfermedad de Crohn aparecen autoanticuerpos (IgC, IgM) contra los tejidos intestinales. El sustrato morfológico de la enfermedad es un proceso inflamatorio autoinmune que se presenta inicialmente en la capa submucosa, se extiende a todo el espesor de la pared intestinal y se caracteriza por la presencia de infiltrados granulomatosos seguidos de ulceración de la mucosa, desarrollo de abscesos y fístulas que curan con la formación de cicatrices y estrechamiento de la luz intestinal. Con el aumento de la duración de la enfermedad, aumenta la extensión de la lesión y aparecen síntomas de trastornos extraintestinales. Clasificación. Clasificación (F.I. Komarov, A.I. Kazanov, 1992). 1) Curso: agudo; crónico. 2) Características del proceso: lesión dentro del intestino delgado; lesión dentro de la región ileocecal; lesión dentro del colon. 3) Complicaciones: estrechamiento del intestino; dilatación tóxica del colon; fístulas; amilosis; nefrolitiasis, colelitiasis; A12-anemia por deficiencia. Cuadro clínico. El cuadro clínico de la enfermedad de Crohn se caracteriza por una diversidad significativa, que está determinada por la localización y extensión del proceso patológico en el intestino, la forma de la enfermedad y la adición de complicaciones. El inicio de la enfermedad puede ser agudo, cuando la enfermedad progresa desde el principio, y crónico, cuando la enfermedad comienza gradualmente. En el primer caso, el diagnóstico a menudo se realiza durante la laparotomía realizada por sospecha de apendicitis u obstrucción intestinal que se desarrolló sin razón aparente en personas jóvenes. Al mismo tiempo, se encuentran un área hiperémica del intestino delgado, ganglios linfáticos agrandados de la raíz mesentérica, característicos de la enfermedad de Crohn. Los pacientes se quejan de dolor en el abdomen sin una localización específica, aflojamiento de las heces sin impurezas patológicas visibles, pérdida de peso, temperatura corporal de bajo grado. Un estudio objetivo presta atención a la palidez de la piel, que se correlaciona con la gravedad de la anemia, la hinchazón en las piernas debido a la alteración de la absorción y el metabolismo de las proteínas. A la palpación del abdomen, se notan flatulencia y ruidos sordos. Cuando el proceso se localiza en el intestino grueso, hay una alternancia de estreñimiento con diarrea, dolor abdominal tipo cólico, heces líquidas o semiformadas que contienen una mezcla de sangre. Cuando se afecta el tracto gastrointestinal superior, se presentan síntomas parecidos a esofagitis crónica, gastritis crónica y duodenitis crónica. Puede haber dolor detrás del esternón durante el paso de los alimentos a través del esófago, dolor nocturno y "hambriento" en el epigastrio, dolor a la palpación en la zona piloroduodenal. Durante el examen físico del paciente, se determina palidez de la piel, condición subfebril, deficiencia de peso corporal, la palpación revela asas intestinales espasmódicas, dolor en la zona paraumbilical, en la región ilíaca derecha. En la enfermedad de Crohn, se observan signos extraintestinales de la enfermedad: estomatitis aftosa, flemones y fístulas de la cavidad oral, artritis, que se asemeja a la artritis reumatoide en la clínica, con síntomas característicos de lesiones simétricas de pequeñas articulaciones, rigidez en la mañana. Cambios típicos en los ojos: iritis, iridociclitis, maculopatía. La piel puede desarrollar eritema nudoso y pioderma gangrenoso. La diarrea se caracteriza por un aumento en la frecuencia de las deposiciones hasta 10 veces al día o más, materia polifecal. El volumen de las heces está determinado por la localización anatómica del proceso: con daño en el intestino delgado proximal, el volumen de heces es mucho mayor que con daño en las partes distales. Se observa pérdida de peso en todos los pacientes. Diagnóstico y diagnóstico diferencial. Un análisis de sangre clínico durante una exacerbación revela leucocitosis, anemia y un aumento de la VSG. Los cambios en el análisis general de orina aparecen en formas graves, caracterizadas por la adición de amiloidosis renal (proteinuria). Un análisis de sangre bioquímico revela hipoproteinemia, hipoalbuminemia, aumento de las globulinas α, disminución del contenido de hierro, vitamina B12, ácido fólico, zinc, magnesio y potasio. Los datos del examen escatológico permiten evaluar indirectamente el nivel de la lesión. En el coprograma con localización intestinal del proceso, se encuentran materia polifecal, esteatorrea, creadorrea; con el colon: una mezcla de moco, leucocitos, eritrocitos. El diagnóstico por rayos X le permite establecer la localización y prevalencia del proceso patológico en el intestino. Las áreas del intestino afectado se alternan con áreas del intestino sin cambios. Las asas alteradas se vuelven rígidas, el cuadro es mosaico con pequeños defectos de llenado y con la penetración del contraste más allá de la pared intestinal en forma de bolsas. El intestino en la zona afectada adquiere el carácter de finamente bordeado, con la formación de pseudodivertículos. La capacidad contráctil de la pared intestinal se reduce o se pierde por completo, la evacuación de bario se ralentiza. Se observa un estrechamiento desigual de la luz intestinal, como resultado, se vuelve tan estrecho que toma la forma de un cordón. Por encima de la zona de estrechamiento, el intestino se expande. El diagnóstico endoscópico tiene una importancia decisiva en la verificación del diagnóstico. Para la enfermedad de Crohn, lo más característico es el cambio en el antro del estómago y la sección inicial del duodeno. Endoscópicamente, es posible detectar un estrechamiento circular del antro, asemejándose a una estenosis tumoral. El período inicial de la enfermedad de Crohn se caracteriza por datos endoscópicos deficientes: una membrana mucosa opaca, contra la cual son visibles erosiones del tipo aftas, rodeadas de granulaciones blanquecinas. El patrón vascular está ausente o suavizado. En la luz del intestino y en sus paredes, se determina moco purulento. En remisión clínica, los cambios descritos pueden desaparecer por completo. A medida que avanza la enfermedad, la mucosa se engrosa de manera desigual, tiene un color blanquecino y se observan grandes úlceras superficiales o profundas. La luz intestinal se estrecha, lo que dificulta el avance del colonoscopio. La colonoscopia permite realizar una biopsia dirigida de la membrana mucosa en cualquier parte del colon y en el íleon terminal. En la enfermedad de Crohn, el proceso patológico comienza en la capa submucosa, por lo que la biopsia debe realizarse de manera que una parte de la capa submucosa entre en el material de biopsia. En relación con lo anterior, en el 54% de los casos no se detecta el sustrato morfológico de la enfermedad. Es necesario diferenciar la enfermedad de Crohn de la colitis ulcerosa inespecífica, tuberculosis gastrointestinal, colitis isquémica, enfermedad de Whipple, enfermedad diverticular, colitis pseudomembranosa, linfogranulomatosis, amiloidosis primaria del intestino delgado, enteritis crónica. Comunes a todas estas enfermedades son el síndrome de dispepsia intestinal y algunas lesiones sistémicas. Sin embargo, la colitis ulcerosa se caracteriza por un cambio en las partes distales del colon con la participación obligatoria del recto y el sigmoide en el proceso. En la colitis ulcerosa inespecífica no hay segmentación de la lesión; con menos frecuencia que en la enfermedad de Crohn, se determinan las manifestaciones sistémicas y el síndrome de malabsorción es menos pronunciado. Sin embargo, el diagnóstico más preciso de la enfermedad de Crohn se confirma mediante endoscopia con biopsia dirigida. La forma gastrointestinal de tuberculosis se distingue de la enfermedad de Crohn por la localización frecuente en el íleon, hallazgos endoscópicos que permiten la detección de úlceras con bordes elevados y exfoliados llenos de contenido grisáceo. Tales úlceras se curan con la formación de una cicatriz corta, que no se observa en la enfermedad de Crohn. En los ancianos, es necesario diferenciar la enfermedad de Crohn de la colitis isquémica. Para este último, los ataques de dolor intenso en el abdomen después de comer son cambios típicos de colitis detectables por irrigoscopia en el ángulo esplénico, el colon descendente y el sigmoide. El signo radiográfico más importante de la colitis isquémica es el síntoma de la "huella digital". El examen endoscópico y morfológico revela células típicas de colitis isquémica que contienen hemosiderina y fibrosis en el material de biopsia. El diagnóstico de linfogranulomatosis y amiloidosis intestinal primaria se realiza sobre la base del examen histológico. En el primer caso, se encuentran células de Berezovsky-Sternberg en la muestra de biopsia del ganglio linfático mesentérico, en el segundo caso, hay depósitos de amiloide en la mucosa rectal. tratamiento. Se prescribe una dieta mecánica y químicamente suave con un alto contenido en proteínas, vitaminas, microelementos, con exclusión de la leche si es intolerante y limitación de fibra vegetal gruesa. Está indicado el uso de hidrolizados enterales líquidos. Las preparaciones de salazo y los corticosteroides forman la base de la terapia farmacológica patogénica. La dosis diaria de medicamentos es de 3-6 g Con la localización del proceso patológico en el intestino grueso, la actividad de la sulfasalazina supera la actividad de la prednisolona. En ausencia del efecto del uso de sulfasalazina, con lesiones predominantemente del intestino delgado y signos pronunciados de inflamación inmune, así como en presencia de manifestaciones sistémicas de la enfermedad, está indicado el uso de corticosteroides. El efecto de su uso se nota en las primeras 8 semanas desde el inicio del tratamiento. La prednisolona se prescribe de acuerdo con el siguiente esquema: en el punto álgido de una exacerbación, 60 mg por día, luego la dosis se reduce gradualmente y en la semana 6-10 se ajusta a una dosis de mantenimiento de 5-10 mg por día. Al alcanzar la remisión clínica, el medicamento se cancela gradualmente. Si no se consigue la remisión, se continúa el tratamiento con prednisolona de forma ambulatoria hasta las 52 semanas. En el curso severo de la enfermedad, en caso de complicaciones en forma de fístulas enteroentéricas rectovaginales, piel-entéricas actuales tórpidas, el nombramiento de 6-mercaptopurina por vía oral a 0,05 g 2-3 veces al día está indicado para cursos de 10 días con un intervalo de 3 días hasta que se logre la remisión clínica. Posteriormente, pasan a tomar dosis de mantenimiento del fármaco durante el año. La dosis de 6-mercaptopurina en este caso es de 75 mg al día. El efecto del tratamiento con inmunosupresores se puede determinar no antes de 3-4 meses. El metronidazol encontró un uso generalizado en el tratamiento de la enfermedad de Crohn, cuyas principales indicaciones son las fístulas y fisuras perianales, la falta de efecto de las preparaciones de salazo y los glucocorticoides, así como las recaídas de la enfermedad después de la proctectomía. El medicamento se prescribe en una dosis de 500-1000 mg por día. La duración del curso continuo no debe exceder las 4 semanas. La terapia sintomática de la enfermedad de Crohn se reduce al nombramiento de cursos cortos (2-3 días cada uno) de medicamentos antidiarreicos (imodio, loperamida). Las dosis se seleccionan individualmente de acuerdo con el efecto clínico. No prescribir antidiarreicos durante mucho tiempo (más de 5 días). Debido a la presencia del síndrome de malabsorción en la enfermedad de Crohn, los preparados enzimáticos que no contienen ácidos biliares (pancreatina, mesimforte, solizim, somilase) se utilizan en dosis de 2 a 6 comprimidos con cada comida. Según las indicaciones, la anemia y la hipoalbuminemia se corrigen prescribiendo preparados de hierro (por vía parenteral) y administrando Alvezin, hidrolizadores de proteínas, aminopéptido, aminosangre. Asigne multivitaminas en pastillas, Essentiale en cápsulas. El tratamiento de la disbacteriosis se lleva a cabo de acuerdo con las reglas generales. Pronóstico y prevención. En la enfermedad de Crohn, el pronóstico de vida con un diagnóstico oportuno y un seguimiento eficaz es favorable, pero en el ámbito laboral es incierto. En pacientes con enfermedad grave, en presencia de complicaciones y manifestaciones sistémicas, se establece el grupo de discapacidad I o II. La enfermedad de Crohn es una enfermedad precancerosa. Es necesario familiarizar al paciente en detalle con las características del curso de la enfermedad y advertirle sobre posibles complicaciones, describiendo sus manifestaciones clínicas de forma accesible. CONFERENCIA N° 14. Enfermedades del tubo digestivo. Enfermedades del colón. Colitis ulcerosa inespecífica La colitis ulcerosa inespecífica es una enfermedad inflamatoria que afecta la membrana mucosa del colon con cambios ulcerativos-destructivos, que tiene un curso crónico recidivante, a menudo acompañada del desarrollo de complicaciones potencialmente mortales. Etiología y patogénesis. La colitis ulcerosa inespecífica es una enfermedad idiopática. Se desconocen los motivos de su aparición. De las muchas teorías que explican el origen de la enfermedad (infecciosa, enzimática, alérgica, inmune, neurogénica, etc.), la teoría infecciosa es la de mayor interés, pero los intentos de aislar el patógeno del contenido del colon no tuvieron éxito. El proceso patológico en la colitis ulcerosa crónica comienza en el recto y se extiende en dirección proximal, capturando las partes suprayacentes del colon. La inflamación puede limitarse al recto (proctitis), recto y sigmoides (proctosigmoiditis), extenderse a toda la sección izquierda (colitis del lado izquierdo) o afectar a todo el colon (colitis total). En términos funcionales, la longitud del colon en la colitis inespecífica se reduce alrededor de 1/3. En el estudio de material patológico reveló inflamación difusa de la membrana mucosa del colon (hinchazón pronunciada y plétora, engrosamiento de los pliegues). Se forman úlceras de varios tamaños en la mucosa, que tienen una forma irregular, cuyo fondo se encuentra en la membrana mucosa, con menos frecuencia en la capa submucosa, en las membranas musculares y serosas. Morfológicamente, en el período inicial, se determina un infiltrado en la lámina propia de la membrana mucosa, que consiste en linfocitos con una mezcla de leucocitos polimorfonucleares, dilatación de los vasos sanguíneos e hinchazón del endotelio de estos vasos. La violación de la microcirculación se acompaña del desarrollo de hipoxia, que exacerba las violaciones de la estructura y función del epitelio de la mucosa. La etapa de manifestaciones clínicas pronunciadas se acompaña de infiltración de leucocitos en la capa superficial del epitelio, el desarrollo de criptitis, en la que se producen acumulaciones de neutrófilos en la luz de las criptas. Las partes distales de las criptas se obliteran, aparecen abscesos de las criptas, en cuya formación juega un papel importante la maduración alterada de los epiteliocitos. Con la necrosis del epitelio que recubre las criptas, se abren los abscesos de las criptas y se forman úlceras. Durante el período de remisión, la membrana mucosa se restaura, pero permanece su atrofia, la deformación de las criptas y el engrosamiento desigual de la lámina propia. Clasificación (Yu. V. Baltaitis et al., 1986). Característica clínica. 1. Forma clínica: 1) agudo; 2) crónico. 2. Actual: 1) progresando rápidamente; 2) con recaídas continuas; 3) recurrente; 4) latente. 3. Grado de actividad: 1) exacerbación; 2) exacerbación que se desvanece; 3) remisión. 4. Gravedad: 1) luz; 2) moderado; 3) pesado. Característica anatómica. 1. Característica macroscópica: 1) proctitis: 2) proctosigmoiditis; 3) lesión subtotal; 4) derrota total. 2. Característica microscópica: 1) el predominio de procesos inflamatorios destructivos; 2) reducción de procesos inflamatorios con elementos de reparación; 3) consecuencias del proceso inflamatorio Complicaciones. 1. locales: 1) sangrado intestinal; 2) perforación del colon; 3) estrechamiento del colon; 4) pseudopoliposis; 5) infección intestinal secundaria; 6) desaparición de la membrana mucosa; 7) dilatación tóxica del colon; 8) malignidad. 2. Generalidades: 1) hipocorticismo funcional; 2) sepsis; 3) manifestaciones sistémicas: artritis, sacroilitis, lesiones cutáneas, iritis, amiloidosis, flebitis, colangitis esclerosante, distrofia hepática. Cuadro clínico. El cuadro clínico de la colitis ulcerosa es polimórfico y depende de la gravedad del curso y la gravedad del proceso. El curso del proceso inflamatorio, a menudo considerado crónico, en algunos casos se vuelve agudo. El alcance del daño al colon también puede variar. La colitis ulcerosa inespecífica se caracteriza por 3 síntomas principales: secreción de sangre escarlata durante las deposiciones, disfunción intestinal y dolor abdominal. El aislamiento de sangre (desde vetas en la superficie de las heces hasta 300 ml o más) durante la defecación es el primer signo de la enfermedad. En la forma aguda de la enfermedad, la sangre es secretada por un chorro, lo que conduce a una disminución de la presión arterial hasta el desarrollo de colapso y shock hemorrágico. La disfunción intestinal se manifiesta en forma de quejas de heces inestables repetidas, que son el resultado de un daño extenso en la membrana mucosa y una disminución en la absorción de agua y sales. Muy a menudo, la diarrea ocurre con colitis ulcerosa severa. Sin embargo, la diarrea no es un indicador fiable de la gravedad del proceso. La gravedad de la diarrea en combinación con la presencia de sangre roja en las heces es importante. En un número significativo de pacientes con colitis ulcerosa, la sangre y el moco se encuentran periódicamente en la superficie de las heces formadas, lo que a menudo se considera erróneamente como una manifestación de hemorroides. Los pacientes se quejan de dolor en la parte inferior del abdomen de tipo cólico o persistente, que se localiza con mayor frecuencia en el hipogastrio o en la región ilíaca izquierda, aumenta antes del acto de defecar y desaparece después. A menudo se nota tenesmo. Cuando las capas submucosa, muscular y serosa del intestino están involucradas en el proceso, el dolor aumenta; a la palpación del abdomen aparece defensa de los músculos de la pared abdominal anterior. El curso leve de la colitis ulcerosa inespecífica se caracteriza por una condición satisfactoria de los pacientes. El dolor en el abdomen es moderado y de corta duración. La silla está decorada, acelerada, hasta 2-3 veces al día. Se encuentra sangre y mucosidad en las heces. El proceso se localiza dentro del recto y el colon sigmoide. El curso clínico es recurrente. El efecto del tratamiento con preparados de salazo es satisfactorio. Las recaídas ocurren no más de 2 veces al año. Las remisiones pueden ser largas (más de 2-3 años). El curso moderado de la enfermedad se diagnostica si el paciente tiene diarrea. La silla es frecuente (hasta 6-8 veces al día), en cada porción es visible una mezcla de sangre y moco. Los dolores tipo calambres en el abdomen son más intensos. Hay fiebre intermitente con elevación de la temperatura corporal hasta 38°C, debilidad general intensa. También pueden existir manifestaciones extraintestinales de la enfermedad (artritis, uveítis, eritema nodoso). El curso es continuamente recurrente, el efecto de las preparaciones de salazo es inestable, las hormonas se recetan durante las exacerbaciones. La forma grave de la enfermedad se caracteriza por un inicio agudo. Una lesión total del intestino grueso se desarrolla rápidamente con la extensión del proceso patológico profundamente en la pared intestinal. La condición del paciente se deteriora bruscamente. La clínica se caracteriza por un inicio súbito, fiebre alta, diarrea profusa hasta 24 veces al día, sangrado intestinal profuso y un rápido aumento de la deshidratación. Aparece taquicardia, disminuye la presión arterial, aumentan las manifestaciones extraintestinales de colitis ulcerosa inespecífica. El tratamiento conservador no siempre es efectivo y, a menudo, se requiere cirugía de emergencia. Diagnóstico y diagnóstico diferencial. En los análisis de sangre clínicos en las formas leves de la enfermedad, la leucocitosis neutrofílica leve, el aumento de la VSG y los recuentos de glóbulos rojos no cambian. A medida que aumenta la gravedad del curso y aumenta la duración de la exacerbación, se produce anemia de origen mixto (B12-deficiente y deficiente en hierro), aumento de la VSG. En el análisis bioquímico de la sangre en formas moderadas y graves, se observan disproteinemia, hipoalbuminemia, hipergammaglobulinemia, desequilibrio electrolítico y estado ácido-base. En el análisis general de la orina, los cambios aparecen solo cuando surgen complicaciones en forma de síndrome nefrótico en el contexto de la amiloidosis, cuando se observan cambios característicos en los análisis de orina: proteinuria, sedimento urinario "muerto", también hay un aumento en la sangre. y el nivel de creatinina, urea. El papel principal en el diagnóstico lo adquiere el examen endoscópico con biopsia dirigida, ya que en la colitis ulcerosa inespecífica la mucosa del colon se ve afectada principalmente. El recto siempre está involucrado en el proceso patológico, es decir, durante la endoscopia se detectan cambios erosivos y ulcerativos inmediatamente detrás del esfínter anal durante la sigmoidoscopia. En la colitis ulcerosa, la curva rectosigmoidea no siempre es posible de superar debido a un espasmo severo. Un intento de sujetar el tubo del proctoscopio se acompaña de un dolor intenso. En esta situación, el proctoscopio debe insertarse a una profundidad de no más de 12-15 cm. La colonoscopia durante una exacerbación grave de la colitis ulcerosa inespecífica no es segura de realizar. Debe utilizarse en caso de alto riesgo de malignidad. Cabe destacar el alto contenido de información de la sigmoidoscopia. El cuadro endoscópico depende de la forma de la enfermedad. Con una forma leve, membrana mucosa opaca edematosa, capas espesas de moco blanquecino en las paredes del intestino, son visibles leves hemorragias de contacto. El patrón vascular de la capa submucosa no se determina visualmente. En el curso moderado de la enfermedad, se revelan hiperemia y edema de la membrana mucosa, sangrado severo por contacto, hemorragias, erosiones y úlceras de forma irregular, capas gruesas de moco en las paredes del intestino. En un curso severo de la enfermedad, la membrana mucosa del colon se destruye en una extensión considerable. Se encuentra una superficie interna granular y sangrante, extensas áreas de ulceración con depósitos fibrinosos, seudopólipos de varios tamaños y formas, pus y sangre en la luz intestinal. Las contraindicaciones para la colonoscopia y la sigmoidoscopia son formas graves de colitis ulcerosa en la etapa aguda de la enfermedad. El examen de rayos X le permite determinar la extensión de la lesión; aclarar el diagnóstico en caso de datos de endoscopia insuficientemente convincentes; diagnóstico diferencial con enfermedad de Crohn, enfermedad diverticular, colitis isquémica; detectar oportunamente signos de malignidad. Las radiografías simples pueden revelar acortamiento del intestino, ausencia de haustración, dilatación tóxica, gas libre debajo de la cúpula del diafragma durante la perforación. La irrigoscopia debe realizarse con mucho cuidado. Puede provocar un deterioro en el estado del paciente. En algunos casos, la preparación del paciente para el enema de bario con enemas y laxantes tiene que ser sustituida por una dieta especial prescrita 2 días antes del estudio. En algunos casos, el uso de un enema de contraste puede acelerar la perforación o provocar una dilatación tóxica del colon. Por lo tanto, la irrigoscopia se realiza después del hundimiento de los fenómenos agudos. Este método revela irregularidades y "granulosidad" de la mucosa, engrosamiento de la pared intestinal, ulceración, pseudopoliposis, falta de haustración. El diagnóstico diferencial de la colitis ulcerosa inespecífica se realiza principalmente con infecciones intestinales agudas. En presencia de una epidemia de infecciones intestinales, el diagnóstico se establece fácilmente. Pero incluso en el caso de morbilidad esporádica en infecciones intestinales agudas, el síndrome de colitis fluye sin recaídas, mientras que la colitis ulcerosa tiene un curso recurrente. Los métodos más precisos para identificar la infección intestinal aguda incluyen bacteriológicos y serológicos. A menudo, la colitis ulcerosa se diferencia de la enfermedad de Crohn. En los casos típicos, la enfermedad de Crohn difiere de la colitis inespecífica en la ausencia de daño en el recto, la participación frecuente del íleon en el proceso patológico y las lesiones segmentarias de la pared intestinal. El diagnóstico definitivo se puede realizar mediante la detección de granulomas linfoides específicos de la enfermedad de Crohn en muestras de biopsia. Con la colitis granulomatosa, la paraproctitis y las fístulas pararrectales se detectan con más frecuencia que con la colitis ulcerosa inespecífica. En algunos casos, se hace necesario distinguir entre colitis ulcerosa y tuberculosis intestinal. Para la tuberculosis intestinal, es característica una cierta localización del proceso (íleon, región ileocecal), daño intestinal segmentario. Pero a veces con tuberculosis intestinal, el recto y todo el intestino grueso se ven afectados. El cuadro colonoscópico de la tuberculosis intestinal se caracteriza por la presencia de úlceras con bordes elevados llenas de contenido grisáceo. Las úlceras tuberculosas tienden a extenderse en dirección transversal y dejan cicatrices cortas en las que reaparecen las úlceras. Con la colitis ulcerosa inespecífica, no se forman cicatrices en el sitio de las úlceras anteriores. En pacientes ancianos y seniles, la colitis ulcerosa debe diferenciarse de la colitis isquémica. Esta última se caracteriza por un intenso dolor paroxístico en el abdomen 20-30 minutos después de comer, mientras que en la colitis ulcerosa el dolor se presenta antes del acto de defecar. El signo radiológico más importante es el síntoma de la "huella digital". La imagen endoscópica de la colitis isquémica se caracteriza por límites bien definidos de la lesión, hemorragias submucosas, formaciones pseudopólipas cianóticas que sobresalen en la luz intestinal. El examen histológico revela células que contienen hemosiderina y fibrosis. La ausencia de sangrado por contacto en el momento de la biopsia también es más indicativa de colitis isquémica. tratamiento. La ausencia de un factor etiológico único y la complejidad de la patogénesis de la colitis ulcerosa inespecífica dificultan el tratamiento de esta enfermedad. Se utilizan medicamentos que tienen efectos antiinflamatorios y antibacterianos: salazopiridazina, sulfasalazina, salazodimetoxina, salofalk. La sulfasalazina tomada por vía oral, con la participación de la microflora intestinal, se descompone en ácido 5-aminosalicílico y sulfapiridina. La sulfapiridina no absorbida inhibe el crecimiento de la microflora anaeróbica en el intestino, incluidos clostridios y bacteriodos. Y gracias al ácido 5-aminosalicílico, el fármaco no sólo provoca cambios en la microflora intestinal, sino que también modula las reacciones inmunitarias y bloquea los mediadores del proceso inflamatorio. El medicamento se prescribe en una dosis de 2 a 6 g por día durante todo el período de inflamación activa. Cuando el síndrome colítico cede, la dosis de sulfasalazina se reduce gradualmente hasta alcanzar el nivel de mantenimiento (en promedio, 1-1,5 comprimidos al día). El nombramiento de derivados del ácido 5-aminosalicílico (salofalk, mesacol, salosan, tidikol) es el método básico y puede usarse como monoterapia para formas leves y moderadas de colitis ulcerosa. El tratamiento se lleva a cabo en el contexto de la dietoterapia con la excepción de los productos lácteos, en presencia de un contenido equilibrado de proteínas, grasas, carbohidratos y vitaminas en la dieta. Es aconsejable excluir frutas frescas, verduras, alimentos enlatados. Los alimentos deben ser mecánica y químicamente cuidadosos. Alimente fraccionadamente 4-5 veces al día. El desequilibrio de vitaminas interrumpe el proceso de absorción de microelementos y se compensa con el nombramiento de preparaciones complejas en tabletas ("Duovit", "Oligovit", "Unicap"). En el síndrome diarreico severo en personas con curso leve y moderado de la enfermedad, está indicado el nombramiento de sandostatin, que inhibe la síntesis de hormonas gastrointestinales y aminas biogénicas (péptido intestinal vasoactivo, gastrina, serotonina), cuya producción aumenta considerablemente en colitis ulcerosa y enfermedad de Crohn. Y también la droga reduce la secreción y mejora la absorción en el intestino, inhibe el flujo sanguíneo visceral y reduce la motilidad. Cuando se usa sandostatin (dentro de los 7 días a una dosis de 0,1 mg 2 veces, por vía subcutánea), la diarrea disminuye, el tenesmo prácticamente desaparece y la excreción de sangre con heces disminuye. En una forma grave de colitis ulcerosa inespecífica, el tratamiento se lleva a cabo en el contexto de la nutrición parenteral. El contenido proteico de estos preparados debe ser de aproximadamente 1,5-2,0 g/kg de peso corporal. Los corticosteroides, que se administran por vía parenteral, son un tratamiento patogénico para una forma grave de la enfermedad: durante el primer día, la prednisona se administra por vía intravenosa a intervalos de 12 horas (90-120 mg o más), en los próximos 5 días - por vía intramuscular, reduciendo gradualmente la dosis. Con un efecto positivo, cambian a medicación oral (prednisolona 40 mg por día). La administración a largo plazo de hormonas durante un período de remisión estable no es práctica. En pacientes con un curso severo de la enfermedad, se observó un efecto positivo de la oxigenación hiperbárica (OHB). El uso de un curso de HBO (7-10 procedimientos) durante el período de remisión puede reducir la frecuencia de las recaídas. Indicaciones de tratamiento quirúrgico de emergencia: perforación intestinal, dilatación tóxica, sangrado intestinal profuso, malignidad. En la forma moderada del curso de la úlcera ulcerosa inespecífica, se requiere una dieta estricta con restricción de fibra, productos lácteos y un alto contenido de proteínas. La prednisolona se administra por vía oral a una dosis inicial de 20-40 mg por día. El tratamiento se puede complementar con sulfasalazina y sus análogos, que se toman por vía oral o se administran en microclysters y óvulos en el recto. La dosis inicial de sulfasalazina es de 1 g por día, luego se aumenta a 4-6 g. Como método auxiliar de tratamiento, se pueden usar decocciones de hierbas con efectos antiinflamatorios y hemostáticos (raíz de pimpinela, hoja de ortiga, liquen, conos de aliso gris, raíz de regaliz), la medicina herbal a menudo le permite reducir la dosis de salazopreparaciones, prolongar remisión. Pronóstico y prevención. En casos graves y en presencia de complicaciones sistémicas y locales, el pronóstico es grave. Los pacientes están completamente incapacitados para trabajar. En las formas leves y moderadas de la enfermedad, el pronóstico de vida es favorable. Los pacientes deben ser trasladados a trabajos ligeros. Durante el período de remisión se recomienda el tratamiento de mantenimiento con salazopreparados, agentes bacterianos, psicoterapia y dietoterapia. Los pacientes que sufren de colitis ulcerosa durante mucho tiempo (más de 5 a 7 años) deben asignarse al grupo de riesgo para la aparición de cáncer de intestino y registrarse en los registros del dispensario. A estos pacientes se les muestra una vez al año una colonoscopia con biopsia dirigida. CONFERENCIA N° 15. Enfermedades de los riñones. Glomerulonefritis aguda La glomerulonefritis aguda (GNA) es una enfermedad renal aguda difusa de carácter infeccioso-alérgico, localizada en los glomérulos. La AGN puede ser una enfermedad independiente (primaria) o ser secundaria como parte de otra enfermedad, complicando el cuadro clínico y diagnóstico de esta última. AGN generalmente afecta a hombres jóvenes y de mediana edad. Etiología. La AGN ocurre con mayor frecuencia después de una infección por cocos (influenza, amigdalitis aguda, faringitis causada por las llamadas cepas de microorganismos nefritogénicos). En el 60-80% de los pacientes se detecta estreptococo β-hemolítico del grupo A; en 1/3 de los casos no se puede establecer la etiología del AGN. La hipotermia prolongada, especialmente en condiciones de alta humedad, contribuye al desarrollo de AGN. La vacunación también es un factor en la aparición de la enfermedad, y en el 75% de los casos los riñones se ven afectados tras la segunda o tercera inyección. Patogenesia. La patogénesis de la enfermedad tiene un mecanismo inmunológico: cuando los antígenos (estreptocócicos, medicinales, proteínas extrañas) ingresan al cuerpo, en respuesta se forman anticuerpos que se unen a estos antígenos y, junto con la tercera fracción del complemento, forman complejos inmunes que circulan en el sistema vascular. cama. Los complejos son capaces de depositarse en la cara exterior de la membrana basal de los capilares glomerulares, provocando su daño mediante la liberación de productos de degradación del complemento, que aumentan la permeabilidad de los capilares y provocan cambios locales en estos últimos. Los neutrófilos se apresuran a los sitios de depósito de complejos inmunes, cuyas enzimas lisosomales agravan el daño al endotelio y la membrana basal, separándolos entre sí. La degranulación plaquetaria provoca la liberación de serotonina, lo que provoca hemocoagulación y depósito de fibrina en la membrana basal. La eliminación de los complejos inmunes del cuerpo se ve facilitada por una reacción de macrófagos en forma de proliferación de células mesangiales y endoteliales, con la efectividad de este proceso, se produce la recuperación. Cuadro clínico. El cuadro clínico de la enfermedad consta de los siguientes síndromes. síndrome urinario. 1. Proteinuria debida al paso de moléculas de proteína a través de los espacios de la pared capilar del glomérulo, formados durante el depósito de inmunocomplejos sobre ellos. La proteinuria es de naturaleza selectiva, en la que predominantemente las albúminas pasan a través del "filtro" glomerular. 2. Hematuria por afectación en el proceso patológico del mesangio capilar y tejido intersticial. Los eritrocitos penetran a través de las más pequeñas roturas de la membrana basal, cambiando su forma. 3. Cilindruria: excreción urinaria de células cilíndricas de los túbulos. Durante los procesos distróficos en los túbulos de las células desintegradas del epitelio renal, se forman cilindros granulares que consisten en una masa granular densa; los cilindros cerosos tienen contornos definidos y una estructura homogénea; Los cilindros hialinos son formaciones proteináceas. El síndrome hipertensivo se observa debido a: 1) retención de sodio y agua; 2) activación de los sistemas renina-angiotensina-aldosterona y simpaticoadrenal; 3) disminución de la función del sistema depresor de los riñones. El síndrome de edema se asocia con los siguientes factores: 1) una disminución de la filtración glomerular debido a su derrota; 2) disminución de la carga de filtración de sodio y aumento de su reabsorción; 3) retención de agua debido a la retención de sodio en el cuerpo; 4) un aumento en BCC; 5) hiperaldosteronismo secundario; 6) un aumento en la secreción de ADH y un aumento en la sensibilidad de la nefrona distal a ella, lo que lleva a la retención de líquidos; 7) un aumento en la permeabilidad de las paredes capilares y la liberación de plasma en los tejidos; 8) una disminución de la presión oncótica del plasma con proteinuria masiva. Las quejas presentadas en AGN no son específicas y ocurren en diversas enfermedades. Es muy importante indicar en la anamnesis un dolor de garganta reciente, exacerbación de amigdalitis crónica, hipotermia, etc. Algunos pacientes notan una disminución de la producción de orina, combinada con algo de hinchazón (pasto) de la cara por la mañana. En 1/3-3/4 pacientes en los primeros días de la enfermedad, no hay dolores dolorosos muy fuertes en la región lumbar asociados con un aumento en el tamaño de los riñones. También hay un aumento de la fatiga, dolor de cabeza, dificultad para respirar durante el esfuerzo físico, un aumento a corto plazo de la temperatura corporal a subfebril. La hipertensión arterial, detectada solo en la mitad de los pacientes, se caracteriza por un aumento en los números a 140-160 / 85-90 mm Hg. Arte. (raramente - hasta 180/100 mm Hg. Art.). diagnósticos. En el 100% de los casos, el examen de orina revela proteinuria de diversa gravedad, cilindruria y, lo que es más importante para el diagnóstico, hematuria de diversa gravedad, desde microhematuria (hasta 10 glóbulos rojos en el campo de visión) hasta macrohematuria (aunque bastante rara). ). Sin embargo, si se sospecha AGN, es necesario realizar una serie de análisis de orina repetidos o realizar una prueba de Nechiporenko (que determina la cantidad de elementos formados en 1 μl), ya que es posible que no se detecten glóbulos rojos en una sola porción de orina. Al examinar la sangre, se detectan indicadores de fase aguda (aumento en el contenido de fibrinógeno y α2-globulina, proteína C reactiva, aceleración de ESR), el número de leucocitos cambia poco, anemia moderada. Con un curso sin complicaciones de AGN, el contenido de sustancias nitrogenadas (creatinina, indican, urea) en la sangre no cambia. En la fase inicial de la enfermedad, se observa un cambio en la prueba de Reberg: una disminución de la filtración glomerular y un aumento de la reabsorción tubular, que se normaliza a medida que se recupera. Un examen de rayos X en pacientes con hipertensión arterial severa puede mostrar un aumento moderado del ventrículo izquierdo, que toma el mismo tamaño a medida que el paciente se recupera. Hay 3 variantes clínicas de AGN. 1) Variante monosintomática: quejas menores, ausencia de edema e hipertensión arterial, solo existe síndrome urinario; la variante más común del curso de la enfermedad (86% de los casos). 2) Variante nefrótica: edema, oliguria son pronunciados, es posible aumentar la presión arterial a números relativamente bajos, se detecta en el 8% de los pacientes. 3) Versión extendida: hipertensión arterial, alcanzando números elevados (180/100 mm Hg. Art.), edema moderadamente pronunciado, insuficiencia circulatoria, ocurre en el 6% de los casos. Diagnóstico diferencial. La AGN debe distinguirse de la glomerulonefritis crónica, que no es difícil con el inicio agudo de la AGN y la posterior reversión completa de los síntomas. Sin embargo, en ausencia de un inicio agudo, así como en caso de persistencia a largo plazo de ciertos signos de la enfermedad, el diagnóstico se vuelve mucho más complicado. Si la diferenciación es difícil, se recurre a una biopsia por punción del riñón. Es difícil diferenciar AGN de pielonefritis debido a la presencia de leucocituria en ambas enfermedades. Sin embargo, la AGN se acompaña de proteinuria más masiva y, en algunos casos, de edema. El diagnóstico diferencial también se ve favorecido por los síntomas clínicos de la pielonefritis en forma de dolor más pronunciado en la parte inferior de la espalda, acompañado de fiebre y trastornos disúricos. También tiene valor diagnóstico la definición de bacteriuria en la pielonefritis, la identificación de leucocitos "activos", así como estudios radiográficos (deformación de las copas) e isotópico-renográficos (asimetría de la función renal). La AGN como enfermedad independiente debe diferenciarse de las enfermedades crónicas difusas del tejido conjuntivo, en las que la AGN es una de las manifestaciones de la enfermedad. Esta situación suele presentarse con la gravedad de los síndromes urinario, hipertensivo y edematoso y la claridad insuficiente de otros síntomas de la enfermedad, más a menudo con el LES (lupus eritematoso sistémico). El diagnóstico correcto en LES se puede hacer teniendo en cuenta el síndrome articular, daño a la piel y otros órganos (corazón), cambios inmunológicos pronunciados (detección de anticuerpos anti-órgano en títulos altos, células de lupus eritematoso, anticuerpos contra ADN y ARN ), así como el seguimiento de la dinámica del cuadro clínico. tratamiento. El tratamiento para la AGN es complejo e incluye las siguientes medidas. 1. Modo. Si se sospecha AGN o inmediatamente después de establecer el diagnóstico, el paciente debe ser hospitalizado de inmediato. Se debe observar un reposo estricto en cama durante aproximadamente 2 a 4 semanas hasta la eliminación del edema y la normalización de la presión arterial. Permanecer en la cama proporciona un calentamiento uniforme del cuerpo, lo que conduce a una disminución del vasoespasmo (por lo tanto, a una disminución de la presión arterial) y a un aumento de la filtración glomerular y la diuresis. Después del alta hospitalaria, el tratamiento domiciliario está indicado hasta por 4 meses desde la fecha de inicio de la enfermedad, que es la mejor prevención de la transición de AGN a la etapa crónica. 2. Dieta. Dependiendo de la gravedad de los síntomas clínicos, es muy importante restringir los líquidos y el cloruro de sodio. Con una forma expandida y nefrótica, se recomienda un ayuno completo durante 1-2 días con ingesta de líquidos en una cantidad igual a la diuresis. En el día 2-3, se muestra el consumo de alimentos ricos en sales de potasio (gachas de arroz, papas). La cantidad total de agua que se bebe por día debe ser igual al volumen de orina asignado para el día anterior más 300-500 ml. Después de 3-4 días, el paciente pasa a una dieta con restricción de proteínas (hasta 60 g por día) y la cantidad total de sal no supera los 3-5 g / día. Se recomienda tal dieta hasta la desaparición de todos los síntomas extrarrenales y una marcada mejoría en el sedimento urinario. 3. La terapia con medicamentos incluye, en primer lugar, la terapia antibacteriana, que, sin embargo, debe llevarse a cabo solo si se establece de manera confiable la naturaleza infecciosa de AGN (el patógeno ha sido aislado y no han pasado más de 3 semanas desde el inicio de la enfermedad). enfermedad). Suele prescribirse penicilina o sus análogos semisintéticos en dosis convencionales. La presencia de focos evidentes de infección crónica (amigdalitis, sinusitis, etc.) también es una indicación directa para la terapia con antibióticos. Los diuréticos en el tratamiento de AGN están indicados solo con retención de líquidos, aumento de la presión arterial y aparición de insuficiencia cardíaca. La furosemida más efectiva (40-80 mg), utilizada hasta la eliminación del edema y la hipertensión. No hay necesidad de una prescripción a largo plazo de estos medicamentos, 3-4 dosis son suficientes. En ausencia de edema, pero con hipertensión persistente o con un efecto antihipertensivo insuficiente de los saluréticos, se prescriben medicamentos antihipertensivos (clofelina, dopegyt) con una duración de administración que depende de la persistencia de la hipertensión arterial. En la forma nefrótica de AGN, se prescribe una terapia inmunosupresora (corticosteroides: prednisona 60-120 mg por día, seguido de una disminución gradual de la dosis, duración del uso de 4 a 8 semanas). En caso de AGN con edema severo y disminución significativa de la diuresis, se administra heparina a razón de 20-000 UI al día durante 30-000 semanas, consiguiendo un aumento del tiempo de coagulación de la sangre de 4-6 veces. Con proteinuria prolongada, se prescribe indometacina o voltaren a 75-150 mg por día (en ausencia de hipertensión y oliguria). El pronóstico es favorable, sin embargo, con formas prolongadas, existe la posibilidad de que el proceso se vuelva crónico. La profiláctica AGN se reduce al tratamiento eficaz de la infección ochago, el endurecimiento racional. Para detectar oportunamente la aparición de la enfermedad después de la vacunación, el SARS transferido en todos los pacientes, es necesario examinar la orina. CONFERENCIA N° 16. Enfermedades de los riñones. pielonefritis La pielonefritis es una enfermedad infecciosa en la que la pelvis renal, sus cálices y la sustancia de los riñones están implicados en el proceso, con una lesión predominante del tejido intersticial. En este sentido, la pielonefritis es una nefritis intersticial (intersticial). Este es un concepto más amplio que la pielonefritis. Denota, en primer lugar, un tipo de inflamación de los riñones de cualquier etiología con afectación predominante del intersticio, y en segundo lugar, una enfermedad especial en la que esta inflamación es su única y principal expresión. Cerca de la nefritis intersticial está la llamada nefritis túbulo-intersticial, en la que hay una lesión amigable de los túbulos y el estroma de los riñones. Clasificación. Según los datos clínicos y morfológicos, se distingue la pielonefritis aguda y crónica, que generalmente tiene un curso recurrente en forma de ataques de pielonefritis aguda. Además, la pielonefritis puede ser unilateral y bilateral. Según la forma del curso (para pielonefritis crónica): forma recurrente, pielonefritis crónica latente, riñón arrugado pielonefrítico. Etiología y patogénesis. La pielonefritis es una enfermedad infecciosa. Sus agentes causantes son agentes infecciosos de naturaleza inespecífica: E. coli, enterococos, estafilococos y otras bacterias, pero en la mayoría de los casos hablamos de E. coli (40%) y flora mixta (38%). Se llama la atención sobre las formas L de las bacterias, los protoplastos (los cuerpos de las bacterias, desprovistos de membranas que puedan soportar la infección), la cándida, que puede causar pielonefritis crónica. Las fuentes de infección pueden ser las amígdalas, las enfermedades de los órganos genitales y el intestino grueso, es decir, los agentes infecciosos pueden penetrar en el riñón, incluida la pelvis, con el torrente sanguíneo (pielonefritis descendente hematógena), que se observa en muchas enfermedades infecciosas (fiebre tifoidea, gripe , angina, sepsis). Más a menudo, los microbios ingresan a los riñones de forma ascendente desde los uréteres, la vejiga, la uretra (pielonefritis ascendente urogénica), lo que se ve facilitado por la discinesia de los uréteres y la pelvis, el aumento de la presión intrapélvica (reflujo vesicorrenal y pielorrenal), así como reabsorción del contenido de la pelvis en las venas de la médula renal (reflujo pielovenoso). La pielonefritis ascendente, por regla general, complica aquellas enfermedades del sistema genitourinario, en las que la salida de la orina es difícil (cálculos y estenosis de los uréteres, estenosis de la uretra, tumores del sistema genitourinario), por lo que a menudo se desarrolla durante el embarazo. La infección linfogénica en los riñones (pielonefritis linfogénica) también es posible, cuando el colon y los órganos genitales son la fuente de infección. Para el desarrollo de la pielonefritis, además de la penetración de la infección en los riñones, son de gran importancia la reactividad del cuerpo y una serie de causas locales que causan una violación del flujo de orina y la estasis urinaria. Las mismas razones explican la posibilidad de un curso crónico recurrente de la enfermedad. Microorganismos infectados con cambios funcionales y morfológicos en el tracto urinario que conducen a estasis urinaria, deterioro del flujo venoso y linfático del riñón, contribuyendo a la fijación de la infección en los riñones, causan zonas focales y polimórficas de infiltrados inflamatorios y supuración del intersticio de uno o ambos riñones. El tejido intersticial de los túbulos se ve afectado y luego las nefronas. Hay endarteritis productiva, hiperplasia de la capa media de los vasos, los fenómenos de hialinosis, arteriolosclerosis se desarrollan hasta el riñón secundariamente arrugado. En los últimos años, se asigna un cierto papel en el desarrollo de la pielonefritis crónica a las reacciones autoinmunes: bajo la influencia de los antígenos bacterianos, la inmunoglobulina G y el complemento se depositan en la membrana basal de los capilares glomerulares, causando su daño. La transición de la pielonefritis aguda a crónica se ve facilitada por: diagnóstico tardío de pielonefritis aguda, hospitalización inoportuna, presencia de infecciones crónicas, diabetes mellitus, gota y abuso de analgésicos: fenacetina. La pielonefritis crónica es más frecuente en mujeres (50%), que se ve facilitada por embarazos, especialmente repetidos (los estrógenos provocan atonía de los músculos lisos de las vías urinarias), en la infancia en niñas, lo que se asocia a la estructura de las vías urinarias , sus anomalías. Cuadro clínico. Como se mencionó anteriormente, es posible un curso de pielonefritis tanto agudo como crónico. El cuadro clínico de la fase aguda de la enfermedad se caracteriza por un aumento repentino y brusco de la temperatura corporal hasta 39-40 ° C, puede ocurrir la aparición de debilidad, dolor de cabeza, escalofríos, combinados con sudoración profusa, náuseas y vómitos. Junto con el aumento de la temperatura corporal, aparecen dolores en la región lumbar que, por regla general, se notan en un lado. La naturaleza del dolor es sorda, su intensidad es diferente. En el caso del desarrollo de la enfermedad en el contexto de la urolitiasis, un ataque de pielonefritis está precedido por un ataque de cólico renal. En ausencia de una terapia adecuada, la enfermedad puede volverse crónica, o esto conduce al desarrollo de procesos supurativos en el riñón, que se manifiestan clínicamente por un deterioro en el estado general del paciente y cambios bruscos de temperatura (de 35-36 °C por la mañana a 40-41 °C por la noche). La pielonefritis crónica es, por regla general, una consecuencia de la pielonefritis aguda no tratada, cuando fue posible eliminar la inflamación aguda, pero no fue posible destruir radicalmente todos los patógenos en el riñón, ni restaurar la salida fisiológica de la orina del riñón. La pielonefritis crónica se preocupa por los constantes dolores sordos en la región lumbar, que se agravan con el clima húmedo y frío. Además, la pielonefritis crónica es propensa a exacerbaciones periódicas, cuando el paciente tiene todos los signos de un proceso agudo. diagnósticos. El problema de diagnosticar la enfermedad se debe al hecho de que los síntomas de la pielonefritis son similares a los síntomas de otras enfermedades resultantes de la inflamación del tracto urinario. El plan de examen de diagnóstico incluye análisis de sangre, análisis de orina, así como estudios que muestran el estado del sistema urinario: ultrasonido de los riñones, estudios de rayos X, análisis de PCR para un agente infeccioso. Para verificar el tipo de agente infeccioso, es necesario realizar un cultivo bacteriológico de una muestra de orina y se utiliza el método de tomografía computarizada para excluir los procesos tumorales. Por lo tanto, los métodos de investigación especiales y de laboratorio son de gran importancia para el reconocimiento de la enfermedad. Y en la pielonefritis crónica, las manifestaciones decisivas y, a veces, las únicas son los cambios en la orina, la sangre y el tracto urinario. Es necesario monitorear dinámicamente la presión arterial y el peso del paciente. Se observa leucocitosis, aumento de la ESR, cambio de neutrófilos en la sangre, un aumento en el nivel de nitrógeno residual (en una norma de 20-40 mg), urea (en una norma de 40-60 mg), creatinina (en una norma de 53-106 μmol / l), indican (norma de 1,41, 3,76-180 µmol/l), colesterol (norma 200-83 mg), cloruros en sangre (norma XNUMX mmol/l). Importante para el diagnóstico de cambios en la orina: disminución de la gravedad específica, proteinuria (incluida la diaria), hematuria y cilindruria. Sin embargo, los métodos para la determinación cuantitativa de los elementos formados del sedimento urinario están adquiriendo una importancia diagnóstica cada vez mayor: Kakovsky-Addis (leucocitos normales hasta 4 millones de glóbulos rojos - hasta 1 millón, cilindros - hasta 2 mil en 24 horas), Amburger (leucocitos normales hasta 2000 , eritrocitos - hasta 1400, cilindros - hasta 20 por 1 minuto), Nechiporenko (normalmente leucocitos hasta 2500, eritrocitos - hasta 1000, cilindros - hasta 20 en 1 ml de orina recién liberada) . La proporción del número absoluto de eritrocitos y leucocitos en el sedimento urinario en la pielonefritis cambia drásticamente hacia un predominio significativo de leucocitos de 10 a 20 veces. En la pielonefritis crónica, las células de Stenheimer-Malbin aparecen en la orina: leucocitos grandes, con movimiento browniano de gránulos citoplasmáticos, que aparecen con una disminución de las propiedades osmóticas de la orina (gravedad específica por debajo de 10-14), teñidos de azul con violeta de genciana y safronina, Leucocitos "activos": leucocitos alterados, que poseen el movimiento browniano del protoplasma, revelados cuando se tiñen con una solución acuosa al 1% de azul de metileno con la adición de agua destilada. El valor diagnóstico de un aumento en el número de leucocitos "activos" y células de Stenheimer-Malbin (hasta 40%), bacteriuria (recuento microbiano de más de 100 mil por 1 ml de orina), prueba de nitrito (con un recuento microbiano de más de 100 mil U, los microbios descomponen los nitritos de la orina), con la adición de ácido sulfanílico y L-naftilamina, aparece un color rojo), una prueba colorimétrica TTX (bajo la acción de las deshidrogenasas microbianas, el cloruro de trifeniltetrazolito se reduce a rojo insoluble trifenilformazán dentro de 4-10 horas a una temperatura de -37 ° C), una prueba de prednisolona provocativa (el paciente recolecta en un plato estéril, la porción media de la orina es el control, luego se administran 30 mg de prednisolona en 10 ml de solución salina se inyecta lentamente en la vena y la porción media de la orina se recolecta tres veces a intervalos de una hora y después de 24 horas; en la pielonefritis crónica, el número de leucocitos, bacterias se duplica, aparecen leucocitos "activos", al menos en una porción), antibiogramas. Se debe prestar especial atención a la microscopía de la tuberculosis de los riñones (microscopía de frotis teñidos según Tsil, siembra de orina en medios especiales: el método de Preis y Shkolnikova, el método biológico). Si se sospecha un proceso unilateral, es necesario realizar una prueba de orina, tomada por separado de cada riñón con catéteres especiales. Los métodos de investigación radiológica desempeñan un papel importante en el diagnóstico de la pielonefritis crónica: radiografía de estudio y tomografía (caracterizan la posición, el tamaño y la forma de los riñones), pielografía excretora y retrógrada (disminución de la concentración y capacidad excretora de los riñones, espasmos , anomalías, deformidades de la pelvis, cálices), neumopielografía (para el reconocimiento de cálculos sin contraste), angiografía renal (revela una violación de la arquitectura vascular: arterias y venas). Para determinar la seguridad de la función y el parénquima de los riñones, especialmente con un proceso unilateral, se utilizan métodos de radioindicación: renografía (yodo hippuran 131) y escanografía (usando neohidruro Hg 203). La biopsia por punción en el caso de pielonefritis por los focos del proceso puede no aportar información. La cromocistoscopia puede indicar daño renal. tratamiento. La mayoría de las veces, la terapia para la pielonefritis es conservadora; sin embargo, si la pielonefritis aguda es purulenta, puede ser necesaria una intervención quirúrgica. El tratamiento conservador consiste en un régimen, dieta, el uso de antibióticos, así como diversos medicamentos que estabilizan la función de los riñones y el cuerpo del paciente en su conjunto. En la pielonefritis aguda, está indicado el reposo estricto en cama. Los alimentos deben consumirse alimentos que contengan la cantidad óptima de proteínas, grasas e hidratos de carbono. En el período agudo, es necesario alternar proteínas y alimentos vegetales. Con intoxicación severa, debe beber mucha agua. El tratamiento de la pielonefritis crónica consiste en la repercusión de la infección (etiotrópica) en la pielonefritis primaria y la eliminación de una u otra causa en la pielonefritis secundaria, mecanismos patogénicos y tratamiento de las complicaciones. El tratamiento más eficaz es tras la determinación del antibiograma. Se lleva a cabo un tratamiento continuo (al menos 2 meses) con medicamentos antibacterianos. Inmediatamente después de la admisión, se prescribe un medicamento antibiótico, sulfanilamida o nitrofurano. Después de 1-10 días, los medicamentos se cambian, el tratamiento se lleva a cabo hasta la desaparición persistente de la leucocituria y la bacteriuria. Tan pronto como se elimine la exacerbación, se lleva a cabo un tratamiento intermitente con uno de los agentes antibacterianos durante 4-5 meses: el medicamento se administra durante 7 días, luego se toma un descanso durante 8-10 días, o el medicamento se administra durante 10 días con un intervalo de 15 a 20 días, o el medicamento se administra durante 15 días, el intervalo se realiza durante 15 días y luego se prescribe nuevamente la terapia antimicrobiana. La duración del tratamiento y los intervalos están determinados por los síntomas clínicos y el control de laboratorio. Cabe señalar que en caso de pielonefritis que se ha desarrollado en un paciente con amigdalitis crónica, los antibióticos de la serie de las penicilinas son los más efectivos; en caso de infecciones genitales en hombres y mujeres, se utilizan antibióticos de amplio espectro (ver Tabla 12) . En presencia de flora gramnegativa, el tratamiento con ácido nalidíxico da buenos resultados (negros, ievigramon: 1,0 g 4 veces al día durante 7 días, pero sus preparaciones deben prescribirse con menos frecuencia que otras drogas (2 veces)). De las sulfamidas, se usan etazol (1,0 g 4 veces - 10 días), solafur (0,1 g 3 veces), sulfonamidas de acción prolongada. Además, los cursos se tratan con furazolidona, furadonina, furagina (0,1 g 4 veces al día). Debe enfatizarse que la función renal debe determinarse antes de iniciar el tratamiento. La terapia antibiótica a largo plazo debe llevarse a cabo con una tasa de filtración glomerular de al menos 30 ml/min o con un contenido de nitrógeno residual en el suero sanguíneo de no más de 70 mg. Un indicador de la efectividad del medicamento después de una semana de tratamiento es una disminución en el recuento microbiano a 10 en 000 ml de orina. Es posible reducir la virulencia de la microflora y aumentar la eficacia de los agentes antibacterianos cambiando la reacción de la orina cada 10-14 días. Los alimentos alcalinizantes, el citrato de sodio (10 g por día), las aguas minerales alcalinas ayudan a reducir las reacciones de pH. Cierta acción antibacteriana tiene el benzoato de sodio (4-6 g por día), que abunda en los arándanos y las gayubas. La terapia patogenética debe tener como objetivo aumentar la reactividad del cuerpo, mejorar el flujo de orina y normalizar la presión arterial. Para activar la reactividad inmunobiológica, se utilizan α-globulina, autohemoterapia, transfusión de sangre, terapia con vacunas (el tratamiento con autovacunas se realiza durante 30-40 días, 0,1 ml por vía subcutánea o 0,2-0,3 ml cada 2 días), toxoide estafilocócico ( 0,1-0,3- 0,5-0,7-1,0-1,2-1,7-2,0 ml cada 3 días). Las hierbas diuréticas (gayuba, bayas de enebro, cola de caballo, hoja de ortosifón - té de riñón, hoja de arándano rojo), antiespasmódicos (papaverina, no-shpa, etc.) ayudan a normalizar el flujo de orina. Si hay una obstrucción al flujo de orina, está indicado el tratamiento quirúrgico. Con hipertensión concomitante, están indicadas las preparaciones de rauwolfia: isobarina, dopegyt, hemiton, saluréticos, antagonistas de la aldosterona. Prevención y pronóstico. La prevención de la pielonefritis consiste en medidas primarias y secundarias. La prevención primaria incluye, en primer lugar, el tratamiento de enfermedades que pueden conducir al desarrollo de pielonefritis: infecciones focales, enfermedades urológicas (como urolitiasis, adenoma de próstata, así como cualquier enfermedad acompañada de una violación de la salida de orina de la riñón), actividades recreativas. Tabla 12 Eficacia comparativa de fármacos antibacterianos en pielonefritis
La prevención secundaria incluye la detección de bacteriuria durante los exámenes preventivos (por ejemplo, las mujeres embarazadas deben realizar un análisis bacteriológico de la orina al menos una vez al mes), el nombramiento del tratamiento contra las recaídas: la primera semana de cada mes, una pausa en el tratamiento: decocción de rosa mosqueta, la segunda, tercera semana - diuréticos y antisépticos a base de hierbas, la cuarta semana - agentes antibacterianos (nitrofuranos, antibióticos, antisépticos, una vez al año - nevigramon 1 g 1 veces durante la semana y 1,0 g - durante la segunda semana, o 4 -NOC 2-5 mg 100 veces al día 150-4 días). El tratamiento anti-recaída se lleva a cabo durante 2-3 años. Los exámenes de dispensario con tratamiento deben realizarse 3-4 veces al año o 4-6 veces. Pronóstico. El pronóstico depende del estadio de la enfermedad. Tratamiento de sanatorio. El tratamiento en un sanatorio está indicado durante el período de remisión, especialmente para pacientes con pielonefritis calculosa secundaria después de operaciones urológicas (aguas minerales Truskavets, Sairme, Zheleznovodsk, Berezovsky), donde los pacientes toman aguas poco mineralizadas. El tratamiento de sanatorio y spa está contraindicado en caso de hipertensión alta, anemia grave e insuficiencia renal evidente. Las complicaciones de la pielonefritis son variadas. En la pielonefritis aguda, la progresión del proceso purulento conduce a la fusión de grandes abscesos y la formación de un carbunco del riñón, la comunicación de cavidades purulentas con la pelvis (pionefrosis), la transición del proceso a una cápsula fibrosa (perinefritis ) y tejido perirrenal (paranefritis). La pielonefritis aguda puede complicarse con necrosis de las papilas de las pirámides (papilonekrosis), que se desarrolla como resultado del efecto tóxico directo de las bacterias en condiciones de estasis urinaria. Esta complicación de la pielonefritis ocurre en la mayoría de los casos en pacientes con diabetes. En raras ocasiones, la pielonefritis se convierte en una fuente de sepsis. Con la restricción del proceso purulento durante el período de cicatrización, se pueden formar abscesos rodeados por una membrana piógena (absceso renal crónico). En la pielonefritis crónica, especialmente unilateral, es posible desarrollar hipertensión nefrogénica y arteriolosclerosis en el segundo riñón (intacto). Las arrugas pielonefríticas bilaterales de los riñones conducen a insuficiencia renal crónica. El resultado de la pielonefritis aguda suele ser la recuperación, pero como resultado de complicaciones (pionefrosis, sepsis, papilonecrosis), puede ocurrir la muerte. La pielonefritis crónica con arrugas en los riñones a menudo termina con azotemia uremia. Con el desarrollo de la hipertensión arterial de origen renal, el desenlace letal en la pielonefritis crónica a veces se asocia con las complicaciones que ocurren en la hipertensión (hemorragia cerebral, infarto de miocardio, etc.). Autor: Mostovaya O.S.
▪ Economía empresarial. Notas de lectura
Máquina para aclarar flores en jardines.
02.05.2024 Microscopio infrarrojo avanzado
02.05.2024 Trampa de aire para insectos.
01.05.2024
▪ Los relojes atómicos confirman la teoría de la relatividad ▪ El sensor de movimiento Philips Hue controla las luces
▪ Sección del sitio Electricista en la casa. Selección de artículos ▪ artículo La insoportable levedad del ser. expresión popular ▪ artículo ¿Qué es la fobia social? Respuesta detallada ▪ artículo Meseta de Putorana. Milagro de la naturaleza
Hogar | Biblioteca | Artículos | Mapa del sitio | Revisiones del sitio www.diagrama.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








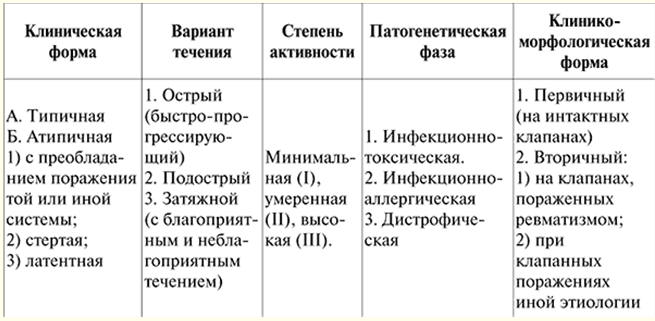








 Ver otros artículos sección
Ver otros artículos sección 