
|
|
Notas de clase, hojas de trucos
Anestesiología y reanimación. Apuntes de clase: brevemente, los más importantes
Directorio / Notas de clase, hojas de trucos tabla de contenidos
Conferencia número 1. El concepto de reanimación La reanimación es una rama de la medicina clínica que estudia los problemas de revitalización del cuerpo, desarrollando principios para la prevención de condiciones terminales, métodos de reanimación y cuidados intensivos. Los métodos prácticos para revitalizar el cuerpo están unidos por el concepto de "resucitación". La reanimación (del latín "renacimiento" o "animación") es un sistema de medidas destinadas a restaurar las funciones vitales del cuerpo gravemente dañadas o perdidas y sacarlo de un estado terminal y muerte clínica. Las medidas de reanimación efectivas son el masaje cardíaco indirecto y la ventilación artificial de los pulmones. Si son ineficaces dentro de los 30 minutos, se determina la muerte biológica. Los cuidados intensivos son un conjunto de medidas utilizadas para tratar condiciones graves que amenazan la vida e implican el uso de una amplia gama de medidas terapéuticas, según las indicaciones, que incluyen infusiones intravenosas, ventilación artificial prolongada de los pulmones, marcapasos, métodos de diálisis, etc. Un estado crítico es la imposibilidad de mantener la integridad de las funciones corporales como resultado de una disfunción aguda de un órgano o sistema, que requiere reemplazo de medicamentos o hardware-instrumental. El estado terminal es un estado límite entre la vida y la muerte, una extinción reversible de las funciones corporales, incluidas las etapas de preagonía, agonía y muerte clínica. La muerte clínica es una condición terminal en la que no hay circulación sanguínea ni respiración, se detiene la actividad de la corteza cerebral, pero se conservan los procesos metabólicos. Con la muerte clínica, queda la posibilidad de una reanimación eficaz. La duración de la muerte clínica es de 5 a 6 minutos. La muerte biológica es el cese irreversible de procesos fisiológicos en órganos y tejidos, en los que la reanimación es imposible. Se establece por una combinación de una serie de signos: la ausencia de movimientos espontáneos, contracciones del corazón y pulso en las grandes arterias, respiración, reacciones a estímulos dolorosos, reflejo corneal, dilatación máxima de la pupila y ausencia de su reacción a la luz. Los signos confiables del inicio de la muerte son una disminución de la temperatura corporal a 20 ° C, la aparición de manchas cadavéricas y el rigor mortis muscular. Conferencia número 2. Manipulaciones básicas en cuidados intensivos. Punción percutánea y cateterismo de la vena principal (subclavia). Indicaciones: grandes volúmenes de terapia de infusión-transfusión, nutrición parenteral, terapia de desintoxicación, terapia antibiótica intravenosa, sondeo y contraste del corazón, medición de PVC, implantación de marcapasos, imposibilidad de cateterismo de venas periféricas. Contraindicaciones: violación del sistema de coagulación sanguínea, proceso inflamatorio y purulento en el sitio de punción y cateterismo, trauma en la clavícula, síndrome de la vena cava superior, síndrome de Paget-Schretter. Instrumental y accesorios para punción y cateterismo: aguja de punción, juego de catéteres de plástico, juego de conductores, jeringa de 10 ml para inyecciones intramusculares, tijeras, portaagujas, aguja quirúrgica y ligadura de seda, esparadrapo. Técnica. El cateterismo se realiza respetando las normas de asepsia y antisepsia, el tratamiento de las manos del operador, el campo operatorio y la aplicación de material estéril. La posición del paciente es horizontal sobre la espalda con los brazos llevados al cuerpo y la solapa de la cabeza en sentido contrario. Se usa anestesia local: solución de novocaína al 0,5-1%. La punción se realiza mejor a la derecha, ya que al pinchar la vena subclavia izquierda, existe el peligro de dañar el conducto linfático torácico. Punto de punción: en el borde del tercio interno y medio de la clavícula, 2 cm por debajo. La aguja se pasa lentamente en un ángulo de 45° a la clavícula y de 30 a 40° a la superficie del tórax entre la clavícula y la primera costilla en dirección al borde superior de la articulación esternoclavicular. Al pasar la aguja, periódicamente se aprieta el émbolo de la jeringa para determinar si entra en la vena, y se inyecta novocaína a lo largo de la aguja. Al perforar una vena, a veces hay una sensación de fracaso. Después de ingresar a la vena, la jeringa se desconecta de la aguja y la cánula se cierra con un dedo. Luego se inserta un conductor a través de la aguja hasta una longitud de 15-20 cm y se retira la aguja. Se pasa un catéter del diámetro apropiado a través del conductor y, junto con el conductor, se inserta en la vena de 6 a 8 cm, después de lo cual se retira cuidadosamente el conductor. Para verificar la posición correcta del catéter, se le conecta una jeringa y se extraen 2-3 ml de sangre, luego se coloca un tapón o se inicia la terapia de infusión. El catéter se fija con una ligadura de seda a la piel. Para hacer esto, se hace una manga de yeso adhesivo en el catéter a 3-5 mm de la piel, sobre la cual se ata la seda, luego se pasa por las orejas del catéter y se ata nuevamente. Después de fijar el catéter, el sitio de punción se cierra con una pegatina aséptica. Complicaciones: punción de la arteria subclavia, embolia gaseosa, punción de la cavidad pleural, daño del plexo braquial, daño del conducto linfático torácico, daño de la tráquea, bocio y glándula tiroides, supuración en el sitio de punción. 1. Traqueotomía Indicaciones: obstrucción de laringe y tráquea superior por obstrucción por tumor o cuerpo extraño, parálisis y espasmo de cuerdas vocales, tumefacción severa de laringe, dificultad respiratoria aguda, aspiración de vómito, prevención de asfixia en traumatismos torácicos severos. Herramientas: 2 bisturís, 2 pinzas anatómicas y quirúrgicas, varias pinzas hemostáticas, un elevador, una sonda estriada, 2 ganchos romos y 1 afilado de un solo diente, dilatador de Trousseau o Deschamps, agujas quirúrgicas con portaagujas. Técnica El paciente se acuesta boca arriba, un rodillo debajo de los hombros, la cabeza echada hacia atrás. Si el paciente se encuentra en estado de asfixia, el rodillo se coloca solo en el último momento, antes de abrir la tráquea. La anestesia por infiltración local se realiza con una solución de novocaína al 0,5-1% con la adición de adrenalina. En asfixia aguda, es posible operar sin anestesia. Puntos de identificación: el ángulo del cartílago tiroides y el tubérculo del arco del cartílago cricoides. Se hace una incisión de la piel, el tejido subcutáneo y la fascia superficial desde el borde inferior del cartílago tiroides hasta la muesca yugular estrictamente a lo largo de la línea media del cuello. Se retrae o liga la vena mediana del cuello, encontrando una línea blanca, a lo largo de la cual se separan los músculos de forma roma y se expone el istmo de la glándula tiroides. Los bordes de la incisión se separan con un dilatador de Trousseau, se aplican ligaduras al borde de la herida y se inserta con cuidado el tubo de traqueotomía, asegurándose de que su extremo entre en la luz de la tráquea. Se sutura la herida quirúrgica. El tubo se fija al cuello del paciente con una férula de gasa, previamente amarrada al protector del tubo. Inserte el tubo interior en el tubo exterior. 2. Conicotomía El paciente se coloca boca arriba con un rodillo transversal al nivel de los omoplatos. La cabeza del paciente está inclinada hacia atrás. Después de tratar la piel de la superficie frontal del cuello con una solución antiséptica, la laringe se fija con los dedos en las superficies laterales del cartílago tiroides y se separa el espacio entre el cartílago tiroides y el cricoides, donde se encuentra el ligamento en forma de cono. sintió. Bajo anestesia local por infiltración con un bisturí puntiagudo, se realiza una incisión transversal en la piel de unos 2 cm de largo, se palpa el ligamento cónico y se diseca o perfora. Cualquier cánula de traqueotomía de diámetro adecuado se inserta en el orificio formado y se fija con una tira de gasa alrededor del cuello. En ausencia de cánula, se puede sustituir por un trozo de tubo de goma o plástico de diámetro y longitud adecuados. Para evitar que este tubo se deslice hacia la tráquea, su extremo exterior se perfora transversalmente a una distancia de 2 cm del borde y se fija con una tira de gasa. El conicotomo es una cánula de traqueotomía de metal de pequeño diámetro con un mandril perforador en su interior. Después de la disección de la piel sobre el ligamento en forma de cono, se perfora con un conicotomo, se retira el mandril y la cánula se coloca en una posición que asegure el libre flujo de aire hacia la tráquea y se fija. En casos extremos, con obstrucción de la entrada a la laringe y una violación aguda de las vías respiratorias, se puede restaurar inyectando 1-2 agujas gruesas con un diámetro interno de 2-2,5 mm en la tráquea a lo largo de la línea media por debajo del nivel de el cartílago tiroides. Las agujas se insertan en un ángulo agudo al eje traqueal, a veces sin anestesia local, a una profundidad de 1-1,5-2 cm. 3. Punción de la cavidad pleural Indicaciones: falta de aire aguda debido a la compresión de los pulmones por un derrame masivo con pleuresía o hidrotórax, así como aire con neumotórax valvular. Técnica La punción se realiza en posición sentada, en condiciones asépticas. Para la anestesia del sitio de punción, se usa una solución de novocaína al 0,5%. Para la punción se utiliza una aguja gruesa conectada a un tubo de goma. La punción se realiza a lo largo del borde superior de la costilla, ya que los vasos intercostales se ubican a lo largo del borde inferior. La penetración de la aguja en la cavidad pleural se siente como un "fallo en el vacío". La aspiración de líquido a lo largo de la aguja confirma que el extremo de la aguja está en la cavidad pleural. Cada vez que se separa una jeringa llena del tubo de goma, este último debe sujetarse con una abrazadera hemostática para evitar que el aire atmosférico sea aspirado hacia la cavidad pleural. Al final de la aspiración, se aplica un vendaje aséptico en el sitio de punción. Complicaciones: lesión de la arteria intercostal, vasos del diafragma del pulmón, punción del estómago o intestinos. Intubación traqueal. Indicaciones: estrechamiento de la laringe, respiración patológica, insuficiencia respiratoria aguda, grado de coma II y III, alto riesgo de aspiración durante intervenciones quirúrgicas en los órganos del tórax y la cavidad abdominal, cabeza y cuello, en enfermedades de la faringe, laringe y tráquea (inflamación aguda, cáncer, tuberculosis, etc.). Se utiliza un laringoscopio para la intubación. Se compone de un mango y una cuchilla. Las palas curvas más utilizadas, ya que son más fisiológicas. Las hojas rectas se utilizan con un cuello largo. La preparación para la intubación incluye el control del equipo y la colocación correcta del paciente. El tubo endotraqueal debe ser revisado. El manguito se prueba inflándolo con una jeringa de 10 ml. Compruebe el contacto de la hoja con el mango del laringoscopio y la bombilla. Es necesario asegurarse de que la succión esté lista en caso de descarga repentina de esputo, sangrado o vómitos. La intubación exitosa depende de la posición correcta del paciente. La cabeza del paciente debe estar al nivel de la apófisis xifoides del intubador. La elevación moderada de la cabeza con extensión simultánea en la articulación atlantooccipital crea una mejor posición para la intubación. La preparación para la intubación también incluye la preoxigenación obligatoria. El laringoscopio se sostiene con la mano no dominante (para la mayoría de las personas, esta es la izquierda) y la boca del paciente se abre completamente con la otra mano. La hoja se inserta a lo largo del lado derecho de la orofaringe, evitando dañar los dientes. La lengua se desplaza hacia la izquierda y la hoja se levanta hasta el arco de la faringe. La punta de una hoja curva se inserta en la vallécula (una fosa ubicada en la superficie anterior de la epiglotis), mientras que la punta de una hoja recta debe levantar la epiglotis directamente. El mango del laringoscopio se empuja hacia arriba y hacia adelante perpendicular a la mandíbula hasta que las cuerdas vocales queden a la vista. Debe evitarse la dependencia de los dientes. El tubo endotraqueal se toma con la mano derecha y se pasa a través de la glotis abierta bajo control visual. El manguito debe colocarse en la parte superior de la tráquea, pero debajo de la laringe. El laringoscopio se retira de la boca, nuevamente evitando dañar los dientes. Inmediatamente después de la intubación, se realiza una auscultación sobre los pulmones en ambos lados (ya que es posible pasar un tubo a un bronquio) y en el epigastrio (para excluir la intubación esofágica). Si el tubo está en la tráquea, se fija en su posición con cintas y se infla el manguito. El manguito debe colocarse por encima del nivel del cartílago cricoides, ya que permanecer mucho tiempo en la laringe puede provocar ronquera en el período posoperatorio. Complicaciones: intubación del esófago, bronquios, ubicación del manguito en la laringe, daño en los dientes, luxación de la mandíbula inferior, laringoespasmo, trastornos reflejos (hipertensión, taquicardia, aumento de la presión intracraneal), traumatismos en las vías respiratorias, inflamación, etc. 4. Punción y cateterismo del espacio epidural Indicaciones: síndrome de dolor severo, intervenciones quirúrgicas, proporcionar analgesia postoperatoria. El nivel de ajuste del bloqueo epidural depende del órgano que se necesite anestesiar. La Tabla No. 1 muestra ejemplos de "órganos diana" para la punción epidural. Tabla 1 Niveles de la columna vertebral y "órganos diana"
Instrumental: agujas para anestesia, aguja especial para punción del espacio epidural, jeringa de muestra, catéter, tapón, bolas filtrantes, servilletas, cinta adhesiva y guantes estériles. La posición del paciente es sentado o acostado de lado. En este caso, las rodillas y el mentón deben estar lo más cerca posible del pecho. Por lo tanto, se crea la máxima flexión de la columna vertebral, en la que aumenta el ángulo entre las apófisis espinosas de las vértebras adyacentes y se facilita el acceso al ligamento amarillo. En condiciones asépticas y bajo anestesia local con una solución de novocaína al 0,5%, se realiza una punción del espacio epidural. La aguja se inyecta de forma estrictamente perpendicular, pero con osteocondrosis, es posible un ángulo de inclinación o durante la punción en la región torácica media. Cuando la aguja ingresa al grosor de los ligamentos, se retira el mandril y se coloca una jeringa con líquido. El avance adicional de la aguja se lleva a cabo lenta y suavemente con presión sobre el émbolo de la jeringa. Debido a la importante resistencia de los ligamentos, el líquido no puede salir de la jeringa. Se desconecta la jeringa y se introduce el catéter 5-7 cm, no debe haber resistencia. Se retira la aguja y se fija la guía a la espalda con esparadrapo, llevándola a la superficie anterior del tórax. El enchufe con el filtro está fijado al conductor. Se inyecta un anestésico. Después de eso, se determina el nivel de anestesia de la piel. Complicaciones: trastornos respiratorios y hemodinámicos, intoxicaciones, daños en la duramadre, complicaciones neurológicas, periduritis. 5. Punción lumbar Indicaciones: presencia de síndrome meníngeo, presión intracraneal elevada, diagnóstico diferencial entre ictus isquémico y hemorrágico, traumatismo craneoencefálico, tumores de la médula espinal. Contraindicaciones: la presencia de un proceso inflamatorio o purulento en el sitio de punción, diátesis hemorrágica, tumor de la fosa craneal posterior, dislocación del tronco, estado terminal del paciente, con límites borrosos del nervio óptico. El punto de punción se encuentra entre la tercera y la cuarta apófisis espinosas de las vértebras lumbares. La manipulación se realiza en condiciones asépticas, bajo anestesia local. La aguja va perpendicular hacia el ombligo. La colocación del paciente es la misma que para la punción epidural. Con el paso de tres ligamentos (interespinoso externo e interno, ligamentos amarillos), hay una sensación de caída, se retira el mandril de la aguja y aparece líquido cefalorraquídeo. Después de tomar el líquido cefalorraquídeo para su examen, se inserta un mandril y se retira la aguja, se aplica una etiqueta aséptica. A diferencia de la punción epidural, se produce daño en la duramadre. El líquido cefalorraquídeo es claro, incoloro, presión 3-4 mm de agua. Art., contenido de proteína 100 g/l, HC - 200-0,33, pH = 1003-1008, contenido de azúcar es igual a la mitad del azúcar en sangre (normalmente 7,35-7,40 mmol/l), cloruros - 2-3 mmol/l, el número de células hasta 110 linfocitos. Complicaciones: epiduritis, dislocación del cerebro en el foramen magnum, trastornos neurológicos. Conferencia No. 3. Trastornos agudos de la conciencia. La conciencia es la forma más alta de reflejo de la realidad, que es un conjunto de procesos mentales que le permiten a una persona navegar en el mundo que lo rodea, el tiempo, su propia personalidad, lo que asegura su comportamiento. Deterioro de la conciencia es el nombre general para los trastornos de la actividad integral del cerebro, expresados en una violación de la capacidad de percibir, comprender y responder adecuadamente al entorno, navegar por él, recordar eventos actuales, establecer contacto verbal y realizar expedientes arbitrarios. actos conductuales. Existen diversas opciones para la depresión de la conciencia (estupor, estupor, coma de diversa profundidad), así como para la confusión aguda (estado delirante o encefalopatía metabólica). El grado de deterioro de la conciencia varía desde una confusión leve hasta un coma, y no hay transiciones claras entre estos estados. En la práctica, el grado de deterioro de la conciencia está determinado por la reacción del paciente a los estímulos. La estupefacción es una forma de deterioro de la conciencia, caracterizada por letargo, ralentización y dificultad en el curso de los procesos mentales, rápido agotamiento de la atención, aumento del umbral para la percepción de estímulos externos, pero manteniendo un contacto verbal limitado. La estupefacción se basa en una violación de la atención, es decir, la capacidad de seleccionar la información necesaria y coordinar las respuestas de tal manera que no se viole la secuencia lógica de pensamientos y acciones. Las causas más comunes de estupor son los trastornos metabólicos y tóxicos, pero en ocasiones también se observa con lesiones focales de la corteza, especialmente del lóbulo parietal derecho. En tales pacientes, es posible lograr una respuesta monosilábica o la implementación de las instrucciones más simples solo después de apelaciones persistentes o estimulación adicional. Con una mayor opresión de la conciencia, se pierde la posibilidad de contacto verbal y se desarrolla el sopor. El sopor es un estado de profunda depresión de la conciencia con la pérdida de la posibilidad de contacto con el paciente, pero la conservación de reacciones defensivas coordinadas y la apertura de los ojos del paciente en respuesta al dolor, sonido u otros estímulos. El paciente no puede despertarse completamente incluso con la ayuda de estímulos dolorosos, yace con los ojos cerrados. La reacción a las instrucciones verbales es débil o está completamente ausente, es imposible obtener una palabra o sonido de respuesta del paciente. Con una mayor opresión de la conciencia, se desarrolla un coma. El coma es un estado de inconsciencia caracterizado por la insensibilidad a los estímulos externos. Este es un estado potencialmente mortal de depresión de las funciones del sistema nervioso central y trastornos de la regulación de las funciones vitales. El coma puede ser causado por muchos trastornos metabólicos diferentes y daño estructural. Fisiopatología del coma Muy a menudo, el coma se debe a: 1) procesos intracraneales con daño al tejido cerebral (hematoma, absceso, tumor, epilepsia); 2) lesiones infecciosas del sistema nervioso central (meningitis, encefalitis); 3) daño tóxico al cerebro (envenenamiento por alcohol, hongos, drogas); 4) insuficiencia del flujo sanguíneo cerebral (consecuencias de la asistolia, ataques de Morgagni-Adams-Stokes); 5) causas metabólicas (alteración del equilibrio hídrico y electrolítico, metabolismo de los hidratos de carbono, equilibrio ácido-base, insuficiencia renal y hepática); 6) trastorno del equilibrio de temperatura (golpe de calor, hipotermia). clasificacion com Según la etiología, se distingue el siguiente coma. 1. Primarias o intracraneales: traumáticas, vasculares, infecciosas, neoplásicas del cerebro, epilépticas, metabólicas e hipóxicas. 2. Secundaria o extracraneal: lesión cerebral grave. Según la gravedad del coma se clasifican de la siguiente forma. 1. Coma moderado, cuando el paciente tiene una reacción a estímulos dolorosos. En respuesta a ellos pueden aparecer movimientos de flexión y extensión. Pero las reacciones motoras protectoras están descoordinadas. El dolor del paciente no abre los ojos. Los reflejos pupilares y corneales suelen estar conservados, los reflejos abdominales están deprimidos y los reflejos tendinosos son variables. Reflejos aumentados de automatismo oral y reflejos podales patológicos. 2. Coma profundo. Se caracteriza por la ausencia de reacciones a cualquier estímulo externo, diversos cambios en el tono muscular, disminución o ausencia de reflejos sin midriasis bilateral, trastornos de la respiración espontánea y de la actividad cardiovascular. 3. El coma terminal está determinado por midriasis fija bilateral, atonía muscular difusa, alteraciones graves de las funciones vitales, trastornos del ritmo y de la frecuencia respiratoria, apnea y taquicardia grave; la presión arterial es crítica o no determinada. Examen de un paciente en coma. El plan de examen del paciente es el siguiente. 1. Valoración del estado funcional de los sistemas respiratorio y cardiovascular. 2. Exámenes clínicos generales, teniendo en cuenta datos de laboratorio, que permitan evaluar patología extracraneal. 3. Exploración neurológica. Estudios de laboratorio: análisis de sangre clínico general (signos de una infección bacteriana o viral); química sanguínea: glucosa, factores de coagulación (tiempo de coagulación, protrombina, fibrinógeno, APTT, antitrombina III, pruebas de paracoagulación, recuento de plaquetas), urea, creatinina, bilirrubina, ALT, AST, osmolaridad, electrolitos (K, Na, Mg, Ca); Cribado toxicológico de sangre, orina, contenido gástrico. Estudios instrumentales: radiografía de cráneo y columna cervical. La consulta de un neuropatólogo (neurocirujano) determina la dirección posterior de la búsqueda de diagnóstico: imágenes por resonancia magnética o computarizada; EEG; dopplerografía ultrasónica. La punción lumbar con análisis de líquido cefalorraquídeo es obligatoria después de: 1) consulta de un oftalmólogo y exclusión de signos de aumento de la presión intracraneal: edema y elevación de los discos ópticos; 2) exclusión de signos de hernia del cerebro. Se distinguen las siguientes localizaciones de la hernia del cerebro. Hernia diencefálica, que se produce cuando se lesiona la localización supratentorial medial y consiste en el desplazamiento del diencéfalo a través de la escotadura de la espiga cerebelosa. Este proceso llama: 1) respiración de Cheyne-Stokes; 2) constricción de las pupilas manteniendo su reacción a la luz; 3) parálisis de la mirada hacia arriba; 4) cambios en el estado mental. La herniación de las partes mediales del lóbulo temporal, que ocurre cuando se afecta la localización supratentorial lateral, consiste en el desplazamiento de las partes mediales del lóbulo temporal a través de la escotadura de la espiga cerebelosa. La presión resultante sobre las estructuras del mesencéfalo se manifiesta por: 1) alteración de la conciencia; 2) una pupila agrandada, no reactiva en el lado de la hernia, que se asocia con la compresión del nervio craneal III; 3) hemiparesia del lado opuesto. Los movimientos de los globos oculares no siempre están perturbados. Hernia de las amígdalas del cerebelo, que es causada por la presión que empuja la parte inferior del cerebelo a través del agujero magno, lo que lleva a la compresión del bulbo raquídeo. Causa: 1) alteración de la conciencia; 2) violaciones del ritmo de la respiración o apnea. tratamiento El tratamiento debe ser lo más agresivo posible y debe estar dirigido principalmente a asegurar una adecuada oxigenación y estabilización de la hemodinámica central. Si se mantiene la respiración espontánea, se recomienda la insuflación de oxígeno humidificado a través de una máscara o catéter nasal. En ausencia de respiración espontánea o en presencia de respiración patológica, se realiza intubación traqueal y se transfiere al paciente a ventilación pulmonar artificial. Con agitación psicomotora y reacción a la ventilación mecánica, es necesario el uso de sedantes (benzodiazepinas, butirofenonas). La estabilización de la hemodinámica central es la normalización de la presión arterial. En un estado hipertenso, la presión arterial debe reducirse, pero no más del 10% del original por hora. Un buen efecto es el uso de nitroprusiato de sodio o sulfato de magnesio. Con hipotensión, se usan dopamina, dopamina, dobutrex y medicamentos hormonales. En ausencia de datos anamnésticos y un diagnóstico poco claro, se realiza terapia ex juvantibus (una respuesta positiva a la exposición al fármaco, por un lado, da la clave del diagnóstico, por otro lado, ayuda a ganar tiempo para evitar cambios irreversibles). ): 1) tiamina - 100 mg por vía intravenosa, posteriormente - 100 mg por vía intramuscular (especialmente si hay antecedentes de alcoholismo, al determinar altas concentraciones de etanol en la sangre); 2) glucosa: una solución al 40% de 60 ml por vía intravenosa (con un nivel desconocido de glucosa en plasma o en un nivel inferior a 3 mmol / l); 3) naloxona: 0,4-1,2 mg por vía intravenosa, fraccionada, repetidamente, especialmente en presencia de "signos de opiáceos" (rastros de inyecciones intravenosas, pupilas estrechas, trastornos respiratorios centrales); 4) anexat (flumazenil) - 0,2 mg durante 30 segundos, durante el siguiente minuto, inyecte otros 0,3 mg, durante cada minuto siguiente - 0,5 mg hasta una dosis total de 3 mg. En ausencia de un efecto, se puede suponer que es poco probable que el coma sea causado por benzodiazepinas; 5) en caso de intoxicación o sobredosis con una droga o sustancia conocida, se debe administrar un antídoto apropiado (si existe la posibilidad de terapia con antídoto). control de convulsiones. La hipoxia cerebral entrante puede causar estado epiléptico. Los episodios de convulsiones también pueden deberse a la toxicidad de los fármacos anticolinesterásicos. Para el tratamiento, el fármaco de elección son las benzodiazepinas: midazolam (Dormikum) 5 mg por vía intravenosa en fracciones hasta una dosis total de 30 mg g, seduxen (Relanium) en fracciones de hasta 10 mg, por vía intravenosa. Con el desarrollo del estado epiléptico, después de las benzodiazepinas, es necesario administrar fenitoína en una dosis total de 1 a 1,5 g a una velocidad de 50 mg/min. Si hay resistencia a estos fármacos, es necesario administrar fenobarbital (tiopental) en una dosis total de hasta 1000 mg mediante infusión intravenosa lenta (es necesario controlar la respiración y la presión arterial). Para las convulsiones recurrentes, es necesaria anestesia general. En pacientes con signos de EEG o tomografía computarizada de un foco epiléptico (hemorragia, neoplasia, infarto isquémico grande, absceso, etc.) y ataques epilépticos episódicos, se requiere terapia de mantenimiento con fenitoína: 300 mg una vez al día por vía oral. Mantener la normotermia. Es necesario controlar la temperatura rectal: su descenso por debajo de 34 °C se desarrolla con hipotermia, sobredosis de somníferos y sedantes, hipotiroidismo y enfermedad de Wernicke. En estos casos, es necesario calentar gradualmente al paciente hasta una temperatura de 36 °C. Los pacientes con hipotermia y falta de funciones vitales están sujetos a RCP, ya que la baja temperatura reduce la demanda de oxígeno en el corazón y el cerebro y contribuye a un mejor resultado de las medidas de reanimación (excepto en los casos acompañados de hiperpotasemia). La presencia de fiebre en pacientes comatosos requiere una búsqueda activa y tratamiento de complicaciones infecciosas. La presencia de signos de meningismo puede indicar la presencia de meningitis bacteriana o hemorragia subaracnoidea (aunque deben pasar aproximadamente 12 horas desde el inicio del sangrado hasta la irritación meníngea química). Otra causa de fiebre puede ser un absceso intracraneal o un hematoma subdural. Si se sospecha meningitis bacteriana, se debe realizar una punción lumbar (análisis del líquido cefalorraquídeo) y una tomografía computarizada para determinar signos de aumento de la presión intracraneal. Prevención de la aspiración del contenido gástrico.. La necesidad de lavado gástrico en caso de intoxicación y sobredosis de fármacos y, por tanto, la instalación de una sonda gástrica aumenta el riesgo de regurgitación del contenido gástrico (por relajación del esfínter gastroesofágico). Por tanto, antes de insertar una sonda gástrica, es necesario realizar una intubación traqueal con manguito sellador, que es el mejor medio para proteger las vías respiratorias. Tratamiento urológico. Para controlar la diuresis es necesario instalar una sonda de Foley, asegurar condiciones asépticas y realizar terapia antimicrobiana para prevenir la sepsis urogenital. Presión intracraneal reducida. El aumento de la PIC es una emergencia clínica que requiere la implementación de medidas adecuadas encaminadas a reducirla, lo que evita daños secundarios al cerebro por compresión de sus tejidos o disminución del flujo sanguíneo cerebral. La realización de las medidas de diagnóstico anteriores permite establecer las causas del aumento de la PIC y, en consecuencia, las medidas clave están dirigidas a su eliminación (tratamiento operativo y conservador). Hiperventilación para mantener los niveles de pCO.2 25-30 mmHg Arte. (los niveles inferiores a 25 mm Hg pueden causar una disminución significativa del flujo sanguíneo cerebral, lo que lleva a una isquemia cerebral). Restricción de la ingesta de líquidos. Es necesario excluir las soluciones que contienen agua libre (5% de glucosa). La solución isotónica de NaCl, necesaria para mantener la osmolaridad sanguínea, debe administrarse a la mitad de la dosis. Introducción de sustancias osmóticamente activas. Se administra manitol a dosis de 1 a 2 g/kg durante 10 a 20 minutos y luego a dosis de mantenimiento de 0,05 a 0,3 g/kg cada 6 horas, adicionalmente se administra furosemida para reducir de manera más efectiva la PIC. Es necesario un control estricto de la terapia para prevenir complicaciones: disminución del volumen intravascular, hipotensión, hipernatremia, hipocalcemia, hipopotasemia, así como un síndrome de respuesta y ruptura de las venas corticales en el hematoma subdural. Una medida importante para prevenir complicaciones es mantener la presión arterial sistólica entre 100 y 110 mm Hg. Arte. Los medicamentos también conducen a una disminución de la PIC. El uso de relajantes musculares ayuda a reducir la PIC durante la ventilación mecánica (bloqueo del aumento de la presión venosa intratorácica durante la ventilación mecánica), pero se recomiendan solo por un tiempo muy corto. El uso de corticoides es eficaz en casos de aumento de la presión intracraneal por neoplasia o isquemia focal (ictus) del cerebro. No se ha demostrado la eficacia de los corticoides en el tratamiento del aumento de la presión intracraneal debido a traumatismos e isquemia cerebral general. Es importante recordar que los glucocorticoides pueden provocar un aumento de los niveles de glucosa en sangre y, en consecuencia, aumentar la isquemia cerebral. tipos de com El coma hipoglucémico ocurre con una sobredosis de insulina en el tratamiento de la diabetes mellitus o con la restricción de la ingesta de carbohidratos. El desarrollo del coma está precedido por bulimia, irritabilidad, miedo. A veces se notan diplopía, alucinaciones, convulsiones tónicas y clónicas. La excitación es reemplazada por adinamia y viceversa. El paciente pierde rápidamente el conocimiento y está cubierto de sudor. La piel está húmeda y pálida, la respiración es superficial, rítmica. A veces se observa hipoglucemia espontánea en atletas y después de un gran esfuerzo físico. Si el coma hipoglucémico dura más de 3 horas, es posible el desarrollo de lesiones orgánicas macroscópicas del sistema nervioso central. Es importante reducir el nivel de azúcar en la sangre por debajo de 3 mmol. No hay azúcar ni acetona en la orina. Tratamiento. Inmediatamente ingrese glucosa al 20-40% a una dosis de 20-30 ml por vía intravenosa como bolo. Después de eso, se lleva a cabo el control de azúcar en sangre y orina. Coma diabético, o hiperglucémico, cuando el nivel de glucosa en sangre aumenta bruscamente. El coma está precedido por somnolencia, sed, anorexia, náuseas, vómitos, dolor de cabeza. La hiperglucemia, la acidosis metabólica se determinan en el laboratorio, el azúcar y la acetona están presentes en la orina (no siempre). La cara está pálida e hiperémica, las mucosas están secas, la piel también está seca y su turgencia está reducida. Los globos oculares están hundidos, es posible el olor a acetona de la boca. La respiración es rara patológica. Se altera la hemodinámica: taquicardia, hipotensión arterial, sonidos cardíacos apagados. Tratamiento. Eliminación de hipovolemia con la ayuda de la administración intravenosa de cloruro de sodio en un volumen de 3-5 litros por día. La terapia con insulina consiste en la introducción de insulina de acción corta 6-10 UI por hora con una bomba de infusión. Con una disminución de la glucosa en sangre a 11-13 mmol / l, la dosis de insulina se reduce a 4-8 unidades por hora y comienza una infusión de glucosa al 5% para evitar un estado hipoglucémico. El coma tirotóxico es raro, pero debe considerarse si, con taquicardia severa, no hay signos típicos de insuficiencia miocárdica hemodinámica y hay insuficiencia cardíaca energéticamente dinámica. La presencia de struma, deslumbramiento ocular y temblor suele también llamar la atención sobre esta posibilidad. El cuadro clínico debe complementarse con la recogida de datos anamnésticos, ya que no se pueden realizar estudios que confirmen el diagnóstico (metabolismo basal, yodo radiactivo). La intoxicación por alcohol se manifiesta por el olor a alcohol de la boca, estado delirante, ansiedad, vómitos y cara hinchada. La respiración es lenta, el pulso se acelera, las pupilas se dilatan. En pacientes con alcoholismo, el delirio se desarrolla 2-3 días después de la abstinencia de alcohol. El desarrollo del delirio se previene con el uso de benzodiazepinas cuando aparecen signos de alarma (fiebre, temblor, taquicardia, hipertensión). Ante el desarrollo del delirio, los fármacos de elección son: en jóvenes, diazepam (administración intravenosa), y en ancianos y pacientes con función hepática alterada, lorazepam, pero si es necesario, es preferible un efecto rápido al diazepam (5 mg cada 5 minutos hasta lograr el efecto). Se describen casos de necesidad de administrar 2640 mg de diazepam para el tratamiento de un estado delirante severo. Además, se utilizan bloqueadores y clonidina. También en estas condiciones es útil el uso de antipsicóticos (haloperidol, droperidol). Con coma apopléjico (se desarrolla con varios procesos intracerebrales), el síntoma principal es hemiplejia o parálisis de grupos musculares individuales. La parálisis aparece cuando los ojos y la cabeza se giran en sentido contrario al paralizado: "el paciente mira la lesión en el cerebro". La boca está sesgada hacia el lado sano: "fumar en pipa del lado enfermo". En el lado hemipléjico, la extremidad elevada cae rápida y pesadamente sobre la cama, mientras que la extremidad no afectada vuelve lentamente a su posición original. El coma con la enfermedad de Addison (coma suprarrenal, que a menudo se desarrolla con tuberculosis suprarrenal, trauma, enfermedades infecciosas) es raro. El síntoma principal es una presión arterial patológicamente baja, a menudo imposible de medir. Junto con el colapso, este síntoma es causado por cambios en el metabolismo de los carbohidratos (hipoglucemia), desequilibrio electrolítico y metabolismo del agua. De repente hay una palidez aguda, sudor frío. La excitación se reemplaza rápidamente por adinamia, luego el paciente pierde el conocimiento. Aparece acrocianosis, la piel se vuelve marmórea. En la piel de la espalda y las extremidades, la pigmentación se encuentra en forma de manchas oscuras y una erupción petequial de color rojo brillante. Los sonidos del corazón están amortiguados. La deshidratación y la oliguria aparecen rápidamente. En sangre, acidosis metabólica, hipoglucemia y aumento del nitrógeno residual. El tratamiento consiste en la introducción rápida de glucocorticoides a la dosis de 1 mg/kg. La dosis se puede aumentar en 2-3 veces. Una dosis similar se administra por vía intramuscular. Para combatir la deshidratación se administra una solución isotónica de cloruro de sodio y luego glucosa. Conferencia número 4. Reanimación cardiopulmonar La reanimación cardiopulmonar (RCP) es un complejo de medidas quirúrgicas y terapéuticas realizadas en ausencia de lesiones que pongan en peligro la vida y destinadas a restaurar y apoyar la función del sistema cardiorrespiratorio. Indicaciones de reanimación cardiopulmonar: se realiza en pacientes sin pulso efectivo en las arterias carótidas o pulso filiforme y débil, que están inconscientes y/o en ausencia de movimientos respiratorios efectivos. Los casos más comunes de paro cardíaco primario, así como insuficiencia respiratoria primaria. Contraindicaciones: traumatismos incompatibles con la vida, estadios terminales de enfermedades incurables y muerte biológica. Principios básicos Los esfuerzos primarios en RCP están dirigidos a: 1) compresión torácica; 2) soplar aire en los pulmones y ventilación; 3) preparación y administración de medicamentos; 4) instalación y mantenimiento de acceso intravenoso; 5) actividades especializadas (desfibrilación, instalación de marcapasos, intubación traqueal). Por lo tanto, para completar el alcance completo de las actividades, se necesitan 4 personas y un líder de equipo. Una persona debe estar a cargo de la RCP. Esta persona debe integrar toda la información disponible y priorizar el impacto. Debe monitorear el monitor de ECG, el uso de drogas y asegurarse de que se corrijan las acciones de otros miembros del equipo. Debe ser apartado de la realización de procedimientos que desvirtúen el rol de liderazgo. Durante más de 40 años, el alfabeto de reanimación Safar se ha utilizado para la RCP. En este complejo se sustenta la secuencia de acciones del resucitador, según su nombre en inglés, se indican con las letras correspondientes. A - Vía aérea: asegurando la permeabilidad de la vía aérea. B - Respiración - ventilación pulmonar artificial (ALV) de forma accesible, por ejemplo, al respirar "boca a boca". C - Circulación - asegurar la hemocirculación - masaje cardíaco indirecto. D - Drogas - la introducción de drogas. E - Electrocardiografía - Registro de ECG. F - Fibrilación - realización, si es necesario, desfibrilación eléctrica (cardioversión). G - Calibración - evaluación de resultados primarios. H - Hipotermia - enfriamiento de la cabeza. I - Cuidados intensivos - cuidados intensivos para síndromes posteriores a la reanimación. A - Vía aérea - manejo de la vía aérea El paciente se coloca horizontalmente sobre su espalda. La cabeza se echa hacia atrás tanto como sea posible, para esto el médico coloca una mano debajo del cuello, la otra se coloca en la frente del paciente; se toma una respiración de prueba de boca a boca. Si un paciente con tono muscular reducido se acuesta boca arriba, su lengua puede hundirse, como si estuviera taponando la garganta. Al mismo tiempo, la epiglotis desciende, obstruyendo aún más las vías respiratorias. Aparece: respiración sonora, luego violaciones del ritmo respiratorio hasta su parada completa. Estos fenómenos se desarrollan con especial rapidez en pacientes inconscientes. Para prevenir y eliminar la retracción de la lengua, se debe adelantar la mandíbula inferior y al mismo tiempo se debe realizar una hiperextensión en la articulación occipito-cervical. Para hacer esto, con la presión de los pulgares en el mentón, la mandíbula inferior del paciente se desplaza hacia abajo y luego, con los dedos colocados en las esquinas de la mandíbula, la empujan hacia adelante, complementando esta técnica con una sobreextensión de la cabeza. posteriormente (técnica triple Safar). Con la realización correcta y oportuna de estas manipulaciones, la permeabilidad de las vías respiratorias al nivel de la faringe se restablece rápidamente. Los cuerpos extraños (coágulos de sangre, mocos, prótesis dentales, etc.) pueden ser la causa de la obstrucción de las vías respiratorias. Se eliminan rápidamente con cualquier material improvisado (servilleta, pañuelo). La cabeza del paciente debe girarse hacia un lado debido al peligro de aspiración. La restauración de la permeabilidad del tracto respiratorio superior se facilita mediante el uso de varios conductos de aire. Lo más adecuado es el uso de un conducto en forma de S. Para su introducción, se abre la boca del paciente con los dedos cruzados II e I, y se avanza el tubo hasta la raíz de la lengua para que su apertura se “deslice” a lo largo del paladar. Se debe tener cuidado para asegurarse de que el conducto de aire no se mueva durante el transporte. Si todos los procedimientos descritos no son efectivos, entonces podemos suponer la presencia de obturación de las vías aéreas en las secciones subyacentes. En estos casos se requiere laringoscopia directa y aspiración activa de la secreción patológica, seguida de intubación traqueal durante 10-15 segundos. Es recomendable realizar conicotomía y traqueotomía. B - Respiración - ventilación pulmonar artificial (ALV) de forma accesible El método más simple y efectivo de respiración artificial durante la reanimación es el método de "boca a boca", cuando el aire exhalado por el reanimador se sopla hacia los pulmones de la víctima bajo presión. Habiendo echado hacia atrás la cabeza de la víctima, con una mano le pellizcan las fosas nasales, colocan la otra mano debajo de su cuello, respiran profundamente, presionando con fuerza sus labios contra los labios de la víctima (en niños, a los labios y al nariz al mismo tiempo) y sople aire en los pulmones de la víctima, observando la elevación del tórax durante el tiempo de inhalación. Tan pronto como el pecho se eleva, se detiene la inyección de aire, mueven la cara hacia un lado, vuelven a respirar profundamente y el paciente en este momento tiene una exhalación pasiva. Después de 2-3 inflaciones de los pulmones, se determina la presencia de un pulso en la arteria carótida, si no se detecta, se procede a la restauración artificial de la circulación sanguínea. Se utiliza ventilación manual mediante una bolsa autoexpandible tipo Ambu. Cuando se usa un ventilador, la frecuencia respiratoria es de 12 a 15 por minuto, el volumen inspiratorio es de 0,5 a 1,0 litros. En un hospital, se realiza una intubación traqueal y se transfiere al paciente a un ventilador. C-Circulación - asegurar la hemocirculación - masaje cardiaco indirecto El masaje cardíaco cerrado es la forma más simple y eficiente de soporte circulatorio artificial de emergencia. El masaje cardíaco cerrado debe iniciarse de inmediato, tan pronto como se haga el diagnóstico de paro circulatorio agudo, sin aclarar sus causas y mecanismos. En casos de contracciones cardíacas ineficaces, no se debe esperar un paro cardíaco completo o una restauración independiente de la actividad cardíaca adecuada. Reglas básicas para el masaje a corazón cerrado. 1. El paciente debe estar en posición horizontal sobre una base sólida (piso o camilla baja) para evitar la posibilidad de desplazamiento de su cuerpo bajo el fortalecimiento de las manos masajeadoras. 2. La zona de aplicación de la fuerza de las manos del resucitador está ubicada en el tercio inferior del esternón, estrictamente a lo largo de la línea media; el resucitador puede estar a ambos lados del paciente. 3. Para el masaje, se coloca una palma sobre la otra y se aplica presión sobre el esternón en el área ubicada 3-4 dedos transversales por encima del lugar de unión al esternón del proceso xifoides; las manos del masajista, estiradas en las articulaciones de los codos, se colocan de manera que sólo la muñeca ejerza presión. 4. La compresión del tórax de la víctima se realiza debido a la gravedad del torso del médico. El desplazamiento del esternón hacia la columna (es decir, la profundidad de la desviación del tórax) debe ser de 4 a 6 cm. 5. La duración de una compresión torácica es de 0,5 s, el intervalo entre compresiones individuales es de 0,5-1 s. Tasa de masaje - 60 movimientos de masaje por minuto. En intervalos, las manos no se retiran del esternón, los dedos permanecen levantados, los brazos están completamente extendidos en las articulaciones de los codos. Cuando la reanimación la realiza una sola persona, tras dos inyecciones rápidas de aire en los pulmones del paciente, se realizan 15 compresiones torácicas, es decir, la relación "ventilación:masaje" es de 2:15. Si en la reanimación intervienen 2 personas, entonces esta relación es de 1:5, es decir, hay 5 compresiones torácicas por respiración. Un requisito previo para el masaje cardíaco es el control constante de su eficacia. Los criterios para la efectividad del masaje deben considerarse de la siguiente manera. 1. Cambio en el color de la piel: se vuelve menos pálida, gris, cianótica. 2. Constricción de las pupilas, si estuvieran dilatadas, con apariencia de reacción a la luz. 3. La aparición de un impulso de pulso en las arterias carótida y femoral, ya veces en la arteria radial. 4. Determinación de la presión arterial al nivel de 60-70 mm Hg. Arte. cuando se mide en el hombro. 5. A veces la aparición de movimientos respiratorios independientes. Si hay signos de restauración de la circulación sanguínea, pero en ausencia de una tendencia a preservar la actividad cardíaca independiente, se realiza un masaje cardíaco hasta que se logre el efecto deseado (restauración del flujo sanguíneo efectivo) o hasta que los signos de vida desaparezcan permanentemente. con el desarrollo de síntomas de muerte cerebral. En ausencia de signos de restauración, incluso del flujo sanguíneo reducido, a pesar del masaje cardíaco durante 25 a 30 minutos, se debe reconocer que el paciente está muriendo y se pueden detener las medidas de reanimación. D - Drogas - administración de Drogas En caso de cese agudo de la circulación sanguínea, la introducción de agentes que estimulen la actividad cardíaca debe comenzar lo antes posible, si es necesario, repetirse durante la reanimación. Después del inicio del masaje cardíaco, se debe administrar lo antes posible 0,5-1 ml de adrenalina (por vía intravenosa o intratraqueal). Son posibles sus introducciones repetidas después de 2-5 minutos (hasta 5-6 ml en total). Con la asistolia, la adrenalina tonifica el miocardio y ayuda a "encender" el corazón, con la fibrilación ventricular contribuye a la transición de la fibrilación de onda pequeña a la de onda grande, lo que facilita enormemente la desfibrilación. La adrenalina facilita el flujo sanguíneo coronario y aumenta la contractilidad del músculo cardíaco. En lugar de epinefrina, se puede usar isodrin, que es 3 veces más efectiva que la adrenalina en términos de efectividad del efecto sobre el miocardio. La dosis inicial es de 1-2 ml por vía intravenosa y la siguiente de 1-2 ml en 250 ml de una solución de glucosa al 5%. En condiciones de alteración de la circulación sanguínea, la acidosis metabólica aumenta progresivamente, por lo tanto, inmediatamente después de la infusión de adrenalina, se administra por vía intravenosa una solución de bicarbonato de sodio al 4-5% a razón de 3 ml / kg del peso corporal del paciente. En el proceso de morir, el tono del sistema nervioso parasimpático aumenta significativamente, el cerebro se agota, por lo tanto, se usan colinolíticos M. Con asistolia y bradicardia, la atropina se administra por vía intravenosa en una solución al 0,1%: 0,5-1 ml, hasta una dosis máxima de 3-4 ml. Para aumentar el tono miocárdico y reducir el efecto de la hiperpotasemia, se recomienda la administración intravenosa de 5 ml de una solución de cloruro de calcio al 10%. La adrenalina, la atropina y el cloruro de calcio se pueden administrar juntos en la misma jeringa. Con taquicardia severa y especialmente con el desarrollo de fibrilación, está indicado el uso de lidocaína a una dosis de 60-80 mg, pero como es de acción corta, se infunde a razón de 2 mg/min. También está indicado el uso de glucocorticoides que, al aumentar la sensibilidad de las estructuras miocárdicas adrenorreactivas a las catecolaminas y normalizar la permeabilidad de las membranas celulares, contribuyen al restablecimiento de la actividad cardíaca adecuada. E - Electrocardiografía - Registro de ECG Con la ayuda de un estudio de ECG, se determina la naturaleza de la violación de la actividad cardíaca. En la mayoría de los casos, puede ser asistolia: cese completo de las contracciones cardíacas, fibrilación: contracción caótica descoordinada de las fibras miocárdicas con una frecuencia de 400-500 latidos / min, en la que el gasto cardíaco prácticamente se detiene. Inicialmente, se observa una fibrilación de onda grande que, en 1 a 2 minutos, pasa a una fibrilación de onda pequeña, seguida de asistolia. La presencia de cualquier ritmo en el ECG es mejor que la ausencia total de actividad eléctrica del miocardio. Por lo tanto, la tarea clave de la RCP es estimular la actividad eléctrica del miocardio y posteriormente modificarla en un ritmo efectivo (presencia de pulso). La presencia de asistolia sirve como marcador de trastorno de perfusión miocárdica grave y sirve como signo de mal pronóstico para restaurar el ritmo cardíaco. Sin embargo, es importante diferenciar entre la fibrilación ventricular por microondas de baja amplitud y la asistolia, que se realiza mejor en las derivaciones estándar 2-3 del ECG. La adrenalina (1 mg por vía intravenosa) y la atropina (1 mg aumentado a 2-4 mg) son los más efectivos para restaurar la actividad eléctrica. En casos refractarios, la corrección de los niveles de potasio y calcio es efectiva. Fibrilación ventricular (FV) En pacientes sin pulso, se debe realizar una terapia de electropulso a ciegas inmediata (antes de que el ECG reconozca la causa del paro circulatorio), ya que la FV es la causa más común de muerte súbita y el éxito de la desfibrilación depende en gran medida del momento en que se realiza. Cabe señalar que la desfibrilación "a ciegas" no dañará a los pacientes con asistolia y bradicardia y suele ser eficaz en pacientes con taquicardia y FV. Es importante recordar que la regla de la cardioversión "a ciegas" no es aceptable en niños, ya que ellos tienen muchas más probabilidades que la FV de tener un paro respiratorio como causa de una enfermedad terminal. El éxito de la desfibrilación depende de la amplitud de la FV, que a su vez está inversamente correlacionada con la duración del episodio de FV. Si dos intentos iniciales de cardioversión resultan ineficaces, en este caso es necesario administrar adrenalina para aumentar la amplitud de las ondas de fibrilación y aumentar el tono vascular (en casos de restauración del ritmo cardíaco, permite aumentar la perfusión del corazón y del cerebro). Por otro lado, es necesario utilizar dosis óptimas de adrenalina para no aumentar la demanda de oxígeno del miocardio. F - fibrilación - realizar desfibrilación eléctrica si es necesario (cardioversión) La fibrilación cardíaca puede eliminarse mediante el uso de desfibrilación eléctrica. Es necesario aplicar los electrodos firmemente en el tórax (en la posición anterolateral, un electrodo está ubicado en la región del vértice del corazón, el segundo en la región subclavia a la derecha del esternón), lo que aumenta la fuerza del descarga y, en consecuencia, la eficacia de la desfibrilación. En varios pacientes, la posición anteroposterior (vértice del corazón - espacio interescapular) de los electrodos es más eficaz. No aplique electrodos sobre las superposiciones del monitor de ECG. Cabe señalar que la desfibrilación eléctrica es efectiva solo cuando se registran en el ECG oscilaciones de onda grande con una amplitud de 0,5 a 1 mV o más. Este tipo de fibrilación miocárdica indica la seguridad de sus recursos energéticos y la posibilidad de restablecer una actividad cardíaca adecuada. Si las oscilaciones son bajas, arrítmicas y polimórficas, lo que se observa en la hipoxia miocárdica severa, entonces la posibilidad de restaurar la actividad cardíaca después de la desfibrilación es mínima. En este caso, con la ayuda de masaje cardíaco, ventilación mecánica, administración intravenosa de adrenalina, atropina, cloruro de calcio, es necesario lograr la transferencia de fibrilación a onda grande, y solo después de eso se debe realizar la desfibrilación. El primer intento de desfibrilación se lleva a cabo con una descarga de 200 J, con intentos posteriores la carga aumenta a 360 J. Los electrodos deben humedecerse y presionarse firmemente contra la superficie del tórax. Los errores más comunes durante la desfibrilación, que provocan la ineficacia de esta última, son los siguientes. 1. Interrupciones prolongadas del masaje cardíaco o ausencia total de reanimación durante la preparación del desfibrilador para el alta. 2. Prensado flojo o humectación insuficiente de los electrodos. 3. Aplicación de una descarga en el contexto de fibrilación de onda baja sin tomar medidas que aumenten los recursos energéticos del miocardio. 4. Aplicar una descarga de baja o excesivamente alta tensión. Cabe señalar que la desfibrilación eléctrica del corazón es un método eficaz para corregir arritmias cardíacas tales como taquicardia ventricular paroxística, aleteo auricular, taquicardia nodal y supraventricular, fibrilación auricular. La indicación de desfibrilación eléctrica, en la etapa prehospitalaria, suele ser la taquicardia ventricular paroxística. Una característica de la desfibrilación en estas condiciones es la presencia de conciencia en el paciente y la necesidad de eliminar la reacción al dolor al aplicar una descarga eléctrica. G - Calibración - evaluación de resultados primarios La evaluación primaria de los resultados se lleva a cabo no solo para determinar el estado del sistema circulatorio y respiratorio, sino también para delinear las tácticas de medidas terapéuticas adicionales. Una vez finalizado el proceso de reanimación, en el que se manifestó el restablecimiento de la actividad cardíaca, el reanimador debe realizar una serie de acciones finales: 1) evaluar la condición del tracto respiratorio (simetría de la respiración, con la continuación de la respiración forzada, la adecuación de la ventilación); 2) verificar la pulsación en las arterias central y periférica; 3) evaluar el color de la piel; 4) determinar el nivel de presión arterial; 5) medir el volumen de sangre circulante (medir CVP, evaluar el estado de las venas yugulares); 6) verificar la posición correcta de los catéteres en las venas centrales; 7) en caso de eliminación de la fibrilación cardíaca, que fue la causa de la muerte súbita, asegurarse de que se continúe la infusión de cualquier agente antifibrilar; 8) corregir la terapia si se realizó al paciente antes del episodio de muerte súbita. H - hipotermia - enfriamiento de la cabeza Con hipotermia, el tiempo crítico de paro circulatorio puede aumentar significativamente. Para prevenir el desarrollo de encefalopatía poshipóxica, se deben tomar medidas para reducir la intensidad de los procesos metabólicos en el cerebro, así como medicamentos antihipóxicos y antioxidantes. Actividades principales 1. Hipotermia craneoencefálica: envolver la cabeza y el cuello con bolsas de hielo, nieve, agua fría. 2. Administración parenteral de antihipoxantes (oxibutirato de sodio, mafusol, pequeñas dosis de sedantes), así como mejorar las propiedades reológicas de la sangre (reopoliglucina, hemodez, heparina, trental). 3. La introducción de antagonistas del calcio (nimoton, lidoflazin, etc.). 4. Introducción de antioxidantes (mafusol, unitiol, vitamina C, catalasa, etc.). I - Cuidados intensivos - realización de cuidados intensivos de síndromes posteriores a la reanimación Aunque una respuesta positiva rápida a la RCP mejora las posibilidades de un pronóstico favorable en los pacientes, es posible el desarrollo posterior de sepsis, insuficiencia pulmonar aguda y neumonía, lo que naturalmente empeora el pronóstico. La supervivencia a largo plazo de pacientes con enfermedades previas de órganos vitales después de la RCP no es típica, ya que durante este período sus lesiones se profundizan y se dañan los centros nerviosos que proporcionan control autónomo y mantenimiento de los reflejos protectores. Además, cuando se usa compresión torácica intensiva, se observan rupturas del hígado, aorta, neumotórax, fracturas de las costillas y el esternón. La neumonitis por aspiración, las convulsiones (debido a la isquemia cerebral) y la intoxicación por lidocaína son complicaciones comunes. Varios pacientes desarrollan sangrado por úlceras de estrés en el estómago y el duodeno. Después de la RCP, hay un aumento significativo en el nivel de enzimas hepáticas (y/o del músculo esquelético), aunque el desarrollo de necrosis hepática y la insuficiencia de su función son raros. En los regímenes de desfibrilación de alta energía, hay un aumento significativo en el nivel de creatina fosfoquinasa, pero un aumento en la fracción MB está presente solo con descargas repetidas de alta energía. 1. Corrección de CBS y equilibrio hidroelectrolítico. A menudo, después de la RCP, se desarrollan alcalosis metabólica, hipopotasemia, hipocloremia y otros trastornos electrolíticos. Hay un cambio en el pH a un ambiente ácido o alcalino. La clave para la corrección del pH es una ventilación adecuada. El uso de bicarbonato debe realizarse bajo el control de la composición gaseosa de la sangre. Como regla, no hay necesidad de introducir NSO3 con la rápida restauración de la circulación sanguínea y la respiración. Con un corazón en funcionamiento, un nivel de pH de ~ 7,15 es adecuado para el funcionamiento del sistema cardiovascular. La dosis comúnmente recomendada de bicarbonato (1 mg/kg) puede causar efectos secundarios que incluyen: 1) alcalosis arritmogénica; 2) aumento de la producción de CO2; 3) hiperosmolaridad; 4) hipopotasemia; 5) acidosis intracelular paradójica del sistema nervioso central; 6) desplazamiento hacia la izquierda de la curva de disociación de la hemoglobina, lo que limita el suministro tisular de O2. Por lo tanto, el nombramiento de este medicamento debe ser estrictamente de acuerdo con las indicaciones. Para eliminar la hipopotasemia, se realiza una infusión intravenosa de cloruro de potasio a una dosis de 2 mmol/kg por día. 2. Normalización del sistema de defensa antioxidante. La terapia intensiva incluye un complejo de fármacos antioxidantes con acción multidireccional: mafusol, unitiol, vitamina C, multibionte, tocoferol, probucol, etc. 3. El uso de antioxidantes ayuda a reducir la intensidad de los procesos metabólicos y, en consecuencia, a reducir las necesidades de oxígeno y energía, así como al máximo aprovechamiento de la reducida cantidad de oxígeno disponible durante la hipoxia. Esto se consigue mediante el uso de fármacos protectores neurovegetativos y antihipoxantes (seduxeno, droperidol, bloqueantes ganglionares, mexamina, hidroxibutirato de sodio, citocromo, gutimina, etc.). 4. El aumento de los recursos energéticos lo proporciona la administración intravenosa de soluciones concentradas de glucosa con insulina y las principales coenzimas involucradas en la utilización de energía (vitamina B6, cocarboxilasa, ATP, riboxina, etc.). 5. La estimulación de la síntesis de proteínas y ácidos nucleicos, sustratos absolutamente necesarios para el funcionamiento normal de las células, la síntesis de enzimas, inmunoglobulinas y otros, se lleva a cabo mediante el uso de hormonas anabólicas (retabolil, nerabolil, insulina, retinol ), ácido fólico, así como la introducción de soluciones de aminoácidos. 6. La activación del metabolismo aeróbico se logra mediante la introducción de una cantidad suficiente de sustratos de oxidación (glucosa), así como mediante el uso de oxigenación hiperbólica (HBO): este método garantiza el suministro de la cantidad requerida de oxígeno incluso en condiciones de violaciones agudas de su entrega . 7. Mejora de procesos redox (ácido succínico, riboxina, tocoferol, etc.). 8. La terapia de desintoxicación activa contribuye a la normalización de los procesos metabólicos. Para esto, se utilizan varios métodos de terapia de infusión (gelatinol, albúmina, plasma), diuresis forzada, etc.. En casos severos, se utilizan métodos de desintoxicación extracorpórea (hemosorción, hemodiálisis, plasmaféresis). 9. Eliminación de violaciones de los procesos de microcirculación. Para esto, se realiza una terapia con heparina. No existe una guía única para todas las situaciones clínicas. Durante la RCP en curso, los signos neurológicos no pueden servir como marcadores del resultado y, en consecuencia, no pueden guiarse por ellos cuando se detiene la RCP. La reanimación rara vez es eficaz si se necesitan más de 20 minutos para restablecer un ritmo cardíaco coordinado. Varios estudios han demostrado que la falta de respuesta dentro de los 30 minutos de una RCP completa, con raras excepciones, conduce a la muerte. Los mejores resultados se dan en casos de cardioversión efectiva inmediata. La reanimación prolongada con un buen resultado neurológico es posible con la provisión de hipotermia y depresión farmacológica profunda del sistema nervioso central (por ejemplo, barbitúricos). Métodos para determinar la no viabilidad del cerebro: 1) angiografía de vasos cerebrales (falta de flujo sanguíneo); 2) EEG (línea recta durante al menos 24 horas); 3) tomografía computarizada. Criterios de terminación de RCP: 1) si dentro de los 30 minutos, todas las medidas de reanimación realizadas correctamente no producen ningún efecto: no aparece la respiración espontánea, la circulación sanguínea no se restablece, las pupilas permanecen dilatadas y no reaccionan a la luz; 2) si dentro de los 30 minutos hay paros cardíacos repetidos que no son susceptibles de terapia y, al mismo tiempo, no hay otros signos de reanimación exitosa; 3) si en el proceso de reanimación se encontró que este paciente no se mostró en absoluto; 4) si dentro de los 45 a 60 minutos, a pesar de la restauración parcial de la respiración, la víctima no tiene pulso y no hay signos de restauración de la función cerebral. Conferencia No. 5. Condiciones de emergencia en neumología. La insuficiencia respiratoria aguda es una condición patológica del cuerpo en la que la función del aparato respiratorio externo es insuficiente para proporcionar oxígeno al cuerpo y la eliminación adecuada de dióxido de carbono. El volumen tidal normal (TO) es de 500 ml (ventilación alveolar - 350 ml, espacio muerto 150 ml). Volumen minuto de ventilación (MOV) - 6-8 l. Consumo de oxígeno - 300 ml/min. En el aire exhalado, el oxígeno es del 16%, en el inhalado, del 21%. El oxígeno en la mezcla inhalada debe ser de al menos un 20 %. Causas de insuficiencia respiratoria aguda: una violación de la regulación central de la respiración o un desajuste entre la ventilación y el flujo sanguíneo a nivel de respirons, las unidades estructurales y funcionales finales de los pulmones. Sobredosis de sustancias estupefacientes (inhalación), analgésicos estupefacientes, edema cerebral agudo, accidente cerebrovascular, tumores cerebrales, reducción de la luz de las vías respiratorias u obstrucción completa, retracción de la lengua, gran cantidad de esputo, especialmente en pacientes con enfermedades pulmonares supurativas (absceso, bronquiectasias), hemorragia pulmonar, vómitos y aspiración, laringoespasmo y broncoespasmo. Cuando la lengua está retraída, se debe colocar un conducto de aire o es más confiable intubar y ventilar artificialmente. Con la acumulación de esputo, es necesario obligar al paciente a expectorarlo. Si el paciente está inconsciente, entonces se desinfecta el tracto respiratorio. En pacientes graves se realiza anestesia y saneamiento activo. Se realiza el cateterismo de la tráquea, árbol bronquial y la extracción del contenido. 1. Laringoespasmo El laringoespasmo es el cierre de las cuerdas vocales verdaderas y falsas. En ambos casos, se utilizan necesariamente agentes de control (eufillin). Si esto no ayuda, es necesario introducir relajantes musculares de acción corta, intubar y transferir al paciente a ventilación mecánica. Los relajantes musculares provocan insuficiencia respiratoria en el postoperatorio si no se realiza una descurarización suficiente. Suele ser producido por fármacos anticolinesterásicos (prozerin). En el momento de la extubación, es necesario asegurarse de que la fuerza y el tono muscular se hayan recuperado (pedir levantar la mano, apretar la mano, levantar la cabeza). Con múltiples fracturas de las costillas, parte del tórax se hunde durante la inhalación, se desarrolla la llamada respiración paradójica, por lo que es necesario restaurar el marco del tórax. Para este paciente, es necesario intubar, después de introducir relajantes, con posterior transferencia a ventilación mecánica (hasta que se restablezca la integridad del tórax). Lo siguiente conduce a una disminución en el funcionamiento del parénquima pulmonar: atelectasia, colapso pulmonar, neumonía, las consecuencias de la cirugía, neumo-, hemo-, piotórax. Diferencias entre atelectasia y colapso: la atelectasia es una obstrucción en estado de enderezamiento. Esta condición se caracteriza por la presencia de un pulmón no ventilado por donde pasa la mitad de la sangre circulante, esta última no se oxigena. Como resultado, se desarrolla insuficiencia respiratoria aguda. Cuando el pulmón colapsa, es comprimido por aire o líquido en la cavidad pleural. Al mismo tiempo, la circulación sanguínea en el pulmón comprimido disminuye bruscamente y aumenta la circulación sanguínea en un pulmón sano. Por lo tanto, el colapso no es una complicación tan peligrosa en términos del desarrollo de insuficiencia respiratoria aguda como la atelectasia. Antes de la cirugía, se debe evaluar la función del pulmón intacto (espirografía separada). Según la etapa de desarrollo, la insuficiencia respiratoria aguda se divide en: 1) disfunción; 2) insuficiencia; 3) fracaso de la función protésica. Según la tasa de desarrollo, la insuficiencia respiratoria aguda se divide en: 1) rápido como un rayo (se desarrolla en un minuto); 2) agudo (se desarrolla en unas pocas horas); 3) subaguda (se desarrolla en unos pocos días); 4) crónico (dura años). Los principales elementos de cuidados intensivos para insuficiencia respiratoria aguda: oxigenoterapia, posición de drenaje del paciente, fibrobroncoscopia, traqueotomía, intubación y ventilación mecánica, broncodilatación, terapia hormonal, OHB. 2. Embolia pulmonar La embolia pulmonar (EP) es un bloqueo del tronco principal o medio, pequeños troncos vasculares de la arteria pulmonar, que conduce a un aumento de la presión en la circulación pulmonar, insuficiencia ventricular derecha. Factores predisponentes Enfermedades del sistema cardiovascular: aterosclerosis, cardiopatía reumática, malformaciones reumáticas, endocarditis séptica. Enfermedades de las venas de las extremidades inferiores, patología de los órganos y vasos de la pelvis pequeña. En particular, la EP posoperatoria requiere mucha atención. Muy a menudo, la embolia se desarrolla durante las operaciones en: vasos de las extremidades inferiores, vejiga, órganos genitales femeninos, glándula prostática, huesos pélvicos y articulación de la cadera. Los cambios en el sistema de hemostasia, fibrinólisis espontánea, retracción y organización de los trombos venosos son esenciales. Los pacientes con enfermedades oncológicas, obesidad, insuficiencia circulatoria, que se ven obligados a permanecer en cama por diversas razones, también tienen mayor riesgo. Clasificación clínica de la EP Forma: pesada, media y ligera. Aguas abajo: fulminante, aguda, recurrente. Según el nivel de daño a la arteria pulmonar: tronco o ramas principales, ramas lobulares (segmentarias), ramas pequeñas. Clínica y diagnóstico El curso clínico de la EP es bastante variable. Los síntomas más comunes son dificultad para respirar de inicio repentino (el RR varía de 30 a más de 50 por minuto), respiración rápida, palidez, más a menudo cianosis, hinchazón de las venas yugulares, taquicardia, hipotensión arterial (hasta shock), retroesternal dolor, tos y hemoptisis. La auscultación a menudo está determinada por el fortalecimiento del tono II sobre la arteria pulmonar. Signos de rayos X: un aumento en el tamaño de la arteria pulmonar proximal, agotamiento del patrón periférico y elevación de la cúpula del diafragma. El ECG puede revelar sobrecarga de los departamentos correctos (cor pulmonale): 1) la aparición de ondas Q con aumento simultáneo de la amplitud de las ondas R y S (síndrome QS); 2) rotación del corazón alrededor del eje longitudinal con el ventrículo derecho hacia adelante (desplazamiento de la zona de transición hacia las derivaciones torácicas izquierdas); 3) elevación del segmento ST con onda T negativa en III, aVF, V1-V3; 4) la aparición o aumento del grado de bloqueo de la pierna derecha del haz de His; 5) diente P "pulmonar" alto y puntiagudo con una desviación de su eje eléctrico hacia la derecha; 6) taquicardia sinusal o forma taquisistólica de fibrilación auricular. La ecocardiografía permite detectar cor pulmonale agudo, determinar la gravedad de la hipertensión en la circulación pulmonar, evaluar el estado estructural y funcional del ventrículo derecho, detectar tromboembolismo en las cavidades del corazón y en las principales arterias pulmonares, visualizar un foramen oval abierto, que puede afectar la gravedad de los trastornos hemodinámicos y ser la causa de la embolia paradójica. Sin embargo, un resultado ecocardiográfico negativo de ninguna manera descarta el diagnóstico de embolia pulmonar. El método de diagnóstico más informativo es la angiografía de la arteria pulmonar. Con fines preventivos, los anticoagulantes se utilizan en el período postoperatorio. La dosis de heparina es de 10 UI al día (000 UI 2 veces). En presencia de contraindicaciones, no se prescriben anticoagulantes. Las contraindicaciones incluyen: daño cerebral severo; oncopatología con potencial de sangrado; trombocitopenia; tuberculosis pulmonar; enfermedades crónicas graves del parénquima hepático y renal con insuficiencia funcional. tratamiento Terapia anticoagulante. Los anticoagulantes pueden prevenir la trombosis secundaria en el lecho vascular pulmonar y la progresión de la trombosis venosa. Es recomendable el uso generalizado de heparinas de bajo peso molecular (dalteparina, eioxaparina, fraxiparina) que, en comparación con la heparina no fraccionada convencional, rara vez provocan complicaciones hemorrágicas, tienen menor efecto sobre la función plaquetaria, tienen una mayor duración de acción y una alta biodisponibilidad. terapia trombolítica. En la EP masiva, la terapia trombolítica está indicada y justificada en los casos en que el volumen de la lesión es relativamente pequeño, pero la hipertensión pulmonar es pronunciada. La mayoría de las veces, la estreptoquinasa se usa en una dosis de 100 000 unidades por hora, pero se debe tener cuidado con las reacciones alérgicas graves. La duración de la trombólisis suele ser de 1-2 días. La uroquinasa y la alteplasa carecen de propiedades antigénicas, pero tienen una alta resistencia. Cirugía. La embolectomía está indicada para pacientes con tromboembolismo del tronco pulmonar o de sus dos ramas principales con un grado extremadamente grave de deterioro de la perfusión pulmonar, acompañado de trastornos hemodinámicos pronunciados. Todas las manipulaciones para eliminar émbolos después del pinzamiento cruzado de la vena cava no deben durar más de 3 minutos, ya que este intervalo es crítico para los pacientes que son operados en condiciones de hipoxia inicial severa. Es óptimo realizar la embolectomía bajo circulación extracorpórea utilizando acceso transesternal. 3. Asma bronquial El asma bronquial es una enfermedad basada en la inflamación crónica de las vías respiratorias con un componente autoinmune, acompañada de un cambio en la sensibilidad y reactividad de los bronquios, manifestada por un ataque o el estado de asfixia, con síntomas constantes de malestar respiratorio, en el contexto de una predisposición hereditaria a las enfermedades alérgicas. Clasificación La clasificación del asma bronquial es la siguiente. 1. Etapas de desarrollo del asma: 1) defectos biológicos en personas prácticamente sanas; 2) el estado de preasma; 3) asma clínicamente pronunciada. 2. Variantes clínicas y patogenéticas: 1) atópico; 2) infeccioso-dependiente; 3) autoinmune; 4) deshormonal; 5) neuropsíquica; 6) aspirado; 7) reactividad bronquial alterada primaria. 3. La gravedad del curso de la enfermedad: 1) pulmón; 2) moderado; 3) pesado. 4. Fases de flujo: 1) exacerbación; 2) remisión inestable; 3) remisión estable (más de 2 años). 5. Complicaciones: 1) pulmonar - atelectasia, neumotórax, insuficiencia pulmonar aguda; 2) extrapulmonar - cor pulmonale, insuficiencia cardíaca. 6. Por etiología: 1) atópico (exógeno, alérgico, inmunológico); 2) no atópico (endógeno, no inmunológico). Los criterios clínicos para el grado de BA se dan en la Tabla 2. Tabla 2 Criterios clínicos para evaluar la gravedad del asma
estado asmático El estado asmático es un ataque continuo de asma bronquial, caracterizado por insuficiencia respiratoria obstructiva aguda durante el día. Las principales características distintivas del estado asmático son la falta de efecto de la terapia broncodilatadora convencional y una tos debilitante e improductiva. La clasificación del estado asmático se muestra en la tabla 3. Tabla 3 Clasificación del estado asmático (Sorokina T. A., 1987)
AS se caracteriza por una grave dificultad para respirar de naturaleza espiratoria con la participación de los músculos auxiliares del tórax y la pared abdominal anterior en el acto de respirar, acompañada de un cambio en el color de la piel: palidez, hiperemia, cianosis. La piel puede estar seca y caliente o fría y húmeda. La taquipnea es característica, la frecuencia respiratoria suele ser superior a 30 por 1 min. Escucha auscultatoria del sonido musical asociado al paso del aire a través de los bronquiolos estrechados. Con la progresión del proceso, se produce el conocido fenómeno de "zonas silenciosas" de los pulmones, que indica una broncoobstrucción de esta región de los pulmones. Caracterizado por taquicardia, aumento de la presión arterial y gasto cardíaco (MOS). Disminución de la presión arterial sistólica durante la inspiración. Se desarrolla deshidratación e hipovolemia. La pérdida de líquidos se produce principalmente a través de las vías respiratorias y la piel. El volumen de sangre circulante (CBV) generalmente se reduce en un promedio del 10% y muy raramente aumenta. Aumenta significativamente la viscosidad de la sangre y el hematocrito a 0,50-0,60, lo que crea una amenaza real de tromboembolismo pulmonar y requiere el nombramiento de heparina. La concentración de proteínas está aumentada, la deshidratación general se manifiesta por sed, sequedad de la lengua, aumento de la osmolaridad plasmática y oliguria. La presión venosa central (PVC) se reduce a 2-5 cm de agua. Arte. La hipovolemia predispone al colapso, lo que es especialmente importante cuando se transfieren pacientes a ventilación mecánica. Inicialmente, hay excitación, luego trastornos mentales y "pánico respiratorio", que se asocia con una sensación de falta de aire. En el futuro, se establece irritabilidad, confusión, letargo (hasta estupor y coma). Se desarrolla acidosis respiratoria. Tratamiento de emergencia del estado asmático Terapia de oxigeno. Se inhala oxígeno humedecido.2 a través de sondas nasales o mediante mascarilla a razón de 1-2 l/min. La adrenalina estimula los receptores adrenérgicos a1, b1 y b2, dilata los bronquios y reduce la resistencia de las vías respiratorias. Se administra por vía subcutánea: con un peso corporal de menos de 60 kg - 0,3 ml, con un peso de 60 a 80 kg - 0,4 ml, con un peso de más de 80 kg - 0,5 ml. Eufillin inhibe la fosfodiesterasa, que contribuye a la acumulación de AMPc y a la eliminación del broncoespasmo. Al prescribir aminofilina, se deben tener en cuenta las contraindicaciones, que incluyen fumar y la infancia, insuficiencia cardíaca y síndrome coronario agudo, enfermedades crónicas de los pulmones, el hígado y los riñones. Con AS, la dosis de carga de aminofilina es de 3-6 mg/kg, se administra por vía intravenosa durante 20 minutos. Luego, se realiza una infusión de mantenimiento por goteo del fármaco a razón de 0,6 mg/kg por 1 hora para un paciente sin patología concomitante, 0,8 mg/kg por 1 hora para un fumador, 0,2 mg/kg por 1 hora para congestivo insuficiencia cardíaca, neumonía, enfermedades del hígado y los riñones, 0,4 mg/kg por 1 hora para enfermedades pulmonares crónicas graves. El efecto de la terapia con corticosteroides se asocia con la supresión de la inflamación de las vías respiratorias y una mayor sensibilidad a los fármacos b-adrenérgicos. Cuanto más grave es la EA, mayor es la indicación de corticoterapia inmediata. Se debe administrar inicialmente una dosis alta de corticosteroides. La dosis mínima es de 30 mg de prednisolona o 100 mg de hidrocortisona o 4 mg de dexametasona (celeston). Si la terapia es ineficaz, se aumenta la dosis. Al menos cada 6 horas, se administran dosis equivalentes apropiadas de estos medicamentos. A la mayoría de los pacientes se les muestra terapia de inhalación con agonistas b-adrenérgicos; (fenoterol, alupent, salbutamol). Las excepciones son los casos de sobredosis de simpaticomiméticos. Si la terapia en curso no produce efecto, está indicada la administración intravenosa de agonistas b-adrenérgicos, como isoproterenol, diluido en una solución de glucosa al 5%. Las contraindicaciones son enfermedades del corazón (cardioesclerosis coronaria, infarto de miocardio), taquicardia severa y síntomas de taquifilaxia, vejez. La velocidad de administración de isoproterenol es de 0,1 μg/kg por 1 min hasta el inicio de la taquicardia (HR 130 por 1 min o más). La terapia de infusión es el componente más importante del tratamiento de AS, cuyo objetivo es reponer la deficiencia de líquidos y eliminar la hipovolemia, el volumen total de la terapia de infusión es de 3 a 5 litros por día. La hidratación se lleva a cabo mediante la introducción de soluciones que contengan una cantidad suficiente de agua libre (soluciones de glucosa), así como soluciones electrolíticas hipo e isotónicas que contengan sodio y cloro. Los indicadores de hidratación adecuada son el cese de la sed, la lengua húmeda, el restablecimiento de la diuresis normal, la mejora de la evacuación del esputo y la disminución del hematocrito a 0,30-0,40. La anestesia con halotano se puede utilizar en el tratamiento de un ataque de asma grave que no se puede tratar con la terapia convencional. Ventilación artificial de los pulmones. Las indicaciones para el traslado de pacientes con SA a ventilación mecánica deben ser muy estrictas, ya que en este estado suele causar complicaciones y se caracteriza por una alta mortalidad. Al mismo tiempo, la ventilación mecánica, si se lleva a cabo según indicaciones estrictas, es el único método que puede prevenir una mayor progresión de la hipoxia y la hipercapnia. Indicaciones para IVL: 1) progresión constante de AS, a pesar de la terapia intensiva; 2) aumento de la pCO2 e hipoxemia, confirmada por una serie de pruebas; 3) progresión de los síntomas del SNC y coma; 4) aumento de la fatiga y el agotamiento. Los mucolíticos y expectorantes se dividen en dos grupos. 1. Las enzimas proteolíticas (tripsina, quimotripsina) actúan rompiendo los enlaces peptídicos de las glicoproteínas, reduciendo la viscosidad y la elasticidad del esputo. Son efectivos en esputos mucosos y purulentos, tienen un efecto antiinflamatorio, pero pueden causar hemoptisis y reacciones alérgicas. 2. Los derivados de cisteína estimulan la actividad secretora en el epitelio ciliado del árbol traqueobronquial (mukosolvan, mukomist), se usan como un aerosol de una solución al 20% de 2-3 ml 2-3 veces al día. Conferencia No. 6. Condiciones de emergencia en cardiología. 1. Infarto de miocardio El infarto de miocardio es una discrepancia entre la demanda de oxígeno del miocardio y su suministro, lo que da como resultado una necrosis limitada del músculo cardíaco. La causa más común es un trombo, con menos frecuencia un émbolo, con menos frecuencia un espasmo de las arterias coronarias. La trombosis se observa con mayor frecuencia en el contexto del daño aterosclerótico de las arterias coronarias. En presencia de placas de ateroma, se produce un remolino del flujo sanguíneo. Las lesiones ateroscleróticas se desarrollan como resultado de la alteración del metabolismo de los lípidos, aumenta la coagulación de la sangre, lo que se asocia con una disminución de la actividad de los mastocitos que producen heparina. El aumento de la coagulación de la sangre y la turbulencia contribuyen a la formación de coágulos de sangre. La desintegración de las placas ateromatosas, las hemorragias en ellas pueden conducir a la formación de coágulos de sangre. Los factores predisponentes son el sexo masculino, la edad mayor de 50 años, la obesidad, la herencia, el estrés psicoemocional, el trabajo duro. Clínica y diagnóstico Clásicamente, el infarto de miocardio comienza con un dolor creciente detrás del esternón, que es de naturaleza ardiente y apremiante. Caracterizado por una irradiación extensa del dolor en los brazos (más a menudo en el izquierdo), espalda, abdomen, cabeza, debajo del omóplato izquierdo, en la mandíbula inferior izquierda, etc. Los pacientes están inquietos, ansiosos, a veces notan una sensación de miedo. de la muerte. Hay signos de insuficiencia cardíaca y vascular: extremidades frías, sudor húmedo, etc. El síndrome de dolor es prolongado y no se alivia con nitroglicerina durante 30 minutos o más. Hay varios trastornos del ritmo cardíaco, una caída de la presión arterial o su aumento. Los pacientes notan subjetivamente la sensación de falta de aire. Los signos anteriores son típicos del período I: doloroso o isquémico, cuya duración varía de varias horas a 2 días. Objetivamente, un aumento en la presión arterial (luego una disminución); aumento de la frecuencia cardíaca o alteración del ritmo; en la auscultación, se escucha un tono intravenoso anormal; los sonidos del corazón están amortiguados; en el tono de aorta acento II; prácticamente no hay cambios bioquímicos en la sangre, signos característicos en el ECG. El segundo período es agudo (febril, inflamatorio), caracterizado por la aparición de necrosis del músculo cardíaco en el sitio de la isquemia. El dolor generalmente desaparece. La duración del período agudo es de hasta 2 semanas. El estado de salud del paciente mejora gradualmente, pero persisten la debilidad general, el malestar general y la taquicardia. Los sonidos del corazón están amortiguados. Un aumento de la temperatura corporal debido al proceso inflamatorio en el miocardio, generalmente pequeño, hasta 38°C, suele aparecer al 3er día de la enfermedad. Al final de la primera semana, la temperatura suele volver a la normalidad. Al examinar la sangre, encuentran: leucocitosis, moderada, neutrofílica (10-15 mil) con un cambio a bastones: los eosinófilos están ausentes o eosinopenia; aceleración gradual de ESR; Aparece proteína C reactiva; aumento de la actividad de las transaminasas; aumento de la actividad de lactato deshidrogenasa, creatina fosfoquinasa y otros marcadores de infarto. Los cardioespecíficos son la fracción CPK-MB y la troponina cardíaca. El tercer período (subagudo o período de cicatrización) dura de 4 a 6 semanas. Se caracteriza por la normalización de los parámetros sanguíneos (enzimas), la temperatura corporal se normaliza, todos los demás signos de un proceso agudo desaparecen: el ECG cambia, se desarrolla una cicatriz de tejido conectivo en el sitio de la necrosis. El cuarto período (período de rehabilitación, recuperación) dura de 6 meses a 1 año. No hay signos clínicos. Durante este período, se produce una hipertrofia compensatoria de las fibras musculares miocárdicas intactas y se desarrollan otros mecanismos compensatorios. Hay una restauración gradual de la función miocárdica. Pero la onda Q patológica persiste en el ECG. Pero no debemos olvidarnos de la presencia de formas atípicas de infarto de miocardio, que a menudo se encuentran en la práctica clínica. Estos incluyen lo siguiente. 1. La forma abdominal procede según el tipo de patología del tracto gastrointestinal con dolor en la región epigástrica, debajo del proceso xifoides, en el abdomen, acompañado de náuseas y vómitos. Más a menudo, esta forma (abdominal) de infarto de miocardio ocurre con un infarto de la pared posterior del ventrículo izquierdo. En general, la opción es rara. Derivaciones de ECG II, III y VL. 2. La forma asmática se caracteriza por signos de asma cardiaca y como resultado provoca edema pulmonar. El dolor puede estar ausente. La forma asmática ocurre con mayor frecuencia en personas mayores con cardiosclerosis o en infartos recurrentes, o en infartos muy grandes. Hay dificultad para respirar, asfixia, tos. Auscultación en los pulmones - estertores burbujeantes finos húmedos. 3. Forma cerebral, o cerebral. Al mismo tiempo, en primer plano, los síntomas de accidente cerebrovascular por tipo de ictus con pérdida de conciencia son más frecuentes en personas mayores con esclerosis vascular cerebral. Hay mareos, náuseas, vómitos, síntomas neurológicos focales. 4. La forma silenciosa o indolora es un hallazgo accidental durante el examen médico. De las manifestaciones clínicas: de repente se "enfermó", hubo una fuerte debilidad, sudor pegajoso, luego todo, excepto la debilidad, desaparece. Esta situación es típica de un ataque al corazón en la vejez y con infartos de miocardio repetidos. Se desarrolla una disminución no motivada de la tolerancia al ejercicio. 5. Forma arrítmica: el síntoma principal es paroxístico: taquicardia, el dolor puede estar ausente. Comienza con un signo de taquicardia ventricular o supraventricular, bloqueo AV grado II-III, bloqueo agudo de las piernas del haz auriculoventricular. Los ataques de Morgagni-Adams-Stokes a menudo ocurren en la apertura. En la mayoría de los casos, las arritmias cardíacas se complican con hipotensión, shock arritmogénico e insuficiencia cardíaca aguda. Los signos de infarto de miocardio en el ECG son los siguientes: 1) con infarto de miocardio penetrante o transmural (es decir, la zona de necrosis se extiende desde el pericardio hasta el endocardio): desplazamiento del segmento ST por encima de la isolina, la forma es convexa hacia arriba, como una "lomo de gato"; fusión de la onda T con los segmentos ST los días 1-3; la onda Q profunda y amplia es el signo principal; disminución del tamaño de la onda R, a veces forma QS; cambios discordantes característicos: cambios opuestos de ST y T (por ejemplo, en la primera y segunda derivaciones estándar en comparación con la tercera derivación estándar); en promedio, a partir del tercer día, se observa una dinámica inversa característica de los cambios del ECG: el segmento ST se acerca a la isolina, aparece una T profunda uniforme. La onda Q también sufre una dinámica inversa, pero la Q alterada y la T profunda pueden persistir de por vida. ; 2) con infarto de miocardio intramural o no transmural: no hay onda Q profunda, el desplazamiento del segmento ST puede ser no solo hacia arriba sino también hacia abajo. Los principales criterios para el diagnóstico de infarto de miocardio: 1) signos clínicos; 2) signos electrocardiográficos; 3) signos bioquímicos. Complicaciones: arritmias cardíacas, trastornos de la conducción auriculoventricular, insuficiencia ventricular izquierda aguda: edema pulmonar, asma cardíaca, shock cardiogénico, trastornos gastrointestinales (paresia del estómago e intestinos, sangrado gástrico), pericarditis, tromboendocarditis parietal, roturas de miocardio, aneurisma cardíaco agudo y crónico , síndrome de Dressler, complicaciones tromboembólicas, angina de pecho posinfarto. tratamiento El tratamiento está dirigido a la prevención de complicaciones, delimitación de la zona del infarto, alivio del dolor y corrección de la hipoxia. La eliminación del síndrome doloroso: comienzan de la recepción de los nitratos. Con hipotensión severa, se realiza neuroleptanalgesia: fentanilo 1-2 ml por vía intravenosa con glucosa, droperidol 0,25% 2 ml por 40 ml de solución de glucosa al 5%. Con un efecto incompleto, la morfina al 1% 1,0 se reintroduce después de una hora por vía subcutánea o intravenosa por chorro; omnopon 2% - 1,0 por vía subcutánea o intravenosa; promedol 1% - 1,0 por vía subcutánea. Para mejorar el efecto analgésico, aliviar la ansiedad, la ansiedad, la excitación, aplique: analgin 50% - 2,0 por vía intramuscular o intravenosa; difenhidramina al 1 % - 1,0 por vía intramuscular (efecto sedante) + clorpromazina al 2,5 % - 1,0 por vía intramuscular, por vía intravenosa (potenciación del fármaco). Para limitar la zona de necrosis, se utilizan anticoagulantes (heparina 5 mil unidades - bolo de 1 ml seguido de la administración intravenosa de una bomba de infusión 1 mil unidades por hora), trombolíticos (fibrinolisina 6 mil unidades por goteo intravenoso; estreptasa 250 mil en solución salina goteo intravenoso ) y agentes antiplaquetarios (aspirina, cardiomagnyl, trombo-ACS, Plavix). Prevención y tratamiento de las arritmias. 1. Mezcla polarizante, que favorece la penetración del potasio en las células. 2. La lidocaína es el fármaco de elección, más eficaz para las arritmias ventriculares en bolo de 80-100 mg. 3. Cordarone o amiodarona 450 mg por vía intravenosa en solución salina. Dado que la función de bombeo del corazón sufre, se indica el nombramiento de bloqueadores beta (egilok 12,5-25 mg) para mejorar la contractilidad del miocardio. En presencia de edema en las extremidades inferiores o estertores húmedos en los pulmones, se utilizan diuréticos (Lasix en dosis de 40-80 mg). Gran énfasis recae en la presión arterial, que debe aumentarse con hipotensión (dopamina) o reducirse (goteo intravenoso de isotet, medicamentos antihipertensivos - enalapril). Para eliminar la hipoxia, la oxigenoterapia se realiza utilizando oxígeno humidificado a través de una mascarilla o sondas nasales. 2. Choque cardiogénico El shock cardiogénico es un trastorno circulatorio crítico con hipotensión arterial y signos de deterioro agudo de la circulación sanguínea en órganos y tejidos. Clínica y diagnóstico El principal signo de diagnóstico es una disminución significativa de la presión arterial sistólica, que está por debajo de 90 mm Hg. Arte. La diferencia entre la presión sistólica y diastólica (presión de pulso) es de 20 mm Hg. Arte. o cada vez más pequeño. Además, se está desarrollando una clínica de fuerte deterioro en la perfusión de órganos y tejidos: 1) deterioro de la conciencia desde letargo leve hasta psicosis o coma, pueden aparecer síntomas neurológicos focales; 2) diuresis inferior a 20 ml/h. Síntomas de deterioro de la circulación periférica: piel pálida cianótica, marmórea, de ladrillo, húmeda; venas periféricas colapsadas, una fuerte disminución de la temperatura de la piel de las manos y los pies; disminución del flujo sanguíneo. El valor del CVP puede ser diferente. Los indicadores normales de CVP son 5-8 cm de agua. Arte.; indicador por debajo de 5 cm de agua. Arte. indica hipovolemia y presión arterial baja, y por encima de 8 cm de agua. Arte. indica insuficiencia ventricular derecha. El diagnóstico de shock cardiogénico no suele ser difícil. Es más difícil determinar su tipo y los principales mecanismos fisiopatológicos. En primer lugar, es necesario distinguir el shock cardiogénico verdadero (contráctil) del shock arrítmico, reflejo (doloroso), médico debido a insuficiencia ventricular derecha o rotura miocárdica de evolución lenta. Al realizar cuidados intensivos para un paciente con shock, es importante excluir causas de presión arterial baja, como hipovolemia, taponamiento cardíaco, neumotórax a tensión, complicaciones tromboembólicas y no pasar por alto hemorragia interna, por ejemplo, con erosiones por estrés o úlceras de el tracto gastrointestinal. tratamiento Está indicada la oxigenoterapia con oxígeno humidificado a través de mascarilla o sondas nasales. Los anticoagulantes se administran en bolo a una dosis de 10 UI, seguido de la administración intravenosa de una bomba de infusión a 000 UI por hora. Es necesario administrar analgésicos: morfina al 1000% 1 ml por vía subcutánea o intravenosa en bolo; analgin 1,0% 50 ml por vía intramuscular, por vía intravenosa. Tónicos vasculares: Cordiamin 1-4 ml por vía intravenosa; mezaton 1% 1,0 g por vía subcutánea, intravenosa, en solución salina; norepinefrina al 0,2% 1,0 por vía intravenosa. El verdadero shock cardiogénico se trata de la siguiente manera. Para aumentar la actividad contráctil del miocardio, se utiliza lo siguiente: estrofantina 0,05% 0,5-0,75 g por vía intravenosa lentamente por solución isotónica 20,0, korglukon 0,01 g por vía intravenosa, también en una solución isotónica o en una mezcla polarizante, glucagón 2-4 mg por vía intravenosa goteo sobre una solución polarizante. Normalización de la presión arterial: norepinefrina 0,2% 2-4 ml por 1 litro de solución de glucosa al 5% o solución isotónica. La PA se mantiene en 100 mm Hg. Art., mezaton 1% 1,0 g por vía intravenosa; cordiamina 2-4 ml, dopamina 200 mg en 400 ml de reopoliglucina o glucosa al 5%. Con un efecto inestable de los medicamentos anteriores, se usan 200 mg de hidrocortisona, 90-120 mg de prednisolona. Normalización de las propiedades reológicas de la sangre (dado que necesariamente se forman trombos microvasculares, se altera la microcirculación). Eliminación de hipovolemia, ya que hay sudoración de la parte líquida de la sangre: reopoliglyukin, polyglukin, en un volumen de hasta 100 ml a una velocidad de 50,0 ml por minuto. Corrección del equilibrio ácido-base (lucha contra la acidosis): bicarbonato de sodio al 5% hasta 200,0 ml. Reintroducción de analgésicos. Restauración del ritmo y alteraciones de la conducción. Pero siempre es necesario controlar la PVC, lo que permite al reanimador determinar la terapia de infusión aceptable. Los pacientes con shock cardiogénico no deben cargarse con agua. A mayor CVP, menor terapia de infusión. 3. Crisis hipertensiva Una crisis hipertensiva es un aumento repentino de la presión arterial a un nivel que generalmente no es característico de este paciente, lo que lleva a trastornos circulatorios regionales agudos y daño a los órganos objetivo (corazón, cerebro, riñones, intestinos). Los factores externos que provocan una crisis pueden ser: 1) estrés psicoemocional; 2) influencias meteorológicas; 3) consumo excesivo de sal de mesa. En primavera y otoño, las crisis ocurren con más frecuencia que en invierno y verano. Las crisis también pueden ocurrir en el contexto de una exacerbación de una serie de enfermedades crónicas. MS Kushakovsky (1982) identifica las siguientes variantes de crisis hipertensivas: neurovegetativa, agua-sal, convulsiva (encefalopatía). Clinica Los síntomas clínicos de la crisis se manifiestan por tinnitus, destellos de moscas ante los ojos, dolor de cabeza estallante en la región occipital, agravado por agacharse, pujar, toser, náuseas, vómitos y alteraciones del ritmo cardíaco. Durante una crisis, ocurren violaciones peligrosas de la circulación coronaria cerebral, con menos frecuencia renal y abdominal, lo que conduce a un accidente cerebrovascular, infarto de miocardio y otras complicaciones graves. El ECG revela hipertrofia ventricular izquierda. La radiografía de tórax muestra un corazón agrandado, deformidad aórtica en forma de número "3", usura de las costillas como resultado del aumento del flujo sanguíneo colateral a través de las arterias intercostales. La aortografía confirma el diagnóstico. La forma neurovegetativa de la crisis se caracteriza por un inicio repentino, excitación, hiperemia y humedad de la piel, taquicardia, micción profusa frecuente, aumento predominante de la presión sistólica con aumento de la amplitud del pulso. Tales crisis también se denominan crisis suprarrenales o de tipo I. Las crisis de tipo I suelen tener un curso relativamente benigno, aunque pueden dar lugar a arritmias paroxísticas o angina de pecho y, en casos graves, a infarto de miocardio. Con la forma de agua y sal de la crisis, la condición empeora gradualmente, se notan somnolencia, debilidad, letargo, desorientación, palidez e hinchazón de la cara e hinchazón. La presión sistólica y diastólica aumentan de manera uniforme o con predominio de esta última y disminución de la presión del pulso. Estas crisis se denominan crisis de tipo II. Las crisis de tipo II, por regla general, son graves y pueden complicarse con infarto de miocardio, accidente cerebrovascular, insuficiencia ventricular izquierda aguda. Es necesario destacar las crisis hipertensivas que se desarrollan como resultado de un cese abrupto de la terapia antihipertensiva permanente, en particular, tomando bloqueadores beta, nifedipino, simpaticolíticos y especialmente clonidina. tratamiento El tratamiento de una crisis hipertensiva consiste en una disminución urgente de la presión arterial a un nivel normal, necesaria para prevenir o limitar el daño a los órganos diana en la hipertensión, para prevenir complicaciones hasta la muerte en los casos más graves, o incapacidad permanente en el desarrollo de un ictus. , infarto de miocardio. En la forma neurovegetativa de la crisis se suele utilizar chorro intravenoso, administración lenta de 0,1 mg de clonidina o infusiones intravenosas repetidas de 50 mg de labetalol. El efecto hipotensor de la clonidina puede potenciarse mediante la administración sublingual de 10 mg de nifedipina. En casos extremadamente graves, el nitroprusiato de sodio se inyecta por vía intravenosa y, en su ausencia, por goteo intravenoso o muy lentamente fraccionadamente, hasta 50 mg de pentamina. Los principales peligros y complicaciones de la terapia antihipertensiva: 1) hipotensión arterial; 2) violación de la circulación cerebral (accidente cerebrovascular hemorrágico o isquémico, encefalopatía); 3) edema pulmonar; 4) angina de pecho, infarto de miocardio; 5) taquicardia. Las crisis hipertensivas potencialmente mortales son motivo de cuidados intensivos inmediatos. Tipos de crisis hipertensivas. 1. Forma convulsiva de crisis hipertensiva (encefalopatía hipertensiva aguda severa). 2. Crisis con feocromocitoma. 3. Hipertensión arterial aguda en enfermedades y condiciones que amenazan la vida (síndrome coronario agudo, infarto agudo de miocardio, aneurisma aórtico disecante, hemorragia interna). 4. Crisis hipertensiva complicada con edema pulmonar o accidente cerebrovascular hemorrágico. Una forma convulsiva de una crisis hipertensiva (encefalopatía hipertensiva aguda severa) se desarrolla en una forma maligna de hipertensión o hipertensión arterial secundaria, por ejemplo, en la toxicosis tardía de mujeres embarazadas o glomerulonefritis aguda. Las crisis comienzan con un fuerte dolor de cabeza pulsátil y arqueado, agitación psicomotora, vómitos repetidos que no brindan alivio, trastornos visuales; Rápidamente se pierde la conciencia y aparecen convulsiones clónico-tónicas. En pacientes con hipertensión arterial reciente (con glomerulonefritis aguda, toxicosis de mujeres embarazadas), se puede desarrollar una crisis hipertensiva convulsiva con un aumento relativamente pequeño de la presión arterial. En la forma convulsiva de la crisis, la atención de emergencia tiene como objetivo eliminar el síndrome convulsivo y bajar la presión arterial de emergencia. El síndrome convulsivo se elimina mediante la administración intravenosa de diazepam. Además, se pueden administrar 10 ml de una solución de sulfato de magnesio al 25% por vía intravenosa por goteo o chorro lento, o por vía intramuscular. El nitroprusiato de sodio, el labetalol y el diazóxido se usan para bajar la presión arterial con urgencia. Para combatir el edema cerebral está indicada la administración intravenosa a chorro de lasix. Con la eclampsia, especialmente con la administración intravenosa, todavía se usa ampliamente el sulfato de magnesio, que se administra a una dosis de 4 g por 100 ml de una solución de glucosa al 5%. Luego, si es necesario, se realiza una inyección por goteo del medicamento, o en lugar de la posterior inyección por goteo de sulfato de magnesio, se pueden inyectar 20 ml de una solución al 25% de sulfato de magnesio por vía intramuscular profunda. Se debe evitar el sulfato de magnesio intravenoso si la mujer embarazada está siendo tratada con antagonistas del calcio (una caída brusca de la presión arterial es peligrosa). Quizás con eclampsia y administración intravenosa de clorpromazina (100-250 mg), diazóxido (300 mg). Seduxen (diazepam) se administra por vía intravenosa lentamente (20-30 mg) y luego por goteo (300 mg en 500 ml de solución de glucosa al 5%). Una crisis de feocromocitoma se manifiesta por un aumento repentino, muy rápido y agudo de la presión arterial, principalmente sistólica, y un aumento de la presión del pulso, acompañado de palidez, sudor frío, palpitaciones, dolor en el corazón y la región epigástrica, náuseas, vómitos. , dolor de cabeza palpitante, mareos. Durante una crisis, es posible un aumento de la temperatura corporal, trastornos visuales y auditivos. Caracterizado por una disminución de la presión arterial después de la transición a una posición vertical. La atención de urgencia en casos de crisis con feocromocitoma comienza con la elevación del cabecero de la cama en un ángulo de 45°, lo que provoca una disminución de la presión arterial. Para la terapia antihipertensiva de emergencia, el fármaco de elección es la fentolamina, que se administra por vía intravenosa en una corriente de 5 ml cada 5 minutos. Para el mismo fin, se utiliza la inyección intravenosa de labetalol 50 ml cada 5 minutos o la infusión por goteo de 30 ml de nitroprusiato de sodio en 300 ml de solución de glucosa al 5%. Como fármaco adicional puede ser útil el droperidol (5-10 ml IV). Para suprimir la taquicardia, se prescribe propranolol en una dosis de 20-40 mg. En el infarto agudo de miocardio (especialmente a menudo observado en su localización anterior), cuando durante una crisis aumenta la carga sobre el miocardio, aumenta la demanda de oxígeno del miocardio, primero es necesario detener un ataque de dolor intenso con la ayuda de analgésicos modernos (incluidos los analgésicos narcóticos ) y administrar sedantes que pueden reducir significativamente la presión arterial. Si persiste una hipertensión significativa y al mismo tiempo aumenta el tono del sistema nervioso simpático, entonces se administran bloqueadores beta (propranolol, metoprolol, esmolol) por vía intravenosa, que, junto con el efecto hipotensor, pueden limitar el área de peri -infarto de isquemia miocárdica. A menudo se recurre a la administración intravenosa de nitroglicerina para provocar una disminución de la precarga y la poscarga. Esto le permite controlar el nivel de presión arterial. Sin embargo, debe evitarse el nombramiento de nitroprusiato de sodio, que en estos casos puede aumentar la isquemia miocárdica, al parecer debido al fenómeno de "robo coronario" (reducción del flujo sanguíneo colateral coronario a la zona isquémica). Si la hipertensión persiste después de la etapa aguda del infarto de miocardio, se inicia tratamiento con los principales antihipertensivos, teniendo en cuenta las indicaciones y contraindicaciones. Sin embargo, en los últimos años, en relación con los datos sobre prevención secundaria, se prefieren con mayor frecuencia los bloqueadores beta y los inhibidores de la ECA, que, en ausencia de contraindicaciones, se intenta prescribir desde un período temprano. Con el desarrollo de insuficiencia cardíaca aguda, la crisis hipertensiva se detiene mediante la administración intravenosa de nitroglicerina (contraindicada en la estenosis mitral grave); prescribir vasodilatadores (aunque a menudo se desarrolla tolerancia a ellos), IFKA. Con hipertensión persistente en casos de insuficiencia cardíaca grave, se recurre a una combinación con diuréticos, e incluso pequeñas dosis de un diurético tiazídico junto con un diurético ahorrador de potasio (triamtereno o amilorida) no solo pueden normalizar la presión arterial, sino también prevenir la aparición. de arritmias causadas por deficiencia de potasio y magnesio en tales pacientes. (Metelitsa V.I., 1996). En el accidente cerebrovascular hemorrágico o hemorragia subaracnoidea, la presión arterial debe reducirse con especial cuidado, con la ayuda de medicamentos, cuyo efecto hipotensor puede controlarse fácilmente (nitroprusiato de sodio), y a un nivel superior al habitual (de trabajo). Cualquier disminución de la presión arterial, acompañada de un deterioro del estado neurológico, debe considerarse excesiva. En caso de edema pulmonar, la nitroglicerina o el nitroprusiato de sodio o la pentamina, así como lasix, se prescriben por vía intravenosa para bajar la presión arterial con urgencia. Con un aneurisma aórtico disecante o ruptura, los siguientes medicamentos se usan por vía intravenosa para regular la presión arterial y prepararse para el tratamiento quirúrgico: nitroprusiato de sodio, diuréticos de asa (furosemida), nifedipina, propranolol (junto con nitroprusiato de sodio), metildopa, reserpina (como agente). En las crisis causadas por un aumento del gasto cardíaco, a menudo se observa taquicardia y un aumento predominante de la presión sistólica y del pulso, un buen efecto en estos casos es la administración intravenosa de anaprilina y luego, si es necesario, furosemida. 4. Arritmias potencialmente mortales Arritmia Una arritmia es un ritmo cardíaco distinto al sinusal. Un ritmo cardíaco normal tiene las siguientes características: 1) frecuencia cardíaca de 60 a 120 por minuto; 2) el nódulo sinusal es el marcapasos, como lo demuestra la onda P positiva que precede al complejo QRS en la derivación estándar II y negativa en AVR; 3) los intervalos RR difieren en no más de 0,01 s; 4) los indicadores reales, que reflejan el tamaño de los intervalos y dientes en la norma. Todos los cambios en el ECG se llevan a cabo en la derivación estándar II. Clasificación de las arritmias 1. Violación de la formación de impulsos: 1) en el nodo sinusal: a) taquicardia sinusal; b) bradicardia sinusal; c) arritmia sinusal; d) síndrome del seno enfermo (SSS); 2) arritmias ectópicas: a) extrasístole; b) taquicardia paroxística; c) fibrilación y aleteo auricular; d) parpadeo y aleteo de los ventrículos. 2. Violación de la conducción del impulso: 1) vías adicionales (paquetes de Kent); 2) bloqueo cardíaco: a) auricular (intraauricular); b) auriculoventricular; c) intraventricular. Mecanismos de las arritmias Una disminución en el potencial de reposo, el umbral de excitabilidad se produce sólo sobre la base de una deficiencia de potasio celular, la relación "plasma - célula" (normalmente 80 meq de potasio está en la célula y 5 meq en el plasma). Asimetría del foco electrofisiológico-metabólico del miocardio por isquemia, inflamación, reperfusión durante la trombólisis. Debilidad electrofisiológica del marcapasos superior. Vías de conducción accesorias congénitas. Taquicardia supraventricular paroxística La taquicardia supraventricular paroxística es un ataque repentino de latidos cardíacos con una frecuencia de 150 a 250 latidos por minuto. Hay 3 formas: 1) auricular; 2) nodal; 3) ventricular. La etiología de la taquicardia paroxística supraventricular se asocia más a menudo con un aumento en la actividad del sistema nervioso simpático. Se manifiesta clínicamente por un ataque repentino de palpitaciones, los vasos del cuello pulsan, la actividad cardíaca cambia a un ritmo diferente. La duración del ataque es de varios minutos a varios días. El número de latidos del corazón en la forma ventricular suele estar en el rango de 150-180 latidos por minuto, con formas supraventriculares: 180-240 latidos por minuto. Durante un ataque, un ritmo de péndulo es característico auscultatorio, no hay diferencia entre el tono I y II. Aumenta la demanda de oxígeno del miocardio y puede provocar un ataque de insuficiencia coronaria aguda. signos de electrocardiograma 1. Los complejos QRS no se modifican. 2. En la forma supraventricular, la onda P se fusiona con la T. El tratamiento comienza con la administración intravenosa de cordarona a una dosis de 300 mg o novocainamida hasta 1 g, y luego adenosina 1 ml - 1% (10 mg) en bolo. Los antagonistas del calcio verapamilo (Isoptin) se usan por vía intravenosa como un bolo a una dosis de 2,5 a 5 mg durante 2 a 4 minutos. Pero se usa para complejos QRS estrechos, y para anchos puede fibrilar. Es posible tomar bloqueadores beta (propranolol 20-40 mg por vía sublingual). Paroxismo de fibrilación auricular El paroxismo de fibrilación auricular se caracteriza por la ausencia de complejos auriculares y, en lugar de una isolínea, se detectan ondas de diente de sierra de aleteo auricular, que son más distintas en las derivaciones II, III y VF con una frecuencia de 250 a 400 latidos por minuto. O no hay complejos auriculares, se detectan ondas parpadeantes, oscilaciones de onda grande o pequeña de la isolínea, la frecuencia de las ondas auriculares es de 350-600 latidos por minuto. Clínica. El pulso es arrítmico con ondas de diferente llenado, la presencia de un déficit de pulso (la diferencia entre la frecuencia cardíaca y el pulso); diferentes intervalos y diferente volumen de los sonidos del corazón durante la auscultación. Tratamiento. En caso de paroxismo se comienza con la introducción de digoxina 0,25 mg (1 ml al 0,025%) por 20 ml de suero fisiológico en bolo intravenoso. Para lograr el efecto deseado de saturación con glucósidos, se recomienda una dosis de 1,5 mg de digoxina por día o 3 días. Con paroxismo no complicado, el fármaco de elección es la novocainamida, administrada por vía intravenosa lentamente en una dosis de hasta 2000 ml durante 30 minutos (10 ml de una solución al 10%) con control constante de la presión arterial, frecuencia cardíaca, ECG. El aleteo auricular se trata con terapia de impulsos eléctricos. Taquicardia ventricular paroxística La taquicardia ventricular paroxística se caracteriza por la detección de 3 o más complejos QRS consecutivos anchos (más de 0,12 s) con una frecuencia de 100-250 latidos por minuto con un desplazamiento discordante del segmento ST y la onda T en la dirección opuesta a la onda principal del complejo QRS. La taquicardia ventricular fusiforme en pirueta o bidireccional ocurre cuando se prolonga el intervalo QT, en este caso se registra un ritmo irregular con una frecuencia cardíaca de 150-250 latidos por minuto con complejos QRS polimórficos anchos deformados. Tratamiento. En condiciones de hipodinamia de la circulación sanguínea, se requiere terapia de impulsos eléctricos, luego de lo cual se realiza una terapia de mantenimiento con goteo de lidocaína. En condiciones de estabilidad hemodinámica, el fármaco de elección es la lidocaína, bolo intravenoso de 1-2 mg/kg (80-100 mg) durante 3-5 minutos, seguido de infusión por goteo durante el día a 4 mg/min. Extrasístole ventricular La extrasístole ventricular es la aparición de un complejo QRS extraordinariamente ancho y deformado, desviación ST y T discordantes, una pausa compensatoria completa (el intervalo entre la onda P pre y post extrasistólica es igual al doble del intervalo RR normal). El fármaco de elección es la lidocaína, que se administra según el esquema anterior. Tal vez el uso de cordarona a una dosis de 300-450 mg por goteo intravenoso. Violación de la conducción AV con el desarrollo de síncope (síndrome de Morgagni-Adams-Stokes) Cuando se altera la conducción, se producen varios tipos de bloqueos cardíacos, hay una desaceleración o cese completo de la conducción del impulso a través del sistema de conducción del corazón. El bloqueo sinoauricular se caracteriza por disfunción de las células T y alteración de la conducción de los impulsos desde el nódulo sinusal hasta las aurículas. Hay 3 grados. Yo grado - ralentizando el impulso. En el ECG: prolongación del intervalo PQ durante más de 0,20 s. Prolapso del complejo QRS. El intervalo RR es estable. II grado - pérdida de parte de los impulsos, conducción incompleta. Mobitz tipo I: a medida que se realizan los impulsos, el intervalo PQ se alarga gradualmente hasta la pérdida completa de la onda del pulso. QRS no se cambia. En el sitio del prolapso QRS, la mayor distancia es RR. Pronósticamente, este tipo es relativamente favorable. Mobitz tipo II con un intervalo PQ constante y un complejo QRS sin cambios. Al mismo tiempo, no todos los impulsos llegan a los ventrículos; en algunos casos, se lleva a cabo cada segundo impulso, en otros, cada tercero, etc., es decir, hay un prolapso periódico del complejo QRS 3: 2, 4: 3 , 5: 6, etc. d. Grado III: bloqueo completo de la conducción. Al mismo tiempo, la conducción de impulsos a los ventrículos se detiene por completo, y en los ventrículos nace un foco heterotópico de ritmo idioventricular, y cuanto menor es el automatismo, más difícil es la clínica. Se observa una disociación completa: el ritmo auricular es casi normal y los ventrículos tienen su propia frecuencia: 40 latidos por minuto o menos. Este último depende del nivel de daño: si sufre el nódulo AV, 40-50 por 1 min, si la pierna del haz de His - 20 latidos por 1 min o menos. El nivel de daño también está indicado por el grado de deformación del complejo QRS. Los sonidos del corazón se debilitan, periódicamente hay un tono de "cañón", cuando la sístole de las aurículas y los ventrículos casi coinciden en el tiempo. Puede ser III tono adicional. Los soplos sistólicos de eyección pueden aparecer en la base del corazón. A menudo se encuentra una pulsación de las venas asociada con la contracción auricular, especialmente distinta con el tono de cañón de Strazhesko. Clínica. Fallo del corazón, si se cae un impulso. Vértigo si se caen varios impulsos. Síndrome de Morgagni-Adams-Stokes (pérdida del conocimiento), si se caen 6-8 complejos. Tratamiento. Para restablecer un ritmo adecuado, se administra atropina a una dosis de 0,5-1 mg a 3 mg. Cada 3 minutos, 1 mg hasta una dosis total de 0,4 mg/kg. Antagonistas del calcio - isoptina 0,04 mg/kg. Con pérdida frecuente de la conciencia, el paciente se transfiere a la terapia de electropulso permanente. Pero más a menudo el ritmo tiene que hacerse "bajo demanda". Conferencia número 7. Insuficiencia renal aguda La insuficiencia renal aguda (IRA) es una complicación de una serie de enfermedades renales y extrarrenales caracterizadas por un fuerte deterioro o cese de la función renal y que se manifiesta por el siguiente conjunto de síntomas: oligoanuria, azotemia, hiperhidratación, alteración del CBS y del equilibrio hídrico y electrolítico. Las formas de programación orientada a objetos incluyen: 1) prerrenal (hemodinámico); 2) renal (parenquimatoso); 3) postrenal (obstructivo); 4) arena. Etiología Razones para el desarrollo de insuficiencia renal aguda prerrenal. 1. Disminución del gasto cardíaco (choque cardiogénico, arritmia paroxística, taponamiento cardíaco, embolia pulmonar, insuficiencia cardíaca congestiva). 2. Tono vascular reducido (sepsis, shock infeccioso-tóxico, shock anafiláctico, sobredosis de fármacos antihipertensivos). 3. Disminución del volumen intravascular efectivo (pérdida de sangre, pérdida de plasma, deshidratación: pérdida del 7-10% del peso corporal, vómitos profusos, diarrea, poliuria, hipovolemia con nefropatía en el embarazo, síndrome nefrótico, peritonitis, cirrosis hepática). 4. Violación de la hemodinámica intrarrenal (tomar AINE, inhibidores de la ECA, medicamentos radiopacos, sandimmune). 5. Envenenamiento por agua: hiperhidratación (producción incontrolada de ADH en tumores malignos, enfermedades inflamatorias del sistema nervioso central, sobredosis de medicamentos: medicamentos, barbitúricos, sulfanilamidas antidiabéticas, indometacina, amitriptilina, ciclofosfamida). Razones para el desarrollo de insuficiencia renal aguda renal. 1. Isquemia renal (choque, deshidratación). 2. Daños nefrotóxicos por exposición a: 1) fármacos (aminoglucósidos, AINE, agentes radiopacos, sulfonamidas, fenacetina, barbitúricos, cefalosporinas, ampicilina, rimfapicina, sandimmune); 2) nefrotoxinas industriales (sales de metales pesados: mercurio, cromo, cadmio, plomo, arsénico, platino, bismuto, oro, uranio, bario); 3) nefrotoxinas domésticas (etilenglicol, alcohol metílico, dicloroetano, tetracloruro de carbono). 3. Obstrucción intratubular por pigmentos: 1) hemoglobina (hemólisis: transfusión de sangre incompatible, intoxicación por hongos, ácido acético, anemia hemolítica, síndrome urémico hemolítico, púrpura trombocitopénica trombótica); 2) uratos (gota, terapia inmunosupresora para mieloma múltiple y leucemia en esfuerzo físico severo, en personas no adaptadas al calor); 3) mioglobina (rabdomiólisis traumática, rabdomiólisis no traumática en coma, lesión eléctrica, congelación, eclampsia, miopatía alcohólica y por heroína, hipopotasemia e hipofosfatemia severas, envenenamiento por monóxido de carbono, sales de mercurio, zinc, cobre, drogas, miositis viral, sobredosis de estatinas y fibratos); 4) procesos inflamatorios: OTIN de génesis medicinal e infecciosa (SIDA, HFRS, sarampión, mononucleosis, leptospirosis, micoplasmosis, rickettsiosis) pielonefritis aguda, glomerulonefritis aguda; 5) papilitis necrótica (diabetes mellitus, analgésico, nefropatía alcohólica); 6) patología vascular (vasculitis - poliarteritis nodosa, granulomatosis de Wegener, esclerodermia sistémica, trombosis de arterias o venas, embolia bilateral de las arterias renales, lesión traumática). Razones para el desarrollo de insuficiencia renal aguda posrenal. 1. Patología de los uréteres: 1) obstrucción (cálculos, coágulos de sangre, papilitis necrótica); 2) compresión (tumor de los órganos pélvicos, fibrosis retroperitoneal). 2. Patología de la vejiga (cálculos, tumores, obstrucción inflamatoria del cuello vesical, adenoma de próstata, alteración de la inervación en lesiones medulares y neuropatía diabética). 3. Estenosis uretral. Clasificación Clasificación OPN según E. M. Tareev. 1. Choque renal. 2. Riñón tóxico. 3. Riñón infeccioso agudo. 4. Obstrucción vascular. 5. Riñón urológico. Opciones de evolución de la insuficiencia renal aguda: cíclica, recurrente e irreversible. Clinica En el curso clínico de la insuficiencia renal aguda, hay cinco etapas. El estadio I de la insuficiencia renal aguda es inicial, dura desde que se presenta el factor etiológico hasta que aparecen los primeros signos. En esta etapa, las tácticas terapéuticas están dirigidas a eliminar o mitigar el impacto del factor etiológico: terapia antichoque, reposición del BCC, combate de la insuficiencia cardíaca, terapia alcalinizante para la hemólisis intravascular, combate del dolor, tratamiento de condiciones sépticas, etc. Junto con etiológico terapia, el espasmo de los vasos renales se elimina bajo el control de la diuresis horaria. Cuanto antes se inicie la estimulación de la diuresis, mejor será el pronóstico. El estadio II de insuficiencia renal aguda, u oligoanúrico, se caracteriza por una disfunción del 70% de las nefronas. La micción de menos de 500 ml por día indica el desarrollo de oliguria y su disminución a 50 ml por día. y abajo indica anuria. Junto con una violación de la capacidad de excreción de agua de los riñones, también sufren las funciones de concentración y excreción de nitrógeno. En la orina, la cantidad de electrolitos y nitrógeno disminuye drásticamente. En esta etapa, ocurren los cambios más pronunciados en la hemostasia. El tratamiento debe estar dirigido a mantener un ambiente interno constante para dar tiempo y oportunidad al epitelio renal para que se regenere. Se desarrolla un estado de hiperhidratación debido a la pérdida de electrolitos durante los vómitos y la diarrea. Por tanto, es necesario estimular la diuresis, pero sólo bajo el control de la presión venosa central. Mejora el flujo sanguíneo renal. Dado que es necesario controlar estrictamente la diuresis, se realiza un cateterismo de la vejiga. La alteración de la función excretora de nitrógeno de los riñones conduce a la azotemia, por lo que para prevenir al máximo la degradación de proteínas en el cuerpo, es necesario introducir una cantidad suficiente de carbohidratos (al menos 5 g/kg por día). Se introducen fructosa y glucosa, agregándoles xilitol (sorbitol) en proporciones de 2: 1: 1, y si no hay fructosa, luego 3 partes de glucosa y 1 parte de sorbitol. Si el curso es severo y no se puede tratar, se realizan sesiones de hemodiálisis. Si se elimina el factor etiológico, después de 5 a 7 días de tratamiento, la diuresis comienza a aumentar. La duración máxima de esta etapa es de hasta 2 semanas. III etapa de insuficiencia renal aguda - poliúrico temprano. Se caracteriza por un aumento progresivo de la diuresis (en 200-300 ml por día) hasta 3 litros. Las funciones de excreción y concentración de nitrógeno de los riñones aún no se han recuperado por completo, pero la concentración de potasio, magnesio y fosfatos se está normalizando gradualmente. La terapia intensiva en la etapa poliúrica temprana debe incluir las mismas medidas que en la anterior, excepto la estimulación de la diuresis. A menudo, se requiere hemodiálisis. Existe un alto riesgo de deshidratación. Etapa IV de insuficiencia renal aguda - poliuria tardía. El aumento diario de orina alcanza los 500-1000 ml, y la diuresis puede alcanzar los 8-10 litros por día o más. En los riñones, los procesos de intercambio iónico comienzan a recuperarse. Las pérdidas de potasio, magnesio, fósforo y otros electrolitos aumentan considerablemente, los pacientes corren el riesgo de deshidratación y desmineralización. Por lo tanto, los electrolitos y los líquidos se administran por vía intravenosa en esta etapa. Etapa V OPN, o etapa de recuperación. Se restablece la función de concentración de los riñones. La diuresis comienza a disminuir gradualmente a la normalidad (2-3 litros por día) y aumenta la densidad de la orina (1008-1028). Para determinar la gravedad de la enfermedad y la efectividad del tratamiento, los pacientes con insuficiencia renal aguda se examinan diariamente en la sangre para detectar indicadores de CBS, la concentración de electrolitos, hemoglobina, azúcar, proteínas totales y fracciones de proteínas, urea, nitrógeno residual y ureico. , creatinina, hematocrito y en la orina diaria - densidad, la cantidad de electrolitos y nitrógeno. tratamiento Los principios del tratamiento son los siguientes. 1. Tratamiento del shock: medidas antishock, glucocorticoides. 2. Reposición de BCC: poliglucina, reopoliglyukin, plasma, albúmina, masa de eritrocitos. 3. Tratamiento de infecciones: terapia antibiótica adecuada. 4. Deshidratación: solución isotónica, hipertónica, hipotónica de cloruro de sodio, glucosa. 5. Envenenamiento con venenos: se introducen antídotos. 6. Riñón urológico: eliminación de la obstrucción. 7. Obstrucción intratubular: terapia alcalinizante en infusión intensiva continua hasta 60 horas (solución de manitol al 10% 3-5 ml/kg/h con solución isotónica de cloruro de sodio, bicarbonato de sodio, glucosa 400-600 ml/h, furosemida 30-50 mg/ kg). 8. Eliminación del espasmo de los vasos renales: eufillin 2,4% - 10 ml nuevamente después de 4-6 horas, chimes 0,5% - 2-4-6 ml por vía intravenosa, trental 3-5 mg / kg por día, pentamina 0,5-1,0 mg /kg por día, benzohexonio 0,3-0,5 mg/kg por día, droperidol 0,12 mg/kg por día, dopamina 1,5-3 mg/kg. 9. Estimulación de la diuresis (después de la estabilización de la presión arterial y la eliminación de la hipovolemia): aminofilina, manitol, lasix. 10. Control de diuresis horaria, presión arterial, PVC. Indicaciones de hemodiálisis aguda: insuficiencia renal aguda hipercatabólica, ausencia de efecto del tratamiento conservador en insuficiencia renal aguda no catabólica durante 2-3 días, hiperpotasemia superior a 6-6,5 mmol/l, acidosis metabólica descompensada con déficit de bases superior a 15 mmol/l, creatinina en sangre superior a 600 µmol/l, urea en sangre superior a 30 mmol/l, hiperhidratación con desarrollo de edema pulmonar o cerebral. Conferencia número 8. Insuficiencia hepática aguda La insuficiencia hepática aguda es un síntoma complejo caracterizado por una violación de una o más funciones hepáticas debido a un daño agudo o crónico de su parénquima. Etiología Las causas de la insuficiencia renal aguda pueden ser virus de la hepatitis A, B, C, D, E, G, así como virus del herpes, citomegalovirus, virus de la mononucleosis infecciosa, simple y herpes zoster, Coxsackie, sarampión, septicemia que se desarrolla con abscesos hepáticos y colangitis purulenta, drogas, alcohol, toxinas industriales, insuficiencia cardíaca. La OPN siempre procede con daño de múltiples órganos: los riñones, el sistema cardiovascular, los pulmones, el páncreas y el cerebro están involucrados en el proceso. El deterioro de la función renal se manifiesta como necrosis tubular aguda. Complicaciones pulmonares - aspiración de contenido gástrico o sangre, atelectasias, infecciones respiratorias. La pancreatitis aguda y la necrosis pancreática pueden causar la muerte. Se desarrolla un trastorno potencialmente mortal de la homeostasis. La insuficiencia hepática se explica por distrofia y necrobiosis generalizada de los hepatocitos. Clínica y diagnóstico Las manifestaciones clínicas de la IRA son las siguientes. 1. La coagulopatía está causada por una deficiencia de factores de coagulación y un aumento de la actividad fibrinolítica. Predispone al sangrado espontáneo de las mucosas: se puede observar sangrado gastrointestinal, uterino, nasal. Las hemorragias cerebrales son posibles. Para evaluar el estado del sistema de hemostasia, se determina el tiempo de protrombina. 2. La hipoglucemia se caracteriza por un nivel elevado de insulina en plasma, que se debe a una disminución de su captación por el hígado. Conduce a un rápido deterioro del estado neurológico y la muerte de los pacientes. 3. Violaciones del equilibrio hidroelectrolítico y ácido-base. La insuficiencia renal aguda terminal se caracteriza por hiponatremia, hipofosfatemia, hipocalcemia e hipomagnesemia. El cambio en el estado ácido-base no tiene una dirección inequívoca. La alcalosis respiratoria asociada con la estimulación del centro respiratorio por sustancias tóxicas puede ser reemplazada por acidosis respiratoria debido al aumento de la presión intracraneal y la supresión de la actividad respiratoria. En el desarrollo del coma hepático como curso severo de la enfermedad, se distinguen las etapas de precoma, coma amenazante y coma propiamente dicho. También hay coma hepatocelular (endógeno), como resultado de una necrosis masiva del parénquima, porto-cava (derivación, derivación, exógena), debido a una exclusión significativa del hígado de los procesos metabólicos debido a la presencia de pronunciadas anastomosis porto-cava, y coma mixto, que ocurre principalmente con cirrosis hepática. En el período precomato, se desarrollan anorexia progresiva, náuseas, disminución del tamaño del hígado, aumento de la ictericia, hiperbilirrubinemia y aumento del contenido de ácidos biliares en la sangre. En el futuro, aumentan los trastornos neuropsíquicos, la lentitud del pensamiento, la depresión y, en ocasiones, la euforia. Caracterizado por inestabilidad del estado de ánimo, irritabilidad, alteración de la memoria, alteración del sueño. Los reflejos tendinosos aumentan, es característico un pequeño temblor de las extremidades. Se desarrolla azotemia. Con una terapia oportuna, los pacientes pueden salir de este estado, pero con mayor frecuencia con cambios irreversibles severos en el hígado, se produce coma. Durante el período de coma, es posible la excitación, que luego se reemplaza por depresión (estupor) y un deterioro progresivo de la conciencia hasta su pérdida completa. Se desarrollan fenómenos meníngeos, reflejos patológicos, inquietud, convulsiones. La respiración está alterada (como Kussmaul, Cheyne-Stokes); el pulso es pequeño, arrítmico; hay hipotermia. El rostro del paciente está demacrado, las extremidades están frías, de la boca y la piel sale un característico olor a hígado dulce, se intensifican los fenómenos hemorrágicos (hemorragias en la piel, sangrado de la nariz, encías, venas varicosas del esófago, etc.). La insuficiencia hepática aguda se desarrolla rápidamente, en unas pocas horas o días, y con una terapia oportuna puede ser reversible. Estudios de laboratorio: bilirrubina, urea y creatinina en sangre y orina, parámetros del sistema de hemostasia, hemograma completo y orina, PVC, ECG, osmolaridad plasmática y urinaria, electrolitos plasmáticos, hemoglobina libre plasmática y urinaria, ALT, AST, fosfatasa alcalina, LDH, CPK, tiempo de protrombina. La tomografía computarizada del hígado puede revelar una disminución de su tamaño, pero la mayoría de los médicos se centran en los datos clínicos y de laboratorio. tratamiento El apoyo inotrópico oportuno es un componente esencial de los cuidados intensivos. Prevención de complicaciones infecciosas: el nombramiento de antibióticos de cefalosporina en combinación con medicamentos antimicóticos (anfotericina-B). Medicamentos hepatoprotectores y estabilizadores de membrana: prednisolona hasta 300 mg, vitamina C 500 mg, troxevasina 5 ml, etamsilato de sodio 750 mg, Essentiale 30 ml, tocoferol 4 ml por vía intramuscular, cytomak 35 mg, cocarboxilasa 300 mg, ácido nicotínico 30-40 mg, Complamin 900 mg, sirepar 5-10 ml, ácido glutámico al 1% 400 ml, vikasol 10 ml por vía intravenosa, vitaminas del grupo B. Inhibidores de la proteasa, que incluyen cortrical 100 mil unidades, trasilol 400 mil unidades, antagonosan, gordox. Estimulación de la diuresis: reogluman 400 ml, manitol, lasix hasta 200 mg por vía intravenosa, eufillin 240 mg. Para corregir la coagulopatía se utiliza la administración intravenosa de vitamina K (10 mg al día durante 3 días). El efecto se produce después de 3 horas.En este caso, la eliminación de la hipoprotrombinemia asociada con la alteración de la absorción de vitamina K, como resultado de una deficiencia de ácidos biliares. En caso de hemorragia o sospecha de procedimientos invasivos (cateterismo vascular, diálisis peritoneal), se administra por vía intravenosa masa plaquetaria o plasma fresco congelado. El edema cerebral es una causa común de muerte. El manitol se administra a razón de 1 g/kg de peso corporal. En pacientes con insuficiencia renal se prescribe manitol en combinación con ultrafiltración para evitar la hiperosmolaridad y la sobrehidratación. Con el desarrollo del coma hepático, se prescribe cloruro de potasio (solución al 0,4-0,5% en una solución de glucosa al 5% con un volumen de 500 ml por goteo intravenoso) o solución de bicarbonato de sodio (con acidosis metabólica); Los pacientes respiran oxígeno humidificado a través de un catéter nasal. Con una disminución de la presión tanto arterial como venosa, la poliglucina y la albúmina se administran por vía intravenosa. En presencia de hemorragias masivas, se toman las medidas adecuadas para detenerlas, se transfunde sangre de un grupo y se administran medicamentos que contienen factores de coagulación de la sangre. Con signos significativos de coagulación intravascular diseminada, se administra heparina por vía intravenosa a una dosis de 10 000 a 15 000 UI en bolo. En caso de insuficiencia renal, se realizan hemodiálisis peritoneal y plasmaféresis, que dan un buen resultado, pero antes de realizar estas manipulaciones, está contraindicada la introducción de heparina. Para detener la agitación psicomotora y las convulsiones, se prescriben diprazina, haloperidol, oxibutirato de sodio. En casos severos, recurrir a la intubación y ventilación mecánica. Es importante recordar que el riesgo de sangrado es alto, por lo que todas las manipulaciones deben realizarse con extrema precaución. Al sacar al paciente del coma, el siguiente paso es realizar una terapia intensiva para la enfermedad subyacente. Conferencia No. 9. Choque El shock es una forma de estado crítico del cuerpo, que se manifiesta por una disfunción de múltiples órganos, que se desarrolla en una cascada sobre la base de una crisis circulatoria generalizada y, por regla general, termina en la muerte sin tratamiento. Un factor de choque es cualquier efecto en el cuerpo que exceda la fuerza de los mecanismos adaptativos. En estado de shock, cambian las funciones de la respiración, el sistema cardiovascular y los riñones, se alteran los procesos de microcirculación de órganos y tejidos y los procesos metabólicos. Etiología y patogénesis El shock es una enfermedad de naturaleza polietiológica. Dependiendo de la etiología de la ocurrencia, los tipos de shock pueden ser diferentes. 1. Choque traumático: 1) con lesiones mecánicas: fracturas óseas, heridas, compresión de tejidos blandos, etc.; 2) con lesiones por quemaduras (quemaduras térmicas y químicas); 3) bajo la influencia de baja temperatura - choque frío; 4) en caso de lesiones eléctricas - descarga eléctrica. 2. Shock hemorrágico o hipovolémico: 1) se desarrolla como resultado de sangrado, pérdida aguda de sangre; 2) como resultado de una violación aguda del equilibrio hídrico, se produce deshidratación del cuerpo. 3. Shock séptico (bacteriano-tóxico) (procesos purulentos generalizados causados por microflora gramnegativa o grampositiva). 4. Choque anafiláctico. 5. Shock cardiogénico (infarto de miocardio, insuficiencia cardíaca aguda). Considerado en la sección condiciones de emergencia en cardiología. En todos los tipos de shock, el principal mecanismo de desarrollo es la vasodilatación y, como resultado, aumenta la capacidad del lecho vascular, hipovolemia: el volumen de sangre circulante (BCC) disminuye, ya que hay varios factores: pérdida de sangre, redistribución de fluido entre la sangre y los tejidos, o un desajuste del volumen normal de sangre que aumenta la capacidad vascular. La discrepancia resultante entre el BCC y la capacidad del lecho vascular subyace a la disminución del gasto cardíaco y los trastornos de la microcirculación. Este último conduce a cambios serios en el cuerpo, ya que es aquí donde se lleva a cabo la función principal de la circulación sanguínea: el intercambio de sustancias y oxígeno entre la célula y la sangre. Viene un espesamiento de la sangre, un aumento de su viscosidad y microtrombosis intracapilar. Posteriormente, las funciones celulares se interrumpen hasta su muerte. En los tejidos, los procesos anaeróbicos comienzan a predominar sobre los aeróbicos, lo que conduce al desarrollo de acidosis metabólica. La acumulación de productos metabólicos, principalmente ácido láctico, aumenta la acidosis. Una característica de la patogenia del shock séptico es una violación de la circulación sanguínea bajo la influencia de toxinas bacterianas, lo que contribuye a la apertura de derivaciones arteriovenosas, y la sangre comienza a pasar por alto el lecho capilar y se precipita desde las arteriolas a las vénulas. Debido a una disminución en el flujo de sangre capilar y la acción de las toxinas bacterianas específicamente sobre la célula, se interrumpe la nutrición celular, lo que conduce a una disminución en el suministro de oxígeno a las células. En el shock anafiláctico, bajo la influencia de la histamina y otras sustancias biológicamente activas, los capilares y las venas pierden su tono, mientras que el lecho vascular periférico se expande, su capacidad aumenta, lo que conduce a una redistribución patológica de la sangre. La sangre comienza a acumularse en los capilares y vénulas, lo que provoca una violación de la actividad cardíaca. El BCC formado al mismo tiempo no corresponde a la capacidad del lecho vascular, y el volumen minuto del corazón (gasto cardíaco) disminuye en consecuencia. El estancamiento resultante de la sangre en el lecho microcirculatorio conduce a una ruptura del metabolismo y del oxígeno entre la célula y la sangre al nivel del lecho capilar. Los procesos anteriores conducen a la isquemia del tejido hepático y la interrupción de sus funciones, lo que exacerba aún más la hipoxia en las etapas graves del desarrollo del shock. Desintoxicación violada, formación de proteínas, formación de glucógeno y otras funciones del hígado. El trastorno del flujo sanguíneo regional principal y la microcirculación en el tejido renal contribuye a la interrupción de las funciones de filtración y concentración de los riñones con una disminución de la diuresis de oliguria a anuria, lo que lleva a la acumulación de desechos nitrogenados en el paciente. cuerpo, tales como urea, creatinina, y otras sustancias tóxicas de los productos metabólicos. Se alteran las funciones de la corteza suprarrenal, se reduce la síntesis de corticosteroides (glucocorticoides, mineralocorticoides, hormonas androgénicas), lo que agrava los procesos en curso. Los trastornos circulatorios en los pulmones explican la violación de la respiración externa, disminuye el intercambio de gases alveolar, se produce una derivación de sangre, se forma una microtrombosis y, como resultado, se desarrolla una insuficiencia respiratoria que agrava la hipoxia tisular. Clinica El shock hemorrágico es una reacción del cuerpo a la pérdida de sangre resultante (la pérdida del 25-30 % del BCC provoca un shock grave). En la aparición del shock por quemadura, el factor dolor y la pérdida masiva de plasma juegan un papel dominante. Oliguria y anuria de rápido desarrollo. El desarrollo del shock y su gravedad se caracterizan por el volumen y la velocidad de la pérdida de sangre. En base a esto último, se distinguen el shock hemorrágico compensado, el shock reversible descompensado y el shock irreversible descompensado. Con shock compensado, palidez de la piel, sudor frío y pegajoso, el pulso se vuelve pequeño y frecuente, la presión arterial permanece dentro del rango normal o se reduce ligeramente, pero la micción disminuye ligeramente. Con el shock reversible no compensado, la piel y las membranas mucosas se vuelven cianóticas, el paciente se vuelve letárgico, el pulso es pequeño y frecuente, hay una disminución significativa de la presión arterial y venosa central, se desarrolla oliguria, el índice de Algover aumenta, el ECG muestra una violación del suministro de oxígeno al miocardio. Con un curso irreversible de shock, la conciencia está ausente, la presión arterial cae a números críticos y es posible que no se detecte, la piel es de color mármol, se desarrolla anuria: cese de la micción. El índice de Algover es alto. Para evaluar la gravedad del shock hemorrágico, la determinación de BCC, el volumen de sangre perdido, es de gran importancia. El mapa de análisis de la severidad del choque y la evaluación de los resultados obtenidos se muestran en la Tabla 4 y la Tabla 5. Tabla 4 Mapa de análisis de la gravedad de la descarga
Tabla 5 Evaluación de resultados por puntos totales
El índice de choque, o índice de Algover, es la relación entre la frecuencia cardíaca y la presión sistólica. En shock de primer grado, el índice de Algover no supera 1. En segundo grado, no más de 2; con un índice de más de 2, la condición se caracteriza como incompatible con la vida. tipos de choques El shock anafiláctico es un complejo de varias reacciones alérgicas de tipo inmediato, que alcanzan un grado extremo de gravedad. Existen las siguientes formas de shock anafiláctico: 1) forma cardiovascular, en la que se desarrolla insuficiencia circulatoria aguda, que se manifiesta por taquicardia, a menudo con alteraciones del ritmo cardíaco, fibrilación ventricular y auricular y disminución de la presión arterial; 2) forma respiratoria, acompañada de insuficiencia respiratoria aguda: dificultad para respirar, cianosis, estridor, respiración burbujeante, estertores húmedos en los pulmones. Esto se debe a una violación de la circulación capilar, hinchazón del tejido pulmonar, laringe, epiglotis; 3) forma cerebral por hipoxia, alteración de la microcirculación y edema cerebral. Según la gravedad del curso, se distinguen 4 grados de shock anafiláctico. I grado (leve) se caracteriza por picazón en la piel, aparición de sarpullido, dolor de cabeza, mareos, sensación de enrojecimiento en la cabeza. II grado (gravedad moderada) - Edema de Quincke, taquicardia, descenso de la presión arterial, aumento del índice de Algover se suman a los síntomas antes indicados. El grado III (grave) se manifiesta por pérdida de conciencia, insuficiencia respiratoria y cardiovascular aguda (dificultad para respirar, cianosis, estridor respiratorio, pulso pequeño y rápido, disminución brusca de la presión arterial, índice de Algover alto). El grado IV (extremadamente grave) se acompaña de pérdida de conciencia, insuficiencia cardiovascular grave: no se determina el pulso, la presión arterial es baja. Tratamiento. El tratamiento se lleva a cabo de acuerdo con los principios generales del tratamiento de choque: restauración de la hemodinámica, flujo sanguíneo capilar, uso de vasoconstrictores, normalización de BCC y microcirculación. Las medidas específicas tienen como objetivo inactivar el antígeno en el cuerpo humano (por ejemplo, penicilinasa o b-lactamasa en el shock causado por antibióticos) o prevenir el efecto del antígeno en el cuerpo: antihistamínicos y estabilizadores de membrana. 1. Infusión intravenosa de adrenalina hasta estabilización hemodinámica. Puede usar dopmin 10-15 mcg/kg/min, y con síntomas de broncoespasmo y agonistas b-adrenérgicos: alupent, goteo de brikanil por vía intravenosa. 2. Terapia de infusión en un volumen de 2500-3000 ml con la inclusión de poliglucina y reopoliglucina, a menos que la reacción sea causada por estos medicamentos. Bicarbonato de sodio al 4% 400 ml, soluciones de glucosa para restablecer el bcc y la hemodinámica. 3. Estabilizadores de membrana por vía intravenosa: prednisolona hasta 600 mg, ácido ascórbico 500 mg, troxevasina 5 ml, etamsilato de sodio 750 mg, citocromo C 30 mg (se indican dosis diarias). 4. Broncodilatadores: eufillin 240-480 mg, noshpa 2 ml, alupent (brikanil) 0,5 mg goteo. 5. Antihistamínicos: difenhidramina 40 mg (suprastin 60 mg, tavegil 6 ml), cimetidina 200-400 mg por vía intravenosa (se indican dosis diarias). 6. Inhibidores de proteasa: trasylol 400 mil U, contrical 100 mil U. El shock traumático es una condición patológica y crítica del cuerpo que ha surgido en respuesta a una lesión, en la que las funciones de los sistemas y órganos vitales se ven afectadas e inhibidas. Durante el shock traumático se distinguen las fases tórpida y eréctil. En el momento de la ocurrencia, el shock puede ser primario (1-2 horas) y secundario (más de 2 horas después de la lesión). Etapa eréctil o fase de ocurrencia. La conciencia permanece, el paciente está pálido, inquieto, eufórico, inadecuado, puede gritar, correr a algún lado, escapar, etc. En esta etapa, se libera adrenalina, por lo que la presión y el pulso pueden permanecer normales durante algún tiempo. La duración de esta fase es de varios minutos y horas a varios días. Pero en la mayoría de los casos es breve. La fase tórpida reemplaza a la eréctil, cuando el paciente se vuelve letárgico y adinámico, la presión arterial disminuye y aparece la taquicardia. Las estimaciones de la gravedad de las lesiones se muestran en la Tabla 6. Tabla 6 Evaluación de la extensión de la gravedad de la lesión
Después de calcular los puntos, el número resultante se multiplica por el coeficiente. Notas 1. En presencia de lesiones que no estén especificadas en el listado de volumen y gravedad de la lesión, se otorgará el número de puntos según el tipo de lesión, según la gravedad correspondiente a una de las enumeradas. 2. En presencia de enfermedades somáticas que reducen las funciones adaptativas del organismo, la suma de puntos encontrada se multiplica por un coeficiente de 1,2 a 2,0. 3. A la edad de 50-60 años, la suma de puntos se multiplica por un factor de 1,2, mayor - por 1,5. Tratamiento. Las direcciones principales en el tratamiento. 1. Eliminación de la acción del agente traumático. 2. Eliminación de la hipovolemia. 3. Eliminación de la hipoxia. La anestesia se lleva a cabo mediante la introducción de analgésicos y medicamentos, la implementación de bloqueos. Oxigenoterapia, si es necesario, intubación traqueal. Compensación por pérdida de sangre y BCC (plasma, sangre, reopoliglucina, poliglucina, eritromasa). Normalización del metabolismo, a medida que se desarrolla la acidosis metabólica, se introducen cloruro de calcio al 10% - 10 ml, cloruro de sodio al 10% - 20 ml, glucosa al 40% - 100 ml. Lucha contra la deficiencia de vitaminas (vitaminas del grupo B, vitamina C). Terapia hormonal con glucocorticosteroides: prednisolona por vía intravenosa una vez 90 ml y posteriormente 60 ml cada 10 horas. Estimulación del tono vascular (mezaton, norepinefrina), pero solo con un volumen reabastecido de sangre circulante. Los antihistamínicos (difenhidramina, sibazon) también están involucrados en la terapia antichoque. El shock hemorrágico es una condición de insuficiencia cardiovascular aguda que se desarrolla después de una cantidad significativa de pérdida de sangre y conduce a una disminución en la perfusión de los órganos vitales. Etiología: lesiones con daño de grandes vasos, úlceras gástricas y duodenales agudas, rotura de aneurisma de aorta, pancreatitis hemorrágica, rotura de bazo o hígado, rotura de trompa o embarazo ectópico, presencia de lóbulos placentarios en el útero, etc. Según los datos clínicos y la magnitud de la deficiencia de volumen sanguíneo, se distinguen los siguientes grados de gravedad. 1. No expresado: no hay datos clínicos, el nivel de presión arterial es normal. El volumen de pérdida de sangre es de hasta el 10% (500 ml). 2. Débil: taquicardia mínima, ligera disminución de la presión arterial, algunos signos de vasoconstricción periférica (manos y pies fríos). El volumen de pérdida de sangre es del 15 al 25% (750-1200 ml). 3. Moderado: taquicardia de hasta 100-120 latidos por minuto, disminución de la presión del pulso, presión sistólica de 1-90 mm Hg. Art., ansiedad, sudoración, palidez, oliguria. El volumen de pérdida de sangre es del 100 al 25% (35-1250 ml). 4. Grave: taquicardia de más de 120 latidos por minuto, presión sistólica inferior a 60 mm Hg. Art., a menudo no determinado por el tonómetro, estupor, palidez extrema, extremidades frías, anuria. El volumen de pérdida de sangre es más del 35% (más de 1750 ml). Laboratorio en el análisis general de sangre, una disminución en el nivel de hemoglobina, eritrocitos y hematocrito. El ECG muestra cambios inespecíficos en el segmento ST y la onda T, que se deben a una circulación coronaria insuficiente. El tratamiento del shock hemorrágico incluye detener el sangrado, el uso de terapia de infusión para restaurar BCC, el uso de vasoconstrictores o vasodilatadores, según la situación. La terapia de infusión implica la administración intravenosa de líquidos y electrolitos en un volumen de 4 litros (solución salina, glucosa, albúmina, poliglucina). En caso de hemorragia, está indicada la transfusión de sangre y plasma de un solo grupo en un volumen total de al menos 4 dosis (1 dosis es de 250 ml). Se muestra la introducción de medicamentos hormonales, como los estabilizadores de membrana (prednisolona 90-120 mg). Dependiendo de la etiología, se lleva a cabo una terapia específica. El shock séptico es la penetración de un agente infeccioso desde su foco inicial en el sistema sanguíneo y su diseminación por todo el cuerpo. Los agentes causales pueden ser: bacterias estafilocócicas, estreptocócicas, neumocócicas, meningocócicas y enterocócicas, así como Escherichia, Salmonella y Pseudomonas aeruginosa, etc. El shock séptico se acompaña de una disfunción de los sistemas pulmonar, hepático y renal, una violación de la sangre. sistema de coagulación, que conduce al síndrome trombohemorrágico ( síndrome de Machabeli), que se desarrolla en todos los casos de sepsis. El curso de la sepsis se ve afectado por el tipo de patógeno, esto es especialmente importante con los métodos modernos de tratamiento. Se nota anemia progresiva de laboratorio (debido a la hemólisis y la opresión de la hematopoyesis). Leucocitosis hasta 12 109 / l, sin embargo, en casos severos, a medida que se forma una fuerte depresión de los órganos hematopoyéticos, también se puede observar leucopenia. Síntomas clínicos de choque bacteriano: escalofríos, fiebre alta, hipotensión, piel seca y cálida - al principio, y luego - fría y húmeda, palidez, cianosis, trastorno del estado mental, vómitos, diarrea, oliguria. Caracterizado por neutrofilia con un cambio de la fórmula leucocitaria hacia la izquierda hasta los mielocitos; La VSG aumenta a 30-60 mm/h o más. El nivel de bilirrubina en sangre aumenta (hasta 35-85 µmol/l), lo que también se aplica al contenido de nitrógeno residual en la sangre. La coagulación de la sangre y el índice de protrombina se reducen (hasta un 50-70%), se reduce el contenido de calcio y cloruros. Se reduce el total de proteínas en la sangre, que se debe a la albúmina, y aumenta el nivel de globulinas (alfa-globulinas y b-globulinas). En la orina, proteínas, leucocitos, eritrocitos y cilindros. El nivel de cloruros en la orina se reduce y la urea y el ácido úrico se elevan. El tratamiento es principalmente de naturaleza etiológica, por lo tanto, antes de prescribir una terapia con antibióticos, es necesario determinar el patógeno y su sensibilidad a los antibióticos. Los agentes antimicrobianos deben usarse en dosis máximas. Para el tratamiento del shock séptico es necesario el uso de antibióticos que cubran todo el espectro de microorganismos gramnegativos. La más racional es la combinación de ceftazidima e impinem, que han demostrado su eficacia frente a Pseudomonas aeruginosa. Fármacos como clindamicina, metronidazol, ticarcilina o imipinem son los fármacos de elección cuando aparece un patógeno resistente. Si se siembran estafilococos de la sangre, es necesario comenzar el tratamiento con medicamentos del grupo de la penicilina. El tratamiento de la hipotensión se encuentra en la primera etapa del tratamiento en la adecuación del volumen de líquido intravascular. Utilice soluciones cristaloides (solución isotónica de cloruro de sodio, lactato de Ringer) o coloides (albúmina, dextrano, polivinilpirrolidona). La ventaja de los coloides es que cuando se introducen, las presiones de llenado requeridas se alcanzan más rápidamente y permanecen así durante mucho tiempo. Si no hay efecto, se usa soporte inotrópico y (o) fármacos vasoactivos. La dopamina es el fármaco de elección porque es un agonista β cardioselectivo. Los corticosteroides reducen la respuesta general a las endotoxinas, ayudan a reducir la fiebre y dan un efecto hemodinámico positivo. Prednisolona a una dosis de 60 a 90 mg por día. Conferencia número 10. Intoxicaciones agudas Envenenamiento agudo: enfermedades de etiología química, cuyo cuadro clínico se desarrolla con una sola ingestión de productos químicos en el cuerpo humano en una dosis tóxica que puede causar violaciones de las funciones vitales y poner en peligro la vida. Según la causa y el lugar de ocurrencia, se distinguen los siguientes tipos de intoxicaciones. 1. Envenenamiento accidental (accidentes) en el trabajo: exposición a venenos industriales durante un accidente o en violación de las normas técnicas de seguridad durante el período de trabajo con sustancias nocivas; en la vida cotidiana: cuando hay un uso erróneo o incorrecto de productos químicos domésticos, en caso de automedicación con medicamentos, su sobredosis o su uso erróneo, con intoxicación por alcohol y drogas, picaduras de insectos venenosos y serpientes; errores medicos 2. Envenenamiento intencional: envenenamiento suicida (verdadero o demostrativo) y envenenamiento criminal (con el objetivo de matar o llevar a un estado de indefensión); "policía" (cuando se utilizan productos químicos y venenos para restaurar el orden público) y lucha contra el envenenamiento (cuando se utilizan armas químicas), incluso como resultado de actos terroristas. Según el número de víctimas se distinguen las intoxicaciones agudas individuales, grupales y masivas. La ingesta de una sustancia tóxica es posible a través de la boca (incorporado, oral), a través de las vías respiratorias (inhalación), piel sin protección (percutánea), por inyección parenteral, o cuando se inyecta en el recto, vagina, conducto auditivo externo. En el curso clínico de la intoxicación aguda se distinguen dos etapas: toxicogénica y somatogénica. La esencia de la etapa tóxica es que la sustancia activa en el cuerpo tiene una dosis que puede causar un efecto tóxico específico. La etapa somatogénica ocurre después de la eliminación o destrucción de la sustancia tóxica y se manifiesta en forma de "rastro" o violaciones residuales del estado estructural y funcional de los órganos y sistemas. Principios generales para el diagnóstico de intoxicaciones agudas 1. El diagnóstico clínico se basa en los siguientes datos: 1) inspección de la escena para el descubrimiento de evidencia material de envenenamiento; 2) anamnesis de las palabras de la víctima u otras personas: puede averiguar qué sustancia tóxica tomó la víctima, el momento de tomar la sustancia tóxica, la dosis de la sustancia tóxica tomada, la ruta de penetración de la sustancia tóxica en el cuerpo , las circunstancias que acompañaron el desarrollo del envenenamiento, etc .; 3) estudiar el cuadro clínico de la enfermedad para identificar síntomas específicos de intoxicación que son característicos de una determinada sustancia tóxica o grupo de sustancias según el principio de "toxicidad selectiva". 2. El diagnóstico toxicológico de laboratorio tiene como objetivo la determinación cualitativa o cuantitativa de sustancias tóxicas en los medios biológicos del cuerpo (sangre, orina, etc.). 3. El diagnóstico anatomopatológico consiste en la detección post-mortem de signos concretos de intoxicación y es realizado por peritos forenses. 1. Intoxicación por alcohol metílico El alcohol metílico se absorbe por todas las vías: respiratoria, digestiva y percutánea. La dosis letal de metanol cuando se toma por vía oral oscila entre 40 y 250 ml, pero tomar incluso 10 o 20 ml puede causar ceguera. El envenenamiento también ocurre después de tomar varias mezclas alcohólicas que contienen de 1,5 a 2,5% de metanol. Después de la absorción, el metanol se distribuye por todos los tejidos debido a su solubilidad en agua. La mayor cantidad se acumula en los riñones y el tracto gastrointestinal, la menor en el cerebro, los músculos y el tejido adiposo. Las lesiones anatómicas patológicas incluyen edema cerebral y daño a la naturaleza inicialmente inflamatoria y luego distrófica de las células ganglionares de la retina. En algunos casos, además del daño al sistema nervioso, se encuentran lesiones degenerativas del hígado, riñones, pulmones y músculo cardíaco. Cuadro clínico En el efecto tóxico del metanol se puede distinguir una acción bifásica. En el período inicial (fase I), el metanol actúa sobre el cuerpo como una molécula completa y tiene un efecto predominantemente narcótico, pero más débil que el del alcohol etílico. Posteriormente (fase II), se manifiesta el efecto nocivo de los productos de oxidación. En el cuadro clínico, se distinguen períodos: intoxicación, bienestar latente o relativo (que dura desde varias horas hasta 1-2 días), las principales manifestaciones de intoxicación y, con un resultado favorable, desarrollo inverso. Según la gravedad, se distinguen leves, moderadas (u oftálmicas) y graves (o generalizadas). Con el envenenamiento leve, se notan fatiga rápida, dolor de cabeza, náuseas y un estado de intoxicación leve, que ocurren después de un período de latencia de 30 minutos a varias horas. La absorción simultánea de alcohol etílico y metílico aumenta el período de latencia y reduce la gravedad de la intoxicación. En caso de intoxicación moderada, después de un breve período de latencia, el paciente desarrolla dolor de cabeza, mareos, dolor agudo en el abdomen (principalmente en la región epigástrica), vómitos, inquietud, delirio, convulsiones. Finalmente, se establece un coma profundo. El paciente tiene hipotermia, en algunos casos, cianosis, cuando se desarrolla insuficiencia respiratoria de naturaleza central, seguida de insuficiencia cardiovascular. En esta etapa, las pupilas se dilatan y el estudio del fondo de ojo indica la presencia de edema retiniano. Los trastornos visuales característicos, como la reducción de la agudeza visual, el estrechamiento del campo, las pupilas dilatadas, la pérdida de reflejos a la luz, el dolor en el globo ocular ocurren del segundo al sexto día. El examen del fondo de ojo revela signos de atrofia del nervio óptico. La complicación más grave es la ceguera total. tratamiento El tratamiento incluye los siguientes puntos. 1. Detener la entrada de veneno en el cuerpo. Cese del uso de veneno, eliminación de la atmósfera contaminada, eliminación del veneno de la piel. 2. Eliminación de veneno no absorbido (del tracto gastrointestinal): 1) sonda de lavado gástrico; 2) el uso de adsorbentes o laxantes salinos; 3) enema de limpieza o sifón. 3. Eliminación del veneno absorbido: 1) diuresis forzada; 2) métodos de desintoxicación extracorpórea (hemosorción, hemodiálisis, diálisis peritoneal, operación de reemplazo de sangre). 4. Terapia con antídotos, es decir, neutralización del veneno debido a la neutralización física o química, así como la competencia con el veneno por los puntos de aplicación. 6. Mantener las funciones vitales del cuerpo. 7. Normalización del agua-electrolito, estado ácido-base del cuerpo. 8. Tratamiento de consecuencias y complicaciones a largo plazo. Lavado gástrico con agua o solución de bicarbonato de sodio al 2%, seguido de ingestión de 30 g de sulfato de magnesio (sodio) en 100 ml de agua. Por vía subcutánea 2 ml de cordiamina, 1 ml de solución de cafeína al 20%. En coma, por vía intravenosa, una solución al 5% de alcohol etílico en una solución de glucosa al 5% a razón de 1,5-2 g de alcohol por 1 kg de peso del paciente por día. Por vía intravenosa 400 ml de poliglucina (reopoliglucina), 50-100 mg de prednisolona, mezcla de glucosana-vocaína (400 ml de solución de glucosa al 5 % con 25 ml de solución de novocaína al 2 %), 80-120 mg de furosemida (lasix), 40 ml de 40% - solución de glucosa con 8 UI de insulina. 2. Intoxicación por alcohol etílico Clinica Al tomar dosis tóxicas: agitación, ataxia, estupor, coma con inhibición de los reflejos, olor a alcohol de la boca, enrojecimiento de la cara, conjuntivitis, "juego" de las pupilas, vómitos, micción involuntaria, taquicardia, respiración "ronca". , colapso, vómitos con posible aspiración de peso emético. tratamiento Lavado gástrico a través de una sonda gruesa, seguido de la introducción de un laxante salino, enema de sifón. Por vía subcutánea, 1 ml de una solución de atropina al 0,1%, 2 ml de cordiamina, 1 ml de una solución de cafeína al 20%, con colapso, por vía intramuscular, 1 ml de una solución de mezaton al 1%. En ausencia de reflejos faríngeos: intubación traqueal y ventilación mecánica. Forzar la diuresis con la administración simultánea de una solución de bicarbonato de sodio al 4% en un volumen calculado según la fórmula de Astrup, soluciones de glucosa hipertónica (10 y 20%) con insulina, vitaminas B y C, cocarboxilasa, ácido nicotínico. Con depresión respiratoria: por vía intravenosa lentamente 3-5 ml de una solución de etimizol al 1,5%, 10 ml de una solución de aminofilina al 2,4%, 1 ml de una solución de efedrina al 5%, inhalación de oxígeno. Con aspiración - broncoscopia de saneamiento de emergencia. Antibióticos parenterales. 3. Intoxicación con etilenglicol (anticongelante) La dosis letal media es de aproximadamente 100 ml. Se absorbe rápidamente en el tracto digestivo y se distribuye a todos los tejidos, creando una concentración máxima en el cerebro. El principal efecto tóxico se observa en el parénquima renal, donde se desarrolla necrosis del epitelio tubular, edema intersticial y focos de necrosis hemorrágica en la capa cortical. El edema se encuentra en el cerebro. Clinica En la clínica de la intoxicación se distinguen 3 períodos: 1) inicial: con una duración de hasta 12 horas, predominan los síntomas de daño del SNC por el tipo de intoxicación por alcohol; 2) neurotóxico - cuando los síntomas del daño del SNC progresan y se juntan los desórdenes del sistema respiratorio y cardiovascular; 3) nefrotóxico: en el segundo al quinto día, el daño renal predomina en el cuadro clínico de intoxicación. La duración y severidad de los períodos de intoxicación depende de la severidad del envenenamiento. En casos leves, después de un período de intoxicación (10-15 horas), se desarrolla un ligero malestar, dolor de cabeza y náuseas. La conciencia permanece clara, no se observa daño renal. En caso de envenenamiento de gravedad moderada, en el contexto de síntomas de intoxicación, se producen vómitos, diarrea, dolor en la región epigástrica y dolor de cabeza. En el día 3-5, aparecen síntomas de daño renal. En el envenenamiento severo, la pérdida de la conciencia ocurre rápidamente, rigidez en el cuello, convulsiones clónico-tónicas, fiebre, respiración profunda ruidosa, colapso y edema pulmonar. Si el paciente no muere el primer día, los síntomas de insuficiencia renal se desarrollan a partir del 2-3er día: aparece sed, dolor de espalda, disminuye la cantidad de orina, hasta anuria. El hígado está agrandado, doloroso. La muerte proviene de la uremia. tratamiento Lavado gástrico con agua o solución de bicarbonato de sodio al 2%, seguido de la introducción de 30 g de sulfato de magnesio en 200 ml de agua. Dentro de 200 ml de una solución al 30% de alcohol etílico. 3-5 g de bicarbonato de sodio en 100 ml de agua. Bebida abundante. Intramuscularmente 1-2 ml de cordiamina, 1 ml de una solución de cafeína al 20%. Por vía intravenosa 400 ml de solución de glucosa al 5% con 5 ml de solución de ácido ascórbico al 5% y 8 unidades de insulina, mezcla de glucosana-vocaína, 400 ml de poliglucina, 400 ml de hemodez, 80-120 g de furosemida, 60-100 mg de prednisolona 4. Intoxicación por dicloroetano Las principales vías de entrada son el tracto digestivo, el tracto respiratorio y la piel. La dosis letal de DCE para humanos cuando se administra por vía oral es de 10-20 ml. El efecto tóxico de DCE se debe al efecto narcótico sobre el sistema nervioso central, daño al hígado, riñones, tracto gastrointestinal y un efecto pronunciado sobre el sistema cardiovascular. Clinica En el cuadro clínico, los síntomas principales son: encefalopatía tóxica, gastritis y gastroenteritis tóxicas agudas, alteración de la respiración externa, hepatitis tóxica, insuficiencia renal. En las primeras horas tras la administración aparecen mareos, ataxia, agitación psicomotora, convulsiones clónico-tónicas, depresión de la conciencia, hasta llegar al coma. Uno de los primeros signos de intoxicación son los trastornos gastrointestinales en forma de náuseas, vómitos repetidos con una mezcla de bilis. La violación de la función de la respiración externa a menudo ocurre según el tipo de aspiración obstructiva y se asocia con un aumento de la salivación, la broncorrea y la aspiración. Se observa la inhibición de la función del centro respiratorio, el desarrollo de hipertonicidad de los músculos respiratorios y rigidez del tórax. Una complicación grave es el shock exotóxico, que se manifiesta por enfriamiento y cianosis de la piel, sudor frío, dificultad para respirar, taquicardia e hipovolemia. Disminución de la función excretora de los riñones. Según la gravedad del envenenamiento por DCE se dividen en los siguientes. 1. Intoxicación leve, caracterizada por el desarrollo de trastornos dispépticos, síntomas neurológicos leves y hepatopatía leve. 2. Envenenamiento moderado. Ocurre con síntomas de gastritis tóxica, gastroenteritis, encefalopatía tóxica, hepatopatía moderada, nefropatía leve. 3. El envenenamiento severo ocurre con manifestaciones severas de encefalopatía tóxica, hepatopatía severa, nefropatía tóxica, gastroenteritis. En caso de intoxicación por vapor, dolor de cabeza, somnolencia, sabor dulce en la boca, olor a veneno de la boca, irritación de las membranas mucosas, pérdida del conocimiento, insuficiencia hepática renal aguda con coloración amarillenta de la esclerótica y la piel, agrandamiento del hígado , se produce anuria. Cuando se ingiere: vómitos repetidos, dolor abdominal, heces blandas con olor a veneno, hiperemia de la esclerótica, agitación psicomotora, seguida de depresión y coma, colapso, shock tóxico, síndrome hemorrágico, insuficiencia hepática renal aguda. Cuando el veneno entra en contacto con la piel, se desarrolla dermatitis. tratamiento En caso de envenenamiento con vapores: extracción de la víctima del área afectada, con depresión respiratoria IVL. Si el veneno ingresa: lavado gástrico a través de una sonda gruesa, seguido de la introducción de 3-4 cucharadas de carbón activado en polvo en 200 ml de agua y 150-200 ml de aceite de vaselina, enema de sifón. Por vía intravenosa 20-40 ml de una solución al 30% de tiosulfato de sodio, por vía intramuscular 5 ml de una solución al 5% de unitiol. por vía intravenosa 400 ml de poliglucina, 400 ml de hemodez, 400 ml de solución de glucosa al 5%, 80-120 mg de furosemida (lasix), 6-8 ml de solución de ácido ascórbico al 5%. Por vía intramuscular, 2 ml de cordiamina, con colapso: 1 ml de una solución de mezaton al 1%, 1 ml de una solución de cafeína al 20%, 100-150 mg de prednisolona. Con un aumento de la insuficiencia hepática-renal, se lleva a cabo una terapia específica. Bolo intravenoso 400 ml de poliglucina, 400 ml de gemodez, 400 ml de glucosa al 5%, 80-120 mg de furosemida, 6-8 ml de ácido ascórbico al 5%, 100-150 mg de prednisolona, con colapso 1 ml de 1% mezatón. Por vía intramuscular 2-4 ml de bromuro de tiamina al 6% y 2-4 ml de piridoxina al 5%. Con agitación psicomotora, 1 ml de una solución de fenozepam al 3%. Inhalación de oxígeno, con depresión respiratoria - IVL a través de un tubo de respiración. Durante el primer día, el método más efectivo y económico es la diálisis peritoneal. La composición de la solución de diálisis estándar incluye: cloruro de potasio 0,3 g, cloruro de sodio 8,3 g, cloruro de magnesio 0,1 g, cloruro de calcio 0,3 g, glucosa 6 g por 1 litro de agua. Al mismo tiempo, se inyectan hasta 2 litros de solución electrolítica con la adición de 500 mil unidades de penicilina y 1000 unidades de heparina en la cavidad abdominal del paciente. En la fase somatogénica de la intoxicación, la terapia principal está dirigida a tratar las complicaciones desarrolladas: neumonía, hepatopatía, etc. 5. Envenenamiento con hongos venenosos (agárico de mosca, hongos falsos, colmenillas, somormujo pálido) Clinica Después de un período de latencia que dura de 1 a 2 a 36 horas, aparecen dolores abdominales tipo cólico, salivación, náuseas, vómitos indomables, diarrea, deshidratación, colapso, delirio, alucinaciones, convulsiones. En el día 2-3: los fenómenos de insuficiencia renal y hepática con anuria, azotemia, ictericia. En el envenenamiento severo con líneas y colmenillas, es posible la hemólisis. tratamiento Lavado gástrico a través de un tubo grueso, seguido de la introducción de 3-4 cucharadas de carbón activado en polvo en 200 ml de agua y 30 g de sulfato de magnesio (sodio) en 100 ml de agua, enema de sifón. Por vía subcutánea 1 ml de una solución de atropina al 0,1%, 2 ml de cordiamina. En el envenenamiento por morillas, la atropina no se usa como antídoto. Por vía intravenosa 400 ml de poliglucina, 400 ml de gemodez, 400 ml de solución de glucosa al 5% con 4-6 ml de solución de ácido ascórbico al 5%, 80-120 mg de furosemida (lasix). Intramuscularmente 1-2 ml de una solución al 6% de bromuro de tiamina y 2 ml de una solución al 5% de clorhidrato de piridoxina (no inyectar en una jeringa). Alivio del síndrome de dolor por vía intramuscular con la introducción de 1 ml de una solución al 0,2% de platifilina, 2 ml de una solución al 2% de papaverina. Con convulsiones, agitación psicomotora: por vía intramuscular, 1-2 ml de una solución de fenozepam al 3% o una mezcla lítica (1-2 ml de una solución de aminazina al 2,5%, 1-2 ml de una solución de difenhidramina al 1%, 5-10 ml de solución de sulfato de magnesio al 25 %) bajo control de la presión arterial. Forzar la diuresis. En casos graves: hemosorción, hemodiálisis temprana. En caso de intoxicación grave con hilos y morillas, en caso de hemólisis grave y ausencia de posibilidad de hemodiálisis, se realiza una cirugía de reemplazo de sangre. Corrección de la acidosis mediante la administración intravenosa de una solución de bicarbonato de sodio al 4% en un volumen determinado según la fórmula de Astrup. Antibióticos: bencilpenicilina hasta 10 millones de unidades por día. Terapia sintomática. Con insuficiencia hepática y renal en aumento: terapia de infusión con una solución de glucosa al 5-10% con insulina, vitaminas B y C, 20-30 mil UI de heparina, aminofilina. 6. Envenenamiento por veneno de serpiente Clinica Dolor e hinchazón que se extiende rápidamente en el sitio de la picadura, somnolencia, depresión respiratoria, colapso, hemólisis intravascular con hemoglobinuria, hemorragias subcutáneas graves, a veces convulsiones. Posiblemente insuficiencia renal. Con una mordedura de cobra, los cambios locales son menos pronunciados, predominan los trastornos bulbares (trastornos del habla y la deglución, ptosis, parálisis de los músculos motores) y depresión respiratoria. Muestra reposo completo en posición horizontal. Exprimir las primeras gotas de sangre de la herida. Inmovilización del miembro lesionado. En lugar de la picadura - frío. Bebida abundante. tratamiento Succión de sangre y linfa de la herida (a más tardar 30-60 minutos después de la picadura), formada en el sitio de la picadura, utilizando un frasco para chupar sangre. Lavar la herida con solución de permanganato de potasio al 1%. Introducción a la herida 0,3-0,5 ml de una solución de adrenalina al 0,1%. Si es posible, introducción urgente de un suero antiserpiente específico mono o polivalente después de una inyección intravenosa preliminar de 100-150 ml de hidrocortisona o 50-100 ml de prednisolona. En caso de mordeduras de cobra: suero Anticobra intravenoso a una dosis de 300 ml en combinación con 1 ml de una solución de prozerina al 0,05% y administración repetida cada 30 minutos con 1 ml de una solución de atropina al 0,1%. Profilácticamente: suero antitetánico según Bezredka, mezcla polarizante intravenosa, 10-15 mil UI de heparina, 1-2 ml de solución de difenhidramina al 1%, 10 ml de solución de cloruro de calcio al 10% (gluconato), 5-10 ml de 5 % - solución de ácido ascórbico, 50-100 mg de prednisolona o 100-150 mg de hidrocortisona, 400 ml de gemodez, 400 ml de poliglucina, 40-80 mg de lasix. Alivio del dolor mediante la administración intravenosa de 1 ml de una solución al 2% de promedol. En insuficiencia respiratoria aguda: ventilación mecánica a través de un tubo de respiración, inhalación de oxígeno. En toxicosis severa - hemosorción, con la progresión de insuficiencia hepática-renal - hemodiálisis en combinación con hemosorción. Terapia sintomática. 7. Intoxicación con ácidos concentrados (nítrico, acético, sulfúrico) Clinica La inhalación de vapores causa irritación de los ojos y del tracto respiratorio superior (lagrimeo, secreción nasal, tos, dificultad para respirar). El paro respiratorio reflejo es posible. Después de un período de latencia (de 2 a 24 horas), se forma neumonía tóxica o edema pulmonar tóxico. Con el impacto en los ojos, en la piel - las quemaduras químicas. Cuando se ingiere: una quemadura química de la cavidad oral, faringe, esófago, estómago, posible hinchazón de la laringe con insuficiencia respiratoria. Vómitos repetidos con sangre, irritación peritoneal y ocasionalmente perforación del esófago o del estómago. Colapso, shock, síndrome hemorrágico. Posible hemólisis intravascular, nefrosis hemoglobinúrica con insuficiencia renal aguda (renal-hepática). El lavado gástrico sin sonda y el vómito artificial son peligrosos debido a la posibilidad de volver a quemar el esófago y la aspiración de ácido. No inyectar laxantes salinos y soluciones alcalinas. tratamiento Lavado gástrico a través de un tubo grueso con agua fría después de una inyección intravenosa o intramuscular preliminar de 1-2 ml de una solución de promedol al 2%. En el interior de trozos de hielo, Almagel A 15-20 ml cada hora. Por vía intravenosa 800 ml de poliglucina, 400 ml de hemodez, mezcla de glucosona-vocaína (400 ml de solución de glucosa al 5% con 25 ml de solución de novocaína al 2%), 50-150 mg de prednisolona o 150-250 mg de hidrocortisona, 10 mil unidades de heparina, 80-120 mg de furosemida (Lasix). El alivio del síndrome de dolor se logra por vía intravenosa con la introducción de 1-2 ml de una solución de fentanilo al 0,005% y 2-4 ml de una solución de droperidol al 0,25%, con dolor persistente en el abdomen - por vía intramuscular 1-2 ml de una Solución al 0,2% de platyfillin, 2 ml de solución de papaverina al 2%. Inhalación de oxígeno con un antiespumante. Con edema laríngeo creciente: por vía intravenosa, 200-400 mg de prednisolona, 1-2 ml de una solución al 1% de difenhidramina, 10-20 ml de una solución al 2,4% de aminofilina, 1-2 ml de una solución al 5% de efedrina. En ausencia de efecto - traqueotomía, inhalación de oxígeno, según indicaciones - ventilación mecánica. 8. Envenenamiento con arsénico y sus compuestos Clinica Hay un sabor metálico en la boca, dolor abdominal, vómitos, heces blandas, deshidratación severa, convulsiones, taquicardia, disminución de la presión arterial, coma, insuficiencia renal aguda. El envenenamiento por hidrógeno con arsénico desarrolla hemólisis intravascular, hemoglobinuria. tratamiento Lavado gástrico a través de una sonda gruesa (2-3 veces al día) con la introducción al principio y al final del lavado de 50 ml de una solución al 5% de unitiol, enemas de sifón repetidos con la adición de unitiol. Continuación de la terapia con antídoto por vía intravenosa o intramuscular con la introducción de una solución de unitiol al 5% (hasta 300 ml por día), goteo intravenoso de 20 ml de tetacina de calcio al 10% (ED1A) en 400 ml de una solución de glucosa al 5%. En caso de envenenamiento con hidrógeno de arsénico, por vía intramuscular, 1-2 ml de una solución de mecaptida al 40% (hasta 6-8 ml por día). Diuresis forzada con la administración simultánea de soluciones poliiónicas hipertónicas (solución de glucosa al 10-20%), solución de bicarbonato de sodio al 4% en un volumen calculado según la fórmula de Astrup, mezcla de glucosana y vocal, aminofilina, vitaminas B y C, citocromo C. En envenenamiento severo - hemodiálisis temprana. En el proceso de hemodiálisis, se inyecta por vía intravenosa una solución de unitiol al 5% (30-40 ml / h para intoxicación grave, 20-30 ml / h para intoxicación moderada). En la hemólisis aguda y la imposibilidad de la hemodiálisis, se realiza una operación de reemplazo de sangre. 9. Envenenamiento por lejía Clinica Cuando se ingiere, se desarrolla una quemadura química de la membrana mucosa de la cavidad oral, el esófago y el estómago. Dolor a lo largo del esófago y en el abdomen, vómitos con una mezcla de sangre, sangrado esofágico-gástrico. Posible perforación del esófago, estómago con desarrollo de mediastinitis, peritonitis. Con una quemadura de la laringe: ronquera, afonía, dificultad (estridor) para respirar. En casos severos: shock por quemadura, oliguria. El contacto con la piel provoca quemaduras químicas. tratamiento Tratar como en el envenenamiento por ácido. 10. Envenenamiento por atropina Clinica Boca seca, ronquera, piel seca e hiperémica, pupilas dilatadas, dificultad para respirar, palpitaciones, taquicardia, sed, náuseas, dificultad para orinar. En intoxicaciones graves: son posibles la agitación psicomotora, el delirio, las alucinaciones, las convulsiones, las alteraciones del ritmo cardíaco, el coma y el colapso. tratamiento Si es necesario, lavado gástrico a través de una sonda gruesa, abundantemente lubricada con aceite de vaselina, la introducción de 3-4 cucharadas. yo carbón activado en polvo en 200 ml de agua y 30 mg de sulfato de magnesio en 100 ml de agua. por vía intravenosa 2-4 ml de solución de proserina al 0,05%, 400-800 ml de solución de glucosa al 5%, 40-80 mg de furosemida (lasix). Bebida abundante. Alivio de la agitación psicomotora y de las convulsiones por vía intramuscular con la introducción de 1-2 ml de una solución de fenozepam al 3% o de una mezcla lítica (2 ml de una solución de clorpromazina al 2,5%, 2 ml de una solución de difenhidramina al 1% y 10 ml de una solución al 25% de sulfato de magnesio) o 1-2 g de hidrato de cloral en un enema con 1-2 g de almidón por 25-50 ml de agua, por vía intravenosa 10-15 ml de una solución de hidroxibutirato de sodio al 20%, 2-4 ml de una solución al 0,5% de seduxen. Con taquicardia severa, extrasístole: anaprilina por vía intravenosa (1-2 ml de una solución al 0,25%) o una tableta de anaprilina (40 mg) debajo de la lengua. Con colapso: por vía intravenosa, 1 ml de una solución de mezaton al 1% en 10 ml de una solución de cloruro de sodio al 0,9%. Con una hipertermia aguda: intramuscularmente, 2 ml de una solución al 50% de analgin, bolsas de hielo en grandes vasos y la cabeza, envolturas húmedas. 11. Intoxicación por cáñamo (hachís, marihuana, marihuana, plan) Clinica Hay euforia, agitación psicomotora, alucinaciones visuales vívidas, pupilas dilatadas, tinnitus. Posteriormente, debilidad, letargo, depresión del estado de ánimo, somnolencia, bradicardia, hipotermia. tratamiento En caso de intoxicación oral: lavado gástrico a través de un tubo grueso, seguido de la introducción de 3-4 cucharadas de carbón activado en polvo en 200 ml de agua. Por vía intravenosa 400-800 ml de una solución de glucosa al 5% con 5-10 ml de una solución de ácido ascórbico al 5% y 8-16 unidades de insulina, 40-80 mg de furosemida (lasix), por vía intramuscular 2 ml de una solución al 6% de bromuro de tiamina. Con una excitación aguda: por vía intramuscular, 3-5 ml de una solución de clorpromazina al 2,5% o una mezcla lítica (2 ml de una solución de clorpromazina al 2,5%, 1-2 ml de una solución de difenhidramina al 1% y 5-10 ml de 25 % - una solución de sulfato de magnesio) bajo el control de la presión arterial. inhalación de oxígeno Diuresis forzada. En casos severos recurrir a la hemosorción. 12. Envenenamiento por cocaína y dicaína Clinica Se manifiesta clínicamente por agitación general, dolor de cabeza, enrojecimiento de la cara, pupilas dilatadas, taquicardia, aumento de la respiración, aumento de la presión arterial, alucinaciones. En casos severos: convulsiones, coma, parálisis respiratoria, colapso. tratamiento Lavado gástrico repetido a través de una sonda gruesa con una solución de permanganato de potasio al 0,1%, seguido de la introducción de 3-4 cucharadas. yo carbón activado en polvo en 200 ml de agua y 30 g de sulfato de magnesio en 100 ml de agua. Por vía intravenosa 400 ml de gemodez, 400 ml de solución de glucosa al 5% con 5-10 ml de solución de ácido ascórbico al 5%, 40-80 mg de furosemida (lasix). Cuando está excitado, fijando a la víctima, intramuscularmente 1-2 ml de una solución al 3% de fenozepam o una mezcla lítica (1-2 ml de una solución al 2,5% de clorpromazina, 2 ml de una solución al 1% de difenhidramina y 5-10 ml del 25% - una solución de sulfato de magnesio) bajo el control de la presión arterial. Con convulsiones, se administran 1-2 g de hidrato de cloral en un enema con 1-2 g de almidón en 25-50 ml de agua, lentamente por vía intravenosa 15-20 ml de una solución de oxibutirato de sodio al 20%, si no hay efecto, lentamente por vía intramuscular hasta 20 ml de solución al 2,5% de tiopental sódico o hexenal. Con el desarrollo de un coma: una bolsa de hielo en la cabeza, 40 ml por vía intravenosa de una solución de glucosa al 40% con 4-6 ml de una solución de ácido ascórbico al 5% y 8 unidades de insulina, por vía intravenosa lentamente o por vía intramuscular 2-4 ml de una solución al 6% de bromuro de tiamina y 2-4 ml de una solución al 5% de clorhidrato de piridoxina, 80-120 mg de furosemida. Con depresión respiratoria severa, se realiza ventilación mecánica, por vía intravenosa lentamente 2 ml de cordiamina, inhalación de oxígeno. 13. Intoxicación con analgésicos narcóticos (morfina, omnopon, droperidol) Clinica Somnolencia o inconsciencia, constricción pupilar, hipertonicidad muscular (a veces convulsiones), depresión respiratoria, bradicardia, colapso. La parálisis respiratoria es posible con la conciencia del paciente preservada. tratamiento Lavado gástrico a través de una sonda gruesa (manteniendo la conciencia), seguido de la introducción de 3-4 cucharadas de carbón activado en polvo y 30 g de sulfato de sodio, enema de sifón. Por vía intravenosa 400 ml de gemodez, 400 ml de poliglucina, 400 ml de solución de glucosa al 5%, 60-80 mg de furosemida (lasix). Por vía subcutánea 1-2 ml de una solución de atropina al 0,1%, 1-2 ml de cordiamina, 1 ml de una solución de cafeína al 20%. Con el desarrollo de un coma, una bolsa de hielo en la cabeza, por vía intravenosa 40 ml de una solución de glucosa al 40% con 5-10 ml de una solución de ácido ascórbico al 5% y 8 unidades de insulina, por vía intravenosa lentamente o por vía intramuscular 2-4 ml de una solución al 6% de bromuro de tiamina y 2-4 ml de una solución al 5% de clorhidrato de piridoxina, 80-120 mg de furosemida (lasix). Si es necesario, cateterismo vesical y extracción de orina. Con depresión respiratoria - IVL, inhalación de oxígeno. Hemosorción (2-3 veces al día hasta que se restablezca la conciencia). Conferencia No. 11. Dolor y analgésicos 1. Dolor El dolor es un estado sensorial y emocional desagradable causado por efectos patológicos reales o potenciales en los tejidos. En el SNC, el dolor se conduce a lo largo de dos vías principales. Ruta específica: los cuernos posteriores de la médula espinal, núcleos específicos del tálamo, la corteza de la circunvolución central posterior. Esta vía es neurológica baja, rápida, de umbral de conductas, emocionalmente incolora, dolor localizado con precisión (dolor epicrítico). Manera no específica: los cuernos posteriores de la médula espinal, los núcleos no específicos del tálamo, la corteza de los lóbulos frontal y parietal de forma difusa. Conduce dolor subumbral, coloreado emocionalmente, pobremente localizado. Es lento, multineuronal, ya que forma numerosas colaterales al bulbo raquídeo, la formación reticular, el sistema límbico y el hipocampo. Los impulsos dolorosos subliminales se suman en el tálamo. Los impulsos conducidos a lo largo de la vía del dolor inespecífico excitan los centros emocionales del sistema límbico, los centros autónomos del hipotálamo y el bulbo raquídeo. Por lo tanto, el dolor se acompaña de miedo, experiencias dolorosas, aumento de la respiración, pulso, aumento de la presión arterial, dilatación de las pupilas, trastornos dispépticos. La acción del sistema de dolor nociceptivo es contrarrestada por el sistema antinoceceptivo, cuyas neuronas principales se localizan en la sustancia gris periacueductal (el acueducto de Silvio conecta los ventrículos III y IV). Sus axones forman vías descendentes hacia el bulbo raquídeo y la médula espinal y vías ascendentes hacia la formación reticular, el tálamo, el hipotálamo, el sistema límbico, los ganglios basales y la corteza. Los mediadores de estas neuronas son pentapéptidos: metencefalina y leuencefalina, que tienen metionina y leucina como aminoácidos terminales, respectivamente. Las encefalinas excitan los receptores de opiáceos. En las sinapsis encefalinérgicas, los receptores de opiáceos se encuentran en la membrana postsináptica, pero la misma membrana es presináptica para otras sinapsis. Los receptores de opiáceos están asociados con la adenilato ciclasa y causan su inhibición al interrumpir la síntesis de AMPc en las neuronas. Como resultado, disminuye la entrada de calcio y la liberación de mediadores, incluidos los mediadores del dolor: péptidos: sustancia P, colecistoquinina, somatostatina, ácido glutámico. Los receptores de opiáceos son excitados no solo por mediadores, las encefalinas, sino también por otros componentes del sistema antinoceceptivo, las hormonas cerebrales (endorfinas). Los agonistas peptídicos de los receptores opiáceos se forman durante la proteólisis de las sustancias peptídicas del cerebro: proopiocortina, proencefalinas A y B. Todos estos péptidos se forman en el hipotálamo. Los receptores de opiáceos excitan a los receptores en todas las estructuras cerebrales involucradas en la conducción y percepción del dolor, la formación de reacciones emocionales al dolor. Al mismo tiempo, disminuye la liberación de mediadores del dolor y se debilitan todas las reacciones que acompañan al dolor. 2. Fármacos analgésicos Un analgésico (ácido acetilsalicílico, paracetamol, morfina) es un fármaco que reduce el dolor de diversos orígenes. Los medicamentos que reducen el dolor provocado solo por un determinado factor causal o eliminan un síndrome de dolor específico, por ejemplo, antiácidos, ergotamina (migraña), carbamazepina (neuralgia), nitroglicerina (angina de pecho), no pertenecen a los analgésicos clásicos. Los corticosteroides suprimen la respuesta inflamatoria y el dolor resultante, pero a pesar de su uso generalizado para estos fines, tampoco representan los analgésicos clásicos. Los analgésicos se clasifican en narcóticos, que actúan sobre las estructuras del SNC y provocan somnolencia, como los opioides, y no narcóticos, que actúan principalmente sobre las estructuras periféricas, como el paracetamol, el ácido acetilsalicílico. Medicamentos adicionales que mejoran el efecto de los analgésicos. Los fármacos de este grupo no son analgésicos propiamente dichos, sino que se utilizan combinados con analgésicos para el dolor, ya que pueden modificar la actitud ante el dolor, su percepción y nivel de ansiedad, miedo, depresión (los antidepresivos tricíclicos pueden incluso provocar una disminución de la necesidad de morfina en un paciente en estado terminal). Dichos medicamentos pueden ser medicamentos psicotrópicos, así como aquellos que afectan los mecanismos del dolor, por ejemplo, eliminando el espasmo de los músculos lisos y estriados. Los analgésicos narcóticos son drogas a base de hierbas y sintéticas que reducen selectivamente la percepción del dolor, aumentan la tolerancia al dolor al reducir la coloración emocional del dolor y su acompañamiento vegetativo, causan euforia y dependencia de las drogas. Los analgésicos narcóticos reducen la conducción y la percepción del dolor solo dentro de los límites del sistema nervioso central, suprimiendo principalmente la vía inespecífica. Los medios de este grupo excitan los receptores de opiáceos, crean una acción similar a los efectos de los péptidos del sistema anti-noreceptivo. Por tanto, los principales mecanismos de la anestesia son los siguientes: un trastorno en la conducción de un impulso doloroso desde el axón de la neurona I, cuyo cuerpo se localiza en el ganglio espinal, hasta la neurona II, situada en la sustancia gelatinosa de las astas posteriores del la medula espinal. Supresión de la suma de impulsos subumbrales en el tálamo. Disminución de la participación en la reacción de dolor del bulbo raquídeo, hipotálamo, sistema límbico (actitud no acentuada ante el dolor). Clasificación de los analgésicos narcóticos y sus antagonistas. La clasificación es la siguiente. 1. Derivados de piperidina-fenantreno: 1) morfina; 2) codeína (metilmorfina, 5-7 veces más débil que la morfina como analgésico); 3) etilmorfina (dionina, igual en fuerza a la morfina). 2. Derivados de fenilpiperidina: 1) promedol (3-4 veces más débil que la morfina); 2) fentanilo (100-400 veces más fuerte que la morfina). 3. Derivados del difenilmetano: 1) piritramida (dipidolor) - igual a la morfina; 2) tramadol (tramal) - algo inferior a la morfina. 4. Agonistas-antagonistas: 1) agonistas de los receptores de opiáceos y antagonistas de los receptores de opiáceos: buprenorfina (norfina) (25-30 veces más fuerte que la morfina); 2) agonistas de los receptores de opiáceos y antagonistas de los receptores de opiáceos: pentazocina (lexir) (2-3 veces más débil que la morfina) y butorfanol (moradol) (igual a la morfina). Los agonistas-antagonistas son mucho menos probables y más débiles que los agonistas completos para causar euforia y drogodependencia. Narorfina: sola (por ejemplo, con envenenamiento por barbitúricos) y con envenenamiento leve por morfina, tiene un efecto analgésico, causa miosis, bradicardia y exacerba la depresión del centro respiratorio. En intoxicaciones graves con morfina y otros agonistas, los desplaza de los receptores opiáceos del centro respiratorio y restablece la respiración. Provoca disforia, irritabilidad, depresión, dificultad para enfocar la mirada. Antagonistas completos de los receptores opioides La naloxona no tiene acción independiente, es eficaz como antídoto para el envenenamiento con analgésicos narcóticos. Los analgésicos narcóticos deben usarse solo para el dolor agudo durante un período breve. Se usa con mayor frecuencia para lesiones, quemaduras, infarto de miocardio, peritonitis (después de aclarar el diagnóstico y decidir sobre la operación). Los analgésicos narcóticos forman parte de las mezclas líticas para la potenciación de la anestesia. Los medicamentos de este grupo se usan para el dolor posoperatorio en combinación con anticolinérgicos M y antiespasmódicos miotrópicos. Se prescriben para detener cólicos hepáticos (pentazocina) y renales (promedol). El dolor crónico es una contraindicación para la prescripción de medicamentos, con la excepción de formas avanzadas de un tumor maligno (dipidolor, tramadol, agonistas-antagonistas). Los analgésicos narcóticos se combinan con fármacos psicotrópicos para tipos especiales de anestesia. La neuroleptoanalgesia es el alivio del dolor con una combinación de fentanilo (fuerte, dura de 30 a 40 minutos) y droperidol (un antipsicótico suave). Droperidol tiene un efecto sedante suave, detiene las reacciones emocionales y reduce el tono de los músculos esqueléticos. También los efectos importantes de droperidol son antieméticos y antichoque. Dosis de droperidol - 1: 50. Medicamento combinado - talamonal. La neuroleptoanalgesia se usa en operaciones poco traumáticas, en el campo de la neurocirugía y en cardiología para el infarto de miocardio, etc. Atalgesia o analgesia tranquilizante: fentanilo en combinación con un tranquilizante fuerte como sibazon, fenazepam. La principal desventaja es la fuerte depresión respiratoria del fentanilo y la preservación de la conciencia. Conferencia No. 12. Anestesia. Tipos y etapas de la anestesia. La anestesia general, o anestesia, es un estado del cuerpo que se caracteriza por un cierre temporal de la conciencia de una persona, su sensibilidad al dolor y sus reflejos, así como la relajación de los músculos de los músculos esqueléticos, causada por la acción de los analgésicos narcóticos en el sistema nervioso central Dependiendo de las vías de administración de sustancias narcóticas en el cuerpo, se distinguen la anestesia por inhalación y la no inhalación. 1. Teorías de la anestesia Actualmente, no existen teorías de la anestesia que definan claramente el mecanismo narcótico de acción de los anestésicos. Entre las teorías de anestesia disponibles, las más significativas son las siguientes. Las drogas pueden causar cambios específicos en todos los órganos y sistemas. Durante el período en que el cuerpo está saturado con un analgésico narcótico, hay una cierta puesta en escena en el cambio de conciencia, respiración y circulación sanguínea del paciente. Por lo tanto, hay etapas que caracterizan la profundidad de la anestesia. Estas etapas se manifiestan de forma especialmente clara durante la anestesia con éter. Hay 4 etapas: 1) analgesia; 2) entusiasmo; 3) etapa quirúrgica, subdividida en 4 niveles; 4) etapa del despertar. Etapa de analgesia El paciente está consciente, pero se nota algo de letargo, está dormitando, responde preguntas con monosílabos. La sensibilidad superficial y al dolor están ausentes, pero en cuanto a la sensibilidad táctil y térmica, están conservadas. En esta etapa se realizan intervenciones quirúrgicas de corta duración, como apertura de flemones, abscesos, estudios diagnósticos, etc. La etapa es de corta duración, con una duración de 3-4 minutos. Etapa de excitación En esta etapa, los centros de la corteza cerebral están inhibidos y los centros subcorticales en este momento están en estado de excitación. Al mismo tiempo, la conciencia del paciente está completamente ausente, se observa una pronunciada excitación motora y del habla. Los pacientes comienzan a gritar, intentan levantarse de la mesa de operaciones. Se nota hiperemia de la piel, el pulso se vuelve frecuente, aumenta la presión arterial sistólica. La pupila del ojo se ensancha, pero la reacción a la luz persiste, se nota lagrimeo. A menudo hay tos, aumento de la secreción bronquial, a veces vómitos. No se puede realizar una intervención quirúrgica en el contexto de la excitación. Durante este período, debe continuar saturando el cuerpo con un narcótico para mejorar la anestesia. La duración de la etapa depende del estado general del paciente y de la experiencia del anestesiólogo. Normalmente, la duración de la excitación es de 7 a 15 minutos. Etapa quirúrgica Con el inicio de esta etapa de la anestesia, el paciente se calma, la respiración se calma y la frecuencia cardíaca y la presión arterial se aproximan a la normalidad. Durante este período, las intervenciones quirúrgicas son posibles. Dependiendo de la profundidad de la anestesia se distinguen 4 niveles y el estadio III de anestesia. Primer nivel: el paciente está tranquilo, el número de movimientos respiratorios, el número de contracciones del corazón y la presión arterial se acercan a los valores iniciales. La pupila comienza a estrecharse gradualmente, se conserva su reacción a la luz. Hay un movimiento suave de los globos oculares, una disposición excéntrica. Los reflejos corneal y faríngeo-laríngeo estaban conservados. El tono muscular se conserva, por lo que no se realizan operaciones abdominales a este nivel. Segundo nivel: se detiene el movimiento de los globos oculares, se fijan en una posición central. Las pupilas se dilatan y su reacción a la luz se debilita. La actividad de los reflejos corneal y faríngeo-laríngeo comienza a debilitarse con una desaparición gradual hacia el final del segundo nivel. Los movimientos respiratorios son tranquilos y uniformes. Los valores de presión arterial y pulso adquieren valores normales. Se reduce el tono muscular, lo que permite operaciones abdominales. La anestesia, por regla general, se lleva a cabo en el período del primer y segundo nivel. El tercer nivel se caracteriza como anestesia profunda. Al mismo tiempo, las pupilas de los ojos se dilatan como reacción a un fuerte estímulo de luz. En cuanto al reflejo corneal, está ausente. Se desarrolla una relajación completa de los músculos esqueléticos, incluidos los músculos intercostales. Debido a esto último, los movimientos respiratorios se vuelven superficiales o diafragmáticos. La mandíbula inferior se hunde, mientras sus músculos se relajan, la raíz de la lengua se hunde y cierra la entrada a la laringe. Todo lo anterior conduce a un paro respiratorio. Para prevenir esta complicación, la mandíbula inferior se adelanta y se mantiene en esta posición. En este nivel, se desarrolla taquicardia y el pulso se vuelve pequeño, lleno y tenso. El nivel de la presión arterial baja. La realización de la anestesia a este nivel es peligrosa para la vida del paciente. cuarto nivel; la máxima expansión de la pupila con la ausencia de su reacción a la luz, la córnea está opaca y seca. Dado que se desarrolla una parálisis de los músculos intercostales, la respiración se vuelve superficial y se realiza mediante movimientos del diafragma. La taquicardia es característica, mientras que el pulso se vuelve filiforme, frecuente y difícil de determinar en la periferia, la presión arterial se reduce drásticamente o no se detecta en absoluto. La anestesia en el cuarto nivel es potencialmente mortal para el paciente, ya que puede ocurrir un paro respiratorio y circulatorio. etapa de despertar Tan pronto como se detiene la introducción de estupefacientes, su concentración en la sangre disminuye y el paciente pasa por todas las etapas de la anestesia en orden inverso, se produce el despertar. 2. Preparación del paciente para la anestesia El anestesiólogo asume un papel directo y, a menudo, principal en la preparación del paciente para la anestesia y la cirugía. Un momento obligatorio es el examen del paciente antes de la operación, pero al mismo tiempo, no solo es importante la enfermedad de base, para la cual se va a realizar la cirugía, sino también la presencia de enfermedades concomitantes, que el anestesiólogo pregunta en detalle. . Es necesario saber cómo se trató al paciente por estas enfermedades, el efecto del tratamiento, la duración del tratamiento, la presencia de reacciones alérgicas, el momento de la última exacerbación. Si el paciente se somete a una intervención quirúrgica de manera planificada, entonces, si es necesario, se realiza la corrección de las enfermedades concomitantes existentes. El saneamiento de la cavidad oral es importante en presencia de dientes flojos y cariados, ya que pueden ser una fuente adicional e indeseable de infección. El anestesiólogo averigua y evalúa el estado psiconeurológico del paciente. Así, por ejemplo, en la esquizofrenia está contraindicado el uso de drogas alucinógenas (ketamina). La cirugía durante el período de psicosis está contraindicada. En presencia de un déficit neurológico, se corrige preliminarmente. Los antecedentes alérgicos son de gran importancia para el anestesiólogo, para ello se especifica la intolerancia a medicamentos, así como a alimentos, productos químicos domésticos, etc.. Si el paciente presenta una anamnesis alérgica agravada, ni siquiera a medicamentos, durante la anestesia se presenta una reacción alérgica puede desarrollarse hasta un shock anafiláctico. Por lo tanto, los agentes desensibilizantes (difenhidramina, suprastina) se introducen en la premedicación en grandes cantidades. Un punto importante es la presencia de un paciente en operaciones pasadas y anestesia. Resulta cuál fue la anestesia y si hubo alguna complicación. Se llama la atención sobre la condición somática del paciente: la forma de la cara, la forma y el tipo del tórax, la estructura y longitud del cuello, la gravedad de la grasa subcutánea, la presencia de edema. Todo esto es necesario para elegir el método correcto de anestesia y medicamentos. La primera regla para preparar a un paciente para la anestesia durante cualquier operación y cuando se usa anestesia es la limpieza del tracto gastrointestinal (el estómago se lava a través del tubo, se realizan enemas de limpieza). Para suprimir la reacción psicoemocional y suprimir la actividad del nervio vago, antes de la cirugía, el paciente recibe medicación: premedicación. Por la noche, el fenazepam se prescribe por vía intramuscular. A los pacientes con un sistema nervioso lábil se les recetan tranquilizantes (seduxen, relanium) un día antes de la cirugía. 40 minutos antes de la cirugía, se administran analgésicos narcóticos por vía intramuscular o subcutánea: 1 ml de una solución de promolol al 1-2% o 1 ml de pentozocina (lexir), 2 ml de fentanilo o 1 ml de morfina al 1%. Para suprimir la función del nervio vago y reducir la salivación, se administran 0,5 ml de una solución de atropina al 0,1%. Inmediatamente antes de la operación, se examina la cavidad bucal para detectar la presencia de dientes removibles y prótesis que se extraen. 3. Anestesia intravenosa Las ventajas de la anestesia general intravenosa son la rápida introducción del paciente a la anestesia. Con este tipo de anestesia no hay excitación y el paciente se duerme rápidamente. Pero los estupefacientes que se usan para la administración intravenosa crean anestesia a corto plazo, por lo que no se pueden usar en su forma pura como mononarcosis para operaciones a largo plazo. Los barbitúricos, el tiopental sódico y el hexenal, pueden inducir rápidamente el sueño narcótico, mientras que no hay una etapa de excitación y el despertar es rápido. Los cuadros clínicos de la anestesia realizada con tiopental sódico y hexenal son similares. Geksenal tiene un efecto inhibidor menor sobre el centro respiratorio. Se utilizan soluciones recién preparadas de derivados del ácido barbitúrico. El contenido del vial (1 g del medicamento) se disuelve antes del inicio de la anestesia en 100 ml de solución isotónica de cloruro de sodio (solución al 1%). Se punza la vena periférica o central (según indicaciones) y se inyecta lentamente la solución preparada a razón de 1 ml durante 10-15 s. Cuando la solución se inyectó en un volumen de 3-5 ml, la sensibilidad del paciente a los derivados del ácido barbitúrico se determina en 30 segundos. Si no se observa una reacción alérgica, continúe con la introducción del medicamento hasta la etapa quirúrgica de la anestesia. Desde el inicio del sueño narcótico, con una sola inyección de anestésico, la duración de la anestesia es de 10-15 minutos. Para mantener la anestesia, los barbitúricos se administran en fracciones de 100-200 mg de la droga, hasta una dosis total de no más de 1 g.Durante la administración de barbitúricos, la enfermera lleva un registro del pulso, la presión arterial y la respiración. El anestesiólogo monitorea el estado de la pupila, el movimiento de los globos oculares, la presencia de un reflejo corneal para determinar el nivel de anestesia. La anestesia con barbitúricos, especialmente tiopental-sódico, se caracteriza por depresión del centro respiratorio, por lo que es necesaria la presencia de un aparato de respiración artificial. Cuando se produce un paro respiratorio (apnea), se realiza ventilación pulmonar artificial (ALV) utilizando una máscara de aparato de respiración. La administración rápida de tiopental sódico puede provocar una disminución de la presión arterial y depresión cardíaca. En este caso, se detiene la administración del medicamento. En cirugía, la anestesia con barbitúricos como mononarcosis se usa para operaciones a corto plazo que no superan los 20 minutos de duración (por ejemplo, apertura de abscesos, flemones, reducción de luxaciones, manipulaciones diagnósticas y reposicionamiento de fragmentos óseos). Los derivados del ácido barbitúrico también se utilizan para la anestesia de inducción. Viadryl (predion para inyección) se usa a una dosis de 15 mg/kg, con una dosis total de 1000 mg en promedio. Viadryl se utiliza principalmente en pequeñas dosis junto con el óxido nitroso. En dosis altas, este medicamento puede causar una disminución de la presión arterial. Una complicación de su uso es el desarrollo de flebitis y tromboflebitis. Para prevenir su desarrollo, se recomienda administrar el medicamento lentamente en la vena central en forma de solución al 2,5%. Viadryl se utiliza para exámenes endoscópicos como un tipo introductorio de anestesia. La propanidida (epontol, sombrevin) está disponible en ampollas de 10 ml de una solución al 5%. La dosis del fármaco es de 7-10 mg/kg, administrada por vía intravenosa, rápidamente (la dosis total es de 500 mg en 30 segundos). El sueño llega de inmediato, "al final de la aguja". La duración del sueño anestésico es de 5-6 minutos. El despertar es rápido, tranquilo. El uso de propanidida provoca hiperventilación, que se produce inmediatamente después de la pérdida del conocimiento. A veces puede ocurrir apnea. En este caso, la ventilación debe llevarse a cabo utilizando un aparato de respiración. El lado negativo es la posibilidad de formación de hipoxia en el contexto de la administración del fármaco. Es necesario controlar la presión arterial y el pulso. El medicamento se usa para la anestesia de inducción en la práctica quirúrgica ambulatoria para operaciones pequeñas. El hidroxibutirato de sodio se administra por vía intravenosa muy lentamente. La dosis media es de 100-150 mg/kg. El medicamento crea una anestesia superficial, por lo que a menudo se usa en combinación con otros estupefacientes, como los barbitúricos, la propanidida. A menudo se utiliza para la anestesia de inducción. La ketamina (ketalar) puede usarse para administración intravenosa e intramuscular. La dosis estimada de la droga es de 2-5 mg / kg. La ketamina se puede utilizar para la mononarcosis y para la anestesia de inducción. El fármaco provoca un sueño superficial, estimula la actividad del sistema cardiovascular (aumenta la presión arterial, se acelera el pulso). La introducción del medicamento está contraindicada en pacientes con hipertensión. Ampliamente utilizado en shock en pacientes con hipotensión. Los efectos secundarios de la ketamina pueden ser alucinaciones desagradables al final de la anestesia y al despertar. 4. Anestesia por inhalación La anestesia por inhalación se lleva a cabo con la ayuda de líquidos (volátiles) que se evaporan fácilmente: éter, halotano, metoxiflurano (pentran), tricloroetileno, cloroformo o sustancias narcóticas gaseosas: óxido nitroso, ciclopropano. Con el método de anestesia endotraqueal, la sustancia narcótica ingresa al cuerpo desde la máquina de anestesia a través de un tubo insertado en la tráquea. La ventaja del método radica en el hecho de que proporciona permeabilidad libre de las vías respiratorias y puede usarse en operaciones en el cuello, la cara, la cabeza, elimina la posibilidad de aspiración de vómito, sangre; reduce la cantidad de droga utilizada; mejora el intercambio de gases al reducir el espacio "muerto". La anestesia endotraqueal está indicada para intervenciones quirúrgicas mayores, se utiliza como anestesia multicomponente con relajantes musculares (anestesia combinada). El uso total de varios fármacos en pequeñas dosis reduce los efectos tóxicos en el organismo de cada uno de ellos. La anestesia mixta moderna se usa para proporcionar analgesia, desactivar la conciencia, relajación. La analgesia y la inconsciencia se llevan a cabo mediante el uso de una o más sustancias narcóticas, inhaladas o no inhaladas. La anestesia se realiza en el primer nivel de la etapa quirúrgica. La relajación muscular, o relajación, se logra mediante la administración fraccionada de relajantes musculares. 5. Etapas de la anestesia Hay tres etapas de anestesia. 1. Introducción a la anestesia. La anestesia introductoria se puede llevar a cabo con cualquier sustancia narcótica, contra la cual se produce un sueño anestésico bastante profundo sin etapa de despertar. En su mayoría, se utilizan barbitúricos, fentanilo en combinación con sombrevin, molidos con sombrevin. El tiopental sódico también se usa a menudo. Los medicamentos se usan en forma de una solución al 1%, se administran por vía intravenosa en una dosis de 400-500 mg. En el contexto de la anestesia de inducción, se administran relajantes musculares y se realiza la intubación traqueal. 2. Mantenimiento de la anestesia. Para mantener la anestesia general, puede usar cualquier narcótico que pueda proteger al cuerpo del trauma quirúrgico (halotano, ciclopropano, óxido nitroso con oxígeno), así como neuroleptoanalgesia. Se mantiene la anestesia en el primer y segundo nivel de la etapa quirúrgica, y para eliminar la tensión muscular se administran relajantes musculares, que provocan mioplegia de todos los grupos musculares esqueléticos, incluidos los respiratorios. Por lo tanto, la condición principal para el método moderno combinado de anestesia es la ventilación mecánica, que se lleva a cabo apretando rítmicamente una bolsa o piel, o utilizando un aparato de respiración artificial. Recientemente, la neuroleptoanalgesia más extendida. Con este método, se utilizan para la anestesia óxido nitroso con oxígeno, fentanilo, droperidol, relajantes musculares. Anestesia introductoria intravenosa. La anestesia se mantiene mediante inhalación de óxido nitroso con oxígeno en proporción 2:1, administración intravenosa fraccionada de fentanilo y droperidol 1-2 ml cada 15-20 minutos. Con el aumento de la frecuencia cardíaca, se administra fentanilo, con un aumento de la presión arterial: droperidol. Este tipo de anestesia es más segura para el paciente. El fentanilo mejora el alivio del dolor, el droperidol suprime las reacciones vegetativas. 3. Retiro de la anestesia. Al final de la operación, el anestesiólogo detiene gradualmente la administración de sustancias narcóticas y relajantes musculares. La conciencia vuelve al paciente, se restaura la respiración independiente y el tono muscular. El criterio para evaluar la adecuación de la respiración espontánea son indicadores de RO2, RSO2, pH. Después del despertar, la restauración de la respiración espontánea y el tono del músculo esquelético, el anestesiólogo puede extubar al paciente y transportarlo para observación adicional en la sala de recuperación. 6. Métodos para monitorear la conducción de la anestesia. Durante la anestesia general, los principales parámetros de la hemodinámica se determinan y evalúan constantemente. Mida la presión arterial, la frecuencia del pulso cada 10-15 minutos. En personas con enfermedades del sistema cardiovascular, así como en operaciones torácicas, es necesario monitorear constantemente la función del músculo cardíaco. La observación electroencefalográfica se puede utilizar para determinar el nivel de anestesia. Para controlar la ventilación pulmonar y los cambios metabólicos durante la anestesia y la cirugía, es necesario realizar un estudio del estado ácido-base (RO2, RSO2, pH, BE). Durante la anestesia, la enfermera mantiene un cuadro anestésico del paciente, en el que necesariamente registra los principales indicadores de la homeostasis: frecuencia del pulso, presión arterial, presión venosa central, frecuencia respiratoria y parámetros del ventilador. En este mapa se fijan todas las etapas de la anestesia y la cirugía, se indican las dosis de sustancias estupefacientes y relajantes musculares. Se anotan todos los fármacos utilizados durante la anestesia, incluidos los medios de transfusión. Se registra el tiempo de todas las etapas de la operación y la administración de medicamentos. Al final de la operación, se indica el número total de todos los medios utilizados, que también se refleja en la tarjeta de anestesia. Se lleva un registro de todas las complicaciones durante la anestesia y la cirugía. La tarjeta de anestesia está incrustada en la historia clínica. 7. Complicaciones de la anestesia Pueden ocurrir complicaciones durante la anestesia debido a una técnica de anestesia inadecuada o al efecto de los anestésicos en órganos vitales. Una de esas complicaciones es el vómito. Al comienzo de la introducción de la anestesia, los vómitos pueden estar asociados con la naturaleza de la enfermedad dominante (estenosis pilórica, obstrucción intestinal) o con el efecto directo del fármaco en el centro del vómito. En el contexto de los vómitos, la aspiración es peligrosa: la entrada de contenido gástrico en la tráquea y los bronquios. Los contenidos gástricos que tienen una reacción ácida pronunciada, que caen sobre las cuerdas vocales y luego penetran en la tráquea, pueden provocar laringoespasmo o broncoespasmo, lo que resulta en insuficiencia respiratoria con hipoxia posterior; este es el llamado síndrome de Mendelssohn, acompañado de cianosis, broncoespasmo, taquicardia. Peligroso puede ser la regurgitación: el lanzamiento pasivo de contenido gástrico a la tráquea y los bronquios. Esto generalmente ocurre en el contexto de una anestesia profunda usando una máscara con relajación de los esfínteres y desbordamiento del estómago o después de la introducción de relajantes musculares (antes de la intubación). La ingestión en los pulmones durante el vómito o la regurgitación de contenido gástrico ácido provoca neumonía grave, a menudo fatal. Para evitar la aparición de vómitos y regurgitaciones, es necesario extraer su contenido del estómago con una sonda antes de la anestesia. En pacientes con peritonitis y obstrucción intestinal, la sonda se deja en el estómago durante toda la anestesia, siendo necesaria una posición moderada de Trendelenburg. Antes de comenzar la anestesia, se puede usar el método Selick para prevenir la regurgitación, presionando el cartílago cricoides hacia atrás, lo que provoca la compresión del esófago. Si se presentan vómitos, es necesario retirar rápidamente el contenido gástrico de la cavidad oral con un hisopo y succión; en caso de regurgitación, el contenido gástrico se extrae por succión a través de un catéter insertado en la tráquea y los bronquios. Los vómitos seguidos de aspiración pueden ocurrir no solo durante la anestesia, sino también cuando el paciente se despierta. Para evitar la aspiración en tales casos, es necesario que el paciente tome una posición horizontal o de Trendelenburg, gire la cabeza hacia un lado. El paciente debe ser monitoreado. Pueden ocurrir complicaciones del sistema respiratorio debido a la alteración de la permeabilidad de las vías respiratorias. Esto puede deberse a defectos en la máquina de anestesia. Antes de iniciar la anestesia, es necesario verificar el funcionamiento del dispositivo, su estanqueidad y la permeabilidad de los gases a través de las mangueras de respiración. La obstrucción de las vías respiratorias puede ocurrir como resultado de la retracción de la lengua durante la anestesia profunda (nivel III de la etapa quirúrgica de la anestesia). Durante la anestesia, los cuerpos extraños sólidos (dientes, prótesis) pueden ingresar al tracto respiratorio superior. Para prevenir estas complicaciones, es necesario avanzar y apoyar la mandíbula inferior en el contexto de una anestesia profunda. Antes de la anestesia, se deben quitar las dentaduras postizas, se deben examinar los dientes del paciente. Las complicaciones de la intubación traqueal realizada por laringoscopia directa se pueden agrupar de la siguiente manera: 1) daño a los dientes por la hoja del laringoscopio; 2) daño a las cuerdas vocales; 3) introducción de un tubo endotraqueal en el esófago; 4) introducción de un tubo endotraqueal en el bronquio derecho; 5) salida del tubo endotraqueal de la tráquea o doblarlo. Las complicaciones descritas pueden prevenirse con un conocimiento claro de la técnica de intubación y control de la posición del tubo endotraqueal en la tráquea por encima de su bifurcación (usando la auscultación de los pulmones). Complicaciones del sistema circulatorio. Puede ocurrir una disminución de la presión arterial tanto durante el período de anestesia como durante la anestesia debido al efecto de las sustancias narcóticas en la actividad del corazón o en el centro vascular-motor. Esto sucede con una sobredosis de sustancias narcóticas (a menudo halotano). La hipotensión puede aparecer en pacientes con BCC bajo con la dosis óptima de sustancias estupefacientes. Para prevenir esta complicación, es necesario llenar la deficiencia de BCC antes de la anestesia y durante la operación, acompañada de pérdida de sangre, transfundir soluciones de sustitución de sangre y sangre. Las alteraciones del ritmo cardíaco (taquicardia ventricular, extrasístole, fibrilación ventricular) pueden ocurrir por varias razones: 1) hipoxia e hipercapnia resultantes de intubación prolongada o ventilación insuficiente durante la anestesia; 2) sobredosis de sustancias estupefacientes: barbitúricos, halotano; 3) el uso de epinefrina en el contexto de ftorotane, lo que aumenta la sensibilidad de ftorotane a las catecolaminas. Se necesita control electrocardiográfico para determinar el ritmo cardíaco. El tratamiento se lleva a cabo según la causa de la complicación e incluye la eliminación de la hipoxia, una disminución de la dosis del medicamento, el uso de medicamentos con quinina. El paro cardíaco es la complicación más peligrosa durante la anestesia. Con mayor frecuencia es causado por un control incorrecto de la condición del paciente, errores en la técnica de anestesia, hipoxia, hipercapnia. El tratamiento consiste en resucitación cardiopulmonar inmediata. Complicaciones del sistema nervioso. Durante la anestesia general, se permite una disminución moderada de la temperatura corporal como resultado de la influencia de sustancias narcóticas en los mecanismos centrales de termorregulación y enfriamiento del paciente en la sala de operaciones. El cuerpo de los pacientes con hipotermia después de la anestesia intenta restablecer la temperatura corporal debido al aumento del metabolismo. En este contexto, al final de la anestesia y después de ella, aparecen escalofríos, que se observan después de la anestesia con halotano. Para prevenir la hipotermia, es necesario controlar la temperatura en la sala de operaciones (21-22 ° C), cubrir al paciente, si es necesario, terapia de infusión, verter soluciones calentadas a la temperatura corporal e inhalar narcóticos tibios y humedecidos. El edema cerebral es consecuencia de la hipoxia prolongada y profunda durante la anestesia. El tratamiento debe ser inmediato, es necesario seguir los principios de deshidratación, hiperventilación, enfriamiento local del cerebro. Daño a los nervios periféricos. Esta complicación ocurre un día o más después de la anestesia. Muy a menudo, los nervios de las extremidades superiores e inferiores y el plexo braquial están dañados. Es el resultado de una incorrecta posición del paciente en la mesa de operaciones (abducción del brazo a más de 90° del cuerpo, colocar el brazo detrás de la cabeza, fijar el brazo al arco de la mesa de operaciones, apoyar las piernas sobre soportes sin acolchado). La posición correcta del paciente sobre la mesa elimina la tensión de los troncos nerviosos. El tratamiento lo lleva a cabo un neuropatólogo y un fisioterapeuta. Conferencia número 13. Anestesia local 1. Anestesia de superficie Este tipo de anestesia se realiza por contacto de la sustancia anestésica con uno u otro órgano, su superficie. Para ello, una solución de cocaína al 1-3%, una solución de dicaína al 0,25-2%, una solución de lidocaína al 1-2%, una solución de trimecaína al 1-5% y una solución de piromecaína al 0,5-2%. La mayoría de los anestésicos locales se unen a los canales de sodio inactivados, impidiendo su activación y la entrada de sodio a la célula durante la despolarización de la membrana, logrando así un efecto analgésico. La técnica de la anestesia de superficie es sencilla y consiste en lubricar, instilar una solución o rociarla con pistolas especiales. El inicio de la acción del anestésico depende del pH; un pH bajo tarda más en hacer efecto que un pH alto. La duración de la acción del anestésico depende del grado de su unión a las proteínas. Este tipo de anestesia se utiliza en manipulaciones de diagnóstico y en oftalmología, otorrinolaringología. 2. Anestesia regional La anestesia regional incluye plexo, conducción, epidural, paravertebral y otros tipos de anestesia. A diferencia de la anestesia general, la anestesia regional proporciona una analgesia quirúrgica adecuada debido al bloqueo periférico de los impulsos dolorosos mientras se mantienen las funciones vitales normales. La anestesia regional es técnicamente difícil y requiere un conocimiento preciso de la ubicación anatómica y topográfica del plexo nervioso o conductor nervioso, una orientación clara en los puntos de identificación permanentes (protuberancias óseas, arterias, músculos), la capacidad de evaluar la resistencia del tejido y las sensaciones del paciente. Para desactivar la sensibilidad al dolor, es suficiente introducir una solución de trimecaína (lidocaína) al 1%, y para desactivar la sensibilidad propioceptiva y lograr la relajación muscular, debe usar soluciones anestésicas locales más concentradas (por ejemplo, trimecaína 2-2,5% ). La restauración de la sensibilidad ocurre en el orden inverso, es decir, primero aparecen el tono muscular y las sensaciones propioceptivas, y luego las sensaciones de dolor y temperatura. Es importante tener en cuenta que con un aumento en la concentración y cantidad de anestésico local, aumenta su toxicidad. Las soluciones más utilizadas son la trimecaína al 1-2 %, la lidocaína al 1-2 % y la bupivocaína al 0,75-0,5 %. Los anestésicos locales bloquean las fibras de mielina delgadas y libres de mielina con mayor facilidad y rapidez (todas las vegetativas, así como la conducción de los estímulos de temperatura y dolor). Las gruesas fibras de mielina que van a los músculos esqueléticos, los receptores táctiles y los propioceptores son altamente resistentes a la anestesia, ya que se ven afectados por la anestesia local en la zona de las intersecciones de Ranvier. La difusión del anestésico en la parte lipoide de la fibra nerviosa es rápida, pero sólo hasta que la concentración fuera del nervio es mayor que en el propio nervio. Después de que cambia esta relación, el anestésico se difunde en dirección opuesta desde el nervio hacia los tejidos circundantes. Las soluciones anestésicas débilmente concentradas, administradas en grandes volúmenes, se distribuyen ampliamente, pero su difusión es insignificante. Las soluciones concentradas introducidas en pequeños volúmenes tienen un buen grado de difusión. El efecto de la anestesia depende de la cantidad de anestésico que penetre transperineuralmente y provoque un bloqueo de umbral adecuado. Duplicar la concentración del anestésico inyectado prolonga la anestesia en 1/3, y la introducción de un volumen doble, solo en un 3-9%. Los anestésicos locales a menudo provocan reacciones anafilácticas. Trimecaína: la duración de la acción es de 1-1,5 horas, la dosis única máxima es de 800-1000 mg. La lidocaína (xicaína) se usa en una solución al 1-2%, la duración de la anestesia es de hasta 2,5-3 horas. La bupivocaína (marcaína ) utilizado en una solución al 0,5-0,75% en una dosis única máxima de 150-170 mg, duración de la acción 8-12 horas Para el uso de anestésicos de acción prolongada, la adición de lidocaína acelera claramente la aparición del efecto, reduciendo el periodo latente. Al realizar anestesia regional, debe conocer y seguir las reglas generales: 1) conocer claramente las características anatómicas y topográficas de los plexos y conductores nerviosos en el área de la anestesia propuesta, así como la técnica de realización de la anestesia; 2) elegir el anestésico local adecuado, determinar su concentración, dosis total y método de entrega al plexo nervioso o conductor; 3) evaluar el estado del paciente y conocer los antecedentes alérgicos y farmacoterapéuticos; 4) advertir al paciente sobre la posible preservación de la sensibilidad táctil y propioceptiva profunda durante la anestesia de conducción y plexo; 5) monitorear constantemente la hemodinámica y la respiración del paciente después de la anestesia; 6) antes o inmediatamente después de la anestesia, realizar venopunción y tomar medidas para prevenir posibles complicaciones; 7) llevar a cabo de conformidad con medidas asépticas y antisépticas, y eliminar cuidadosamente las sustancias químicamente activas (yodo, clorhexidina, etc.) de la superficie de la piel antes de la punción; 8) antes de la introducción de un anestésico local, es imperativo realizar una prueba de aspiración para evitar que la aguja ingrese al vaso arterial; 9) recordar que la parestesia que siente el paciente durante la anestesia regional es un requisito previo para el éxito de la obtención de la analgesia; su ausencia indica un posible fallo; 10) para facilitar la localización del conductor nervioso o plexo, se aconseja aplicar estimulación eléctrica aplicando un impulso negativo a la aguja, y un impulso positivo (ánodo) al polo indiferente del electrodo, que se fija en el paciente. piel. 3. Anestesia del plexo cervical (ASP) ACS, realizado en uno o ambos lados, le permite realizar todas las operaciones en el cuello, la glándula tiroides, los vasos braquiocefálicos en caso de heridas de bala, lesiones y enfermedades tumorales. El plexo cervical (Plexus cervicalis) está formado por las ramas anteriores de los cuatro nervios cervicales superiores (C1-DE4) a su salida de los agujeros intervertebrales. Se encuentra en la superficie anterior del músculo escaleno medio y el músculo que levanta la escápula, lateral a las apófisis transversas de las vértebras cervicales. Los nervios motores del plexo cervical inervan los músculos del cuello, y los nervios sensoriales inervan la piel de la región occipital de la cabeza, las superficies anterior y lateral del cuello, la región subclavia hasta el nivel de las costillas I y II y la aurícula El mayor nervio del plexo cervical es el frénico (p. prenicus), que se forma a partir de C3-DE4 y menos a menudo debido a una rama adicional de C5. La mayoría de los nervios sensoriales salen en el medio por debajo del borde posterior del músculo esternocleidomastoideo y divergen en las capas superficiales del cuello, la piel de la región occipital de la cabeza y la parte superior del tórax. Cuando se anestesian los nervios sensibles del plexo cervical a lo largo del borde posterior en el medio del músculo esternocleidomastoideo, se pueden realizar varias operaciones en el cuello, pero se debe recordar que la anestesia debe ser bilateral, ya que los nervios se anastomosan a lo largo del línea media del cuello. Para grandes operaciones en las capas profundas del cuello (estrumectomía, extirpación de tumores de cuello, laringectomía, endarterectomía carotídea, etc.), es necesario anestesiar el plexo cervical con un abordaje anterior. Con el acceso lateral, existe el riesgo de complicaciones graves (introducción de una solución anestésica en el espacio subdural), por lo que no se utiliza. Para realizar un ASS con abordaje anterior, es necesario que el paciente se acueste boca arriba con un pequeño giro debajo del cuello. La cabeza debe estar plana, recta en la línea media sin girar o ligeramente girada en dirección opuesta a la punción. Con las manos a lo largo del cuerpo, el anestesiólogo se para en la cabeza de la punción. Puntos de referencia: músculo esternocleidomastoideo, hueso hioides, arteria carótida interna y ángulo mandibular. Técnica de anestesia 2 cm por debajo del ángulo de la mandíbula inferior, anterior al músculo esternocleidomastoideo, se determina la pulsación de la arteria carótida interna. La rama horizontal del hueso hioides corresponde al nivel del proceso transverso de la vértebra C3. El punto de inyección de la aguja se encuentra en la intersección de la línea, que es una continuación de la rama horizontal del hueso hioides, con el borde anterior del músculo esternocleidomastoideo. En este punto de intersección, en condiciones asépticas, se forma una "piel de limón" y se dirige una aguja de inyección a través de ella desde el exterior hacia el interior y de adelante hacia atrás, avanzándola medialmente hacia el músculo esternocleidomastoideo y detrás de la carótida interna. arteria (en el espacio entre el músculo esternocleidomastoideo y la arteria carótida interna palpable) hasta que el paciente desarrolle parestesia o la aguja golpee el proceso transverso de la vértebra C3. La profundidad de la inyección no supera los 2-5 cm.La aguja se fija de forma segura en esta posición y se realiza una prueba de aspiración, determinando si el extremo de la aguja está en la luz del vaso. Para la anestesia, se inyectan de ambos lados 10-12 ml de una solución de trimecaína al 2%. Para potenciar la anestesia del plexo cervical, también puede bloquear las ramas superficiales que van a la superficie anterior del cuello. El lugar de su salida es el medio del borde posterior del músculo esternocleidomastoideo. La aguja se inyecta en el punto de su salida debajo de la fascia superficial del cuello. Se administra una solución de trimecaína al 2% en una cantidad de 3-5 ml por vía craneal y caudal (en forma de abanico). La anestesia adecuada ocurre después de 8 a 12 minutos y brinda un alivio efectivo del dolor en la mayoría de los pacientes dentro de 1,5 a 2 horas. Complicaciones Síndrome de Horner, bloqueo del nervio frénico, paresia del nervio recurrente, hipotensión con inyección intravascular de anestésico. La ronquera es el síntoma principal del bloqueo del plexo cervical. La complicación más peligrosa con acceso lateral es el desarrollo de anestesia espinal alta y la entrada de anestésico en la cavidad del ventrículo IV, cuyos síntomas son parálisis de los centros bulbares, dilatación de las pupilas, disminución de la presión arterial, insuficiencia respiratoria y atonía muscular. . Las contraindicaciones absolutas para la anestesia del plexo cervical son paresia del nervio frénico en el lado opuesto, daño a los nervios del plexo cervical. 4. Anestesia del plexo braquial (APS) APS permite realizar todas las operaciones de miembro superior, articulación del hombro, hombro, antebrazo y mano: amputaciones, tratamiento quirúrgico de heridas con reposición y fijación de fragmentos óseos, operaciones de vasos sanguíneos y nervios, reducción de luxaciones de hombro, etc. La alta frecuencia de intervenciones quirúrgicas en el miembro superior, especialmente en tiempos de guerra, plantea la cuestión de los métodos racionales de anestesia durante estas operaciones. Topográficamente, hay 2 partes del plexo braquial: supraclavicular y subclavia. Las ramas se extienden desde la parte supraclavicular hasta los músculos profundos del cuello y los músculos de la cintura escapular. La parte subclavia del plexo braquial consta de tres troncos que cubren la arteria axilar desde los lados interno, posterior y externo. Los nervios largos se originan en los troncos, yendo a la parte libre del miembro superior, y un nervio corto a la cintura escapular. Del tronco interno parte el nervio cubital y la raíz inferior al nervio mediano; del tronco posterior salen los nervios radial y axilar, y del tronco externo el nervio musculocutáneo y la raíz superior del nervio mediano. Por lo tanto, la anestesia del plexo braquial es posible de varias maneras utilizando abordajes supraclaviculares, axilares y subclavios. De los abordajes supraclaviculares, los métodos de anestesia en el espacio intersticial son los más utilizados por ser los más sencillos, fiables y con menos complicaciones. Anestesia del plexo braquial por Winnie El paciente se acuesta boca arriba, la cabeza se gira en la dirección opuesta al sitio de punción, la barbilla se lleva a la cintura escapular contralateral. La mano del lado de la punción se encuentra a lo largo del cuerpo, ligeramente tirada hacia abajo. Puntos de referencia: músculo esternocleidomastoideo, escaleno anterior, espacio intersticial, vena yugular externa, clavícula, cartílago cricoides. Técnica de anestesia. La piel se trata con una solución antiséptica. Detrás del músculo esternocleidomastoideo, que se perfila claramente con una ligera elevación de la cabeza, al nivel del cartílago cricoides, las yemas de los dedos de la mano izquierda se colocan sobre el músculo escaleno anterior. Con un mayor desplazamiento lateral de los dedos de 0,5 a 1,5 cm entre los músculos escalenos anterior y medio, se explora el espacio interescalénico. Se vuelve más claro con una respiración profunda, ya que esto tensa los músculos escalenos. En la profundidad del espacio intersticial, se palpan los procesos transversos de las vértebras cervicales (sensación de resistencia firme) y, al aumentar la presión con la punta del dedo, a menudo se produce parestesia en el hombro o la cintura escapular; más caudalmente, en el espacio intersticial, se puede palpar la arteria subclavia. El espacio intersticial en la sección superior es atravesado por la vena yugular externa. El punto de inyección de la aguja se encuentra en la parte superior del espacio intersticial a la altura del cartílago cricoides. En este punto, se forma una "costra de limón" y, a través de ella, la aguja se dirige medialmente y algo hacia abajo, de adelante hacia atrás (en dirección dorsal) al proceso transverso C6 en un ángulo de 30° con el plano sagital. Cuando la aguja avanza hacia adentro a una distancia de 1,5 a 4 cm, se produce parestesia y la punta de la aguja descansa sobre el proceso transverso de la sexta vértebra cervical. En esta posición, la aguja se fija o se levanta 6-1 mm y, después de la prueba de aspiración, se inyectan 2-30 ml de una solución de trimecaína (lidocaína) al 40% o una solución de bupivocaína (marcaína) al 2-0,5%. inyectado. Durante la introducción de los primeros mililitros de solución anestésica local, el paciente experimenta un dolor breve ("descarga eléctrica"), lo que indica la ubicación correcta de la punta de la aguja. En ausencia de parestesia, se puede comprobar la posición de la punta de la aguja introduciendo 0,75 ml de una solución de cloruro sódico al 0,5% sacada del frigorífico. La aparición de una sensación de dolor en el miembro superior indica el contacto de una solución fría con un nervio. Contraindicaciones: paresia del nervio recurrente o frénico en el lado opuesto, daño a los nervios del plexo braquial. Posibles complicaciones: inyección intravascular de una solución de anestésico local, especialmente en la arteria vertebral, cuya rápida difusión conduce a la intoxicación del SNC; la administración subaracnoidea de una solución anestésica provoca un bloqueo espinal total; la administración epidural da como resultado una anestesia epidural alta. Anestesia del plexo braquial en el espacio intersticial según el método de S. V. Gavrilin y L. G. Tikhonov La principal diferencia de este método con respecto a otros es que no hay cúpula de la pleura ni grandes vasos sanguíneos en el sitio de punción. El paciente se acuesta boca arriba, su cabeza se gira en la dirección opuesta al sitio de punción, la barbilla se lleva a la cintura escapular contralateral. Se coloca un pequeño rodillo debajo de los hombros, el brazo del lado del pinchazo se encuentra a lo largo del cuerpo. Puntos de referencia: clavícula, músculo esternocleidomastoideo. Técnica de anestesia. El punto de inyección de la aguja se encuentra en la parte superior de la perpendicular, restaurada desde el borde superior de la mitad de la clavícula, cuya longitud es igual a ¼ de la longitud del músculo esternocleidomastoideo. En este punto, se forma una "piel de limón", la aguja de inyección intramuscular se inserta en un ángulo de 60 ° con respecto a la superficie de la piel, mientras que la aguja y una perpendicular imaginaria o dibujada deben estar en el mismo plano. La aguja se introduce en dirección a la apófisis transversa de la 6ª vértebra cervical hasta que aparece parestesia en el miembro superior. En ausencia de parestesia, la aguja se avanza completamente en el proceso transverso de la 6.ª vértebra cervical y, después de tirar de ella hacia sí misma 1-2 mm, se inyectan 30-40 ml de una solución al 2% de trimecaína o lidocaína. . La profundidad de inserción de la aguja es de 2-5 cm. Anestesia del plexo braquial en la modificación de V. S. Sokolovsky El paciente se acuesta boca arriba, la cabeza se encuentra en la línea media, los brazos se encuentran a lo largo del cuerpo. Puntos de referencia: músculo esternocleidomastoideo y clavícula. Técnica de anestesia. Para facilitar la búsqueda de un punto en la piel del cuello, se construye un triángulo con un vértice en la zona de la articulación esternoclavicular del lado de la anestesia. Los rayos del triángulo son el eje de la clavícula y una línea recta que conecta el proceso mastoideo con la articulación esternoclavicular. Se restablece una perpendicular a la bisectriz del ángulo ABC desde la mitad de la clavícula. El punto de intersección es el punto de inyección de la aguja, que avanza en un ángulo de 45° con respecto al plano horizontal de la mesa de operaciones y perpendicular al eje de la columna cervical. A una profundidad de 2-3 cm, después de recibir parestesia y realizar una prueba de aspiración, se inyectan 30-40 ml de una solución al 2% de trimecaína (lidocaína). La anestesia ocurre en 10-12 minutos. Cuando se obtiene parestesia no concluyente, es deseable usar estimulación eléctrica para identificar el tronco nervioso del plexo cervical. 5. Anestesia de nervios periféricos en el área de la muñeca Para operaciones en la mano, es necesario anestesiar los nervios cubital, mediano y radial. En todos los casos, la aguja se inyecta a nivel del pliegue proximal de la muñeca. Durante la anestesia, el paciente se acuesta boca arriba, en el área de la muñeca, el brazo está en supinación y ligeramente doblado. Puntos de referencia: estiloides del cúbito, pisiforme, tendón del flexor cubital del carpo y tendón del flexor largo del carpo. Anestesia del nervio cubital Topografía del nervio cubital. En el tercio inferior del antebrazo, el nervio cubital discurre lateral al tendón flexor cubital y medial a la arteria cubital. Al nivel de la muñeca o en la superficie flexora del antebrazo, 3-5 cm proximal a la muñeca, el nervio cubital se divide en dos ramas: dorsal y palmar. La rama dorsal es sensible, pasa por debajo del tendón del flexor cubital de la mano y sale al tejido subcutáneo del dorso de la mano aproximadamente al nivel de la articulación de la muñeca. Al anastomosarse con las ramas del nervio radial, inerva 2 ½ dedos. La rama palmar del nervio cubital se mezcla y al nivel del hueso pisiforme se divide en dos ramas: profunda y superficial. Este último es sensible e inerva la región hipotenar del quinto dedo y el lado cubital del anular. Técnica de anestesia de la rama palmar del nervio cubital. El punto de inyección de la aguja está al nivel del pliegue proximal de la muñeca medial al tendón del flexor cubital de la mano. Se pasa la aguja a una profundidad de 1-2 cm a través del tejido subcutáneo hacia el hueso pisiforme. Tras la aparición de parestesias y con prueba de aspiración negativa, se fija la aguja y se inyectan 3-5 ml de una solución de trimecaína al 2%. En ausencia de parestesia, se avanza la aguja hasta que entre en contacto con el hueso, y cuando se retira, se infiltran los tejidos con una solución de trimekia al 2%. Técnica de anestesia de la rama dorsal del nervio cubital. El punto de inyección de la aguja está al nivel de la intersección del pliegue proximal de la muñeca con el borde medial del tendón del músculo flexor cubital. La aguja se dirige a la apófisis estiloides del cúbito. Para obtener parestesia, se inyectan 3-5 ml de una solución de trimecaína al 2%. En ausencia de parestesia, se retira la aguja y se infiltran 5-10 ml de una solución de trimecaína al 2% en los tejidos. No hay complicaciones. anestesia del nervio mediano El paciente se acuesta boca arriba, el brazo está en supinación y enderezado. Puntos de referencia: tendón del músculo palmar largo, tendón del flexor radial de la mano y pliegue cutáneo proximal de la muñeca. Topografía. En el tercio inferior del antebrazo, el nervio mediano discurre por el surco medial muy cerca de la superficie de la piel, situado bajo la fascia, y aproximadamente 4-5 cm por encima del pliegue cutáneo distal. El surco medial está formado desde el exterior por el tendón del flexor radial de la mano, en el lado cubital, por el tendón del flexor largo de la mano. Las ramas del nervio mediano inervan los dedos 1, 2 y 3 y la superficie externa del 4 dedo, así como los músculos tenares. Técnica de anestesia. El punto de inyección de la aguja se encuentra en la línea del pliegue cutáneo proximal de la muñeca entre el tendón del músculo palmar largo y el flexor radial de la mano. Tras el avance perpendicular de la aguja a través del tejido subcutáneo hasta una profundidad de 0,5-1 cm y la obtención de parestesia, se fija la aguja y se inyectan 3-5 ml de una solución de lidocaína al 2%. Si no es posible lograr parestesia a una profundidad de 1 cm, los tejidos se infiltran en forma de abanico con 5-10 ml de una solución de trimecaína al 2% mientras se retira lentamente la aguja. Anestesia del nervio radial Puntos de referencia: apófisis estiloides del radio, arteria radial, "caja de rapé anatómica". Topografía. La rama superficial del nervio radial va primero al antebrazo junto con la arteria radial, y luego en el tercio inferior del antebrazo a una distancia de unos 8 cm de la articulación de la muñeca, el nervio se cruza con el tendón del músculo braquiorradial y pasa a la superficie posterior del antebrazo, donde se dirige distal y posteriormente, cruzando el abductor largo del dedo mayor y su extensor corto. A nivel de la muñeca en la parte superior de la "caja de rapé anatómica" se divide en ramas terminales que inervan los dedos 1, 2 y la superficie externa de los dedos 3. Las ramas de los tres nervios a menudo se anastomosan entre sí en el antebrazo, la muñeca y la mano. Técnica de anestesia. El punto de inyección está a nivel del pliegue cutáneo proximal de la muñeca lateral a la arteria radial en la proyección de la parte superior de la "caja de rapé anatómica". Se inyecta y la aguja se dirige hacia la "caja de rapé". Cuando se produce parestesia, se fija la aguja, con prueba de aspiración negativa, se inyectan 3-5 ml de una solución de trimecaína al 2%. En ausencia de parestesia, se inyectan en forma de abanico 5-10 ml de una solución de trimecaína al 2% en los tejidos subyacentes, creando un "brazalete" de infiltración de 3-3,5 cm de largo desde los tendones del extensor corto y abductor largo del pulgar en un lado, al extensor largo del pulgar - con otro. 6. Anestesia de las extremidades inferiores Para realizar intervenciones quirúrgicas en el miembro inferior, es necesario anestesiar los cuatro nervios principales. Tres de ellos, el femoral, el obturador y el nervio cutáneo externo del muslo, se originan en el plexo lumbar, y el nervio ciático se forma en parte a partir del lumbar y tres ramas del plexo sacro. Cada nervio inerva ciertas zonas de la extremidad inferior: el nervio femoral: la superficie anterior del muslo, la superficie interna anterior de la parte inferior de la pierna y la parte posterior del pie; isquiático: superficie posterior y lateral de la parte inferior de la pierna, superficie plantar del pie y su borde exterior, obturador: superficie interna del muslo; nervio cutáneo externo del muslo - la superficie lateral del muslo. Las zonas de sensibilidad profunda coinciden con la inervación de las zonas de la piel. Todos los músculos del miembro inferior reciben fibras motoras de los nervios femoral y ciático, excepto el grupo de abductores inervados por el nervio obturador. La articulación de la rodilla y su cara anterior están inervadas por el nervio femoral, la cara interna por el obturador, la lateral por los nervios cutáneo externo y ciático, y la posterior por los nervios cutáneo posterior, femoral y ciático. Anestesia del plexo lumbar por acceso anterior (inguinal) El paciente se acuesta boca arriba. Puntos de referencia: ligamento inguinal y arteria femoral. Topografía. El plexo lumbar está formado por las ramas anteriores que se anastomosan de las raíces L.1-L2-L3 y en parte por las ramas anteriores de Th12 y L4 nervios El plexo está ubicado frente a los procesos transversales de las vértebras lumbares entre el músculo cuadrado de la parte inferior de la espalda, dorsalmente, el músculo psoas mayor, ventralmente, los cuerpos de las vértebras, medialmente, emite ramas musculares y desciende en la fascia. cama. Los nervios espinales lumbares tienen ramas de conexión con los ganglios lumbares de los troncos simpáticos, contienen fibras nerviosas motoras, sensoriales y simpáticas. Los nervios más grandes del plexo lumbar son el nervio cutáneo femoral externo (L2-L3), obturador (L2-L4) y femoral (L2-L4) nervios. Este último es una continuación del plexo lumbar, se extiende hasta el muslo por debajo del ligamento pupartito a través de la laguna muscular, estando separado de la arteria femoral de localización medial por el ligamento iliopectíneo. El ancho del nervio femoral en este lugar es de aproximadamente 0,7-0,8 cm. La profundidad del nervio femoral es en promedio de 1,8-3 cm. -0,5 cm. Debajo del ligamento inguinal, el nervio forma dos haces. Las ramas del haz anterior inervan el músculo cuádriceps femoral, el lado medio y medial de la articulación de la rodilla y pasan al nervio safeno, que inerva la superficie medial de la parte inferior de la pierna y la parte interna del tobillo. La anestesia del nervio ciático permite operar en cualquier zona por debajo de la articulación de la rodilla, para reducir todas las fracturas de los huesos del miembro inferior, excluyendo una fractura del cuello femoral. Técnica de anestesia. La piel se trata con una solución desinfectante. Se forma una "piel de limón" con una solución anestésica, después de lo cual se inyecta la aguja debajo del ligamento inguinal 1-1,5 cm por debajo de este último y 0,5-1 cm lateral a la arteria femoral palpada. La aguja se dirige a través del tejido subcutáneo un poco en dirección proximal debajo del ligamento inguinal, donde a una profundidad de 3-4 cm después de la punción de la fascia, la aguja falla con pérdida de resistencia y puede ocurrir parestesia, que se extiende a la superficie anterior. del muslo En esta posición, la aguja se fija con el pulgar y el índice de la mano izquierda, y el borde de la palma de la mano izquierda se presiona con fuerza sobre los tejidos blandos del muslo distal a la aguja y 35-40 ml de una Se inyecta solución de trimecaína al 1,5%. La presión sobre los tejidos blandos dura de 1,5 a 2 minutos. Así, la anestesia del nervio femoral con pinzamiento se convierte en anestesia del plexo lumbar, realizada desde el abordaje anterior. La acción de la anestesia dura de 2 a 2,5 horas. Complicaciones: la reabsorción bastante rápida de la solución anestésica es posible cuando la anestesia del plexo lumbar se combina con la anestesia del nervio ciático, cuando la dosis única total excede 1 g del medicamento. La anestesia del plexo lumbar se puede realizar por el abordaje posterior, mientras se anestesia simultáneamente el femoral (L2-L4) y los nervios obturadores (L2-L3), nervio genitofemoral (L1-L2) y el nervio cutáneo femoral lateral (L2-L3). La posición del paciente durante la anestesia es del lado sano con las piernas dobladas. Puntos de referencia: apófisis espinosa de la cuarta vértebra lumbar (línea que conecta las crestas ilíacas por detrás); 4 cm caudal a lo largo de las crestas de las apófisis espinosas desde la apófisis espinosa de la 3ª vértebra lumbar y 4 cm lateral desde el último punto. Técnica de anestesia. Desde la apófisis espinosa de la cuarta vértebra lumbar en dirección caudal, se dibuja una línea de 5 cm de largo, desde cuyo extremo se restablece lateralmente hacia arriba una perpendicular de 4 cm de largo. El punto final de la perpendicular, que se encuentra cerca de la cresta ilíaca, es el punto de inyección de la aguja. Después de crear una "cáscara de limón", se inserta una aguja de 3 a 5 cm de largo perpendicular a la piel hasta que haga contacto con el proceso transverso de la quinta vértebra lumbar. Cranealmente, deslizándose desde el proceso transverso de la quinta vértebra lumbar, la aguja penetra en el espesor del músculo psoas cuadrado. Al mismo tiempo, se siente resistencia a la introducción de una solución con una jeringa (o se produce una resistencia elástica con la deformación de la burbuja de aire en la jeringa). La aguja se pasa a una profundidad donde se tiene la sensación de "pérdida de resistencia" (o la burbuja de aire no se deforma). Esta prueba indica que la aguja está en la fascia entre el psoas cuadrado y el psoas mayor. La aguja se fija a esta profundidad y se inyectan 12-15 ml de una solución de trimecaína (lidocaína) al 5-5% para lograr la anestesia. Posibles complicaciones: inyección intramuscular de una solución anestésica local con la posición incorrecta de la aguja, así como una rápida reabsorción del anestésico en la sangre cuando se inyecta una solución concentrada. Anestesia del nervio ciático desde el abordaje anterior Topografía. El nervio ciático se origina en el plexo sacro (L4-S3). Se forma en la pelvis pequeña y sale de la cavidad pélvica a través de la abertura piriforme junto con la arteria. Medialmente a él, pasa el nervio cutáneo posterior, así como el haz neurovascular, que consta de la arteria pudenda interna, la vena y el nervio pudendo. En la región glútea, el nervio ciático se encuentra debajo del glúteo mayor, detrás de los músculos gemelo, obturador interno y cuadrado femoral. En este último, se encuentra aproximadamente a la misma distancia de la tuberosidad isquiática y el trocánter mayor del fémur. Como regla general, en la parte superior de la fosa poplítea, el nervio se divide en ramas terminales: los nervios tibial y peroneo común. El nervio tibial pasa por la mitad de la fosa poplítea, ubicada lateral y superficialmente a la vena y arteria poplítea, y, junto con los vasos, ingresa al canal tobillo-poplíteo. El nervio tibial inerva el grupo muscular posterior de la parte inferior de la pierna, todos los músculos de la planta del pie, la piel de la superficie posterior de la parte inferior de la pierna, el talón y el borde lateral del pie. Se ramifica desde el nervio ciático hasta la articulación de la cadera. En la región del pliegue glúteo, se encuentra superficialmente debajo de la fascia ancha del muslo hacia afuera de la cabeza larga del bíceps femoral. El nervio peroneo común corre a lo largo del lado lateral de la fosa poplítea, alrededor de la cabeza del peroné. De él salen ramas hacia la articulación de la rodilla y la piel de la superficie lateral de la parte inferior de la pierna, también inerva los músculos de la parte inferior de la pierna, los músculos posteriores del pie y la piel de la parte posterior de los dedos. La anestesia del nervio ciático se realiza desde el abordaje anterior. Puntos de referencia: eje ilíaco anterosuperior y la parte más sobresaliente del trocánter mayor del fémur. Técnica de anestesia. El paciente se acuesta boca arriba, la espina ilíaca anterosuperior y el punto más saliente del trocánter mayor del fémur están conectados por una línea recta, y desde el último punto se restablece una perpendicular a la superficie anterior del muslo. La longitud de la perpendicular es igual a la distancia entre la espina ilíaca anterosuperior y el trocánter mayor del fémur, el extremo de esta perpendicular es el punto de proyección. En la posición fisiológica del miembro inferior, después de tratar la piel con una solución desinfectante y crear una "piel de limón", se dirige verticalmente hacia abajo una aguja de 12-15 cm de largo hasta que se apoya contra el trocánter menor del fémur. Después de que la aguja se desliza desde el trocánter menor, sin cambiar la dirección principal, la aguja se lleva aún más profundamente, 4-5 cm, hasta que se produce parestesia. Si no es posible lograr parestesia, la aguja se devuelve al hueso y, girando la extremidad hacia adentro 7-10 °, se avanza la aguja nuevamente hasta que aparece parestesia en el paciente. Anestesia del nervio ciático desde el abordaje posterior Técnica de anestesia. El paciente se acuesta sobre un lado sano, la extremidad anestesiada se dobla en las articulaciones de la cadera y la rodilla en un ángulo de 45-60°. Desde la parte más sobresaliente del trocánter mayor del fémur, se dibuja una línea recta hasta la espina ilíaca posterosuperior, desde la mitad de la cual se baja una perpendicular de 4-5 cm de largo en dirección caudal. como punto de proyección del nervio ciático. La aguja se inyecta en un ángulo de 90° con respecto al plano frontal del cuerpo del paciente y se avanza hasta obtener parestesia o contacto con el hueso. Si es necesario, la aguja se tira hacia arriba y se inserta aproximadamente 0,5 cm lateral o medial a la inyección original. Tener parestesia es imprescindible. Introduzca 20-25 ml de una solución al 2% de lidocaína (trimecaína). La técnica de anestesia no cambiará si el paciente se acuesta boca abajo. Anestesia en la fosa poplítea Para intervenciones quirúrgicas en la parte inferior de la pierna y el pie, es suficiente anestesiar los nervios tibial y peroneo en la fosa poplítea. La posición del paciente: sobre un lado sano o sobre el estómago. Puntos de referencia: tendones del bíceps, músculos semimembranoso y semitendinoso del muslo, rótula, músculo de la pantorrilla. Topografía. La fosa poplítea contiene fibra, vasos sanguíneos, nervios y ganglios linfáticos. El borde superior externo está formado por el tendón del músculo bíceps femoral, el borde superior interno está formado por los tendones de los músculos semimembranoso y semitendinoso, la cabeza lateral del músculo gastrocnemio está debajo y afuera, y la interna inferior es la medial. cabeza del músculo gastrocnemio. La proyección del ángulo superior de la fosa poplítea corresponde principalmente al borde superior de la rótula en la esquina superior de la fosa romboidal del nervio ciático y se divide en los nervios tibial y peroneo común. Este último desde el borde superior va al borde lateral del gastrocnemio y envuelve el cuello de la cabeza del peroné en forma de semiespiral. En la fosa poplítea, el nervio tibial pasa más superficialmente a lo largo de la línea media, una vena se encuentra más profunda y medialmente desde él, e incluso más profunda y medialmente, más cerca del hueso, está la arteria poplítea. Técnica de anestesia. La esquina superior de la fosa romboidal está al nivel del borde superior de la rótula. El punto de inyección se encuentra 1-1,5 cm por debajo del ángulo superior en la bisectriz bajada desde este ángulo, formado desde el exterior por el tendón del bíceps femoral, desde el interior por los tendones de los músculos semimembranoso y semitendinoso del muslo. La dirección del movimiento de la aguja es estrictamente vertical con el paciente en decúbito prono hasta que se obtiene la parestesia del nervio tibial. En ausencia de parestesia, la aguja se dirige en forma de abanico, tirando de ella cada vez hasta el nivel del tejido subcutáneo. Después de una prueba de aspiración, se inyectan 5-10 ml de una solución de trimecaína al 2%. Para bloquear el nervio peroneo común desde el mismo punto, la aguja se dirige lateralmente en un ángulo de 30-45° con respecto al plano frontal. Después de recibir parestesia, se inyectan 5-10 ml de una solución de trimecaína al 2%. No hay complicaciones ni contraindicaciones. Complicaciones de la anestesia regional Durante la AR, las complicaciones ocurren muy raramente y se pueden dividir en dos grupos. 1. Específicos, que están más relacionados con los errores técnicos de la metodología: 1) inyección errónea de un anestésico local en el canal espinal o espacio epidural, por vía intravenosa o intraarterial (con anestesia del plexo cervical, anestesia del plexo lumbar con acceso inguinal); 2) punción de cavidades y órganos (cavidad pleural, pulmón); 3) la formación de un hematoma con descuido de la punción y daño a un vaso grande; el hematoma comprime el tejido circundante o el haz neurovascular; 4) hipotensión severa y prolongada que ocurre con una rápida reabsorción del anestésico local; 5) lesión del plexo nervioso o conductor con el extremo de la aguja de inyección durante una manipulación brusca; 6) la ausencia de un efecto analgésico después de la anestesia del plexo o de conducción. 2. Inespecífica, manifestada principalmente por reacciones generales y locales del organismo a la acción de un anestésico local en forma de reacciones tóxicas y alérgicas. Pueden desarrollarse complicaciones inespecíficas dependiendo del tiempo, la dosis y el sitio de administración del anestésico. En este caso predominan las lesiones del sistema nervioso central o cardiovascular. Las complicaciones del lado del sistema nervioso central pueden ser leves (limitadas solo a la excitación central) o graves, que se manifiestan por inhibición del sistema nervioso central con posible parálisis total. La naturaleza de las complicaciones no específicas: 1) una sobredosis de anestésico con la administración simultánea de una dosis grande (más de 1 g) de trimecaína o lidocaína por vía intraarterial o intravenosa. Con la inyección intravascular de un anestésico local, las reacciones tóxicas aparecen de inmediato y con sobredosis del medicamento, después de 10 a 15 minutos. Las reacciones tóxicas graves con dosis excesivas de anestésicos locales son extremadamente raras. Mucho más a menudo (hasta la muerte) se observan con la administración intravascular de una solución altamente concentrada de anestésico local; 2) reacciones alérgicas a la introducción de un anestésico local, caracterizadas por un complejo de síntomas de trastornos del sistema nervioso central y cardiovascular: ansiedad, alteración de la conciencia, trastornos del habla, espasmos musculares, convulsiones, respiración profunda, alteración del ritmo cardíaco, expansión QR, disminución de la presión arterial, taquicardia, apnea, asistolia; 3) complicaciones infecciosas debido al procesamiento deficiente del campo quirúrgico en el sitio de la anestesia, esterilización insuficiente de jeringas, agujas y soluciones, así como en presencia de una infección local de la piel (pioderma) en el área de la manipulación intencionada; 4) el desarrollo de hipotensión con anestesia de plexos y de conducción es mucho menos común que con anestesia epidural y espinal, pero esto no reduce la importancia de corregir la hipovolemia; 5) con la introducción de soluciones concentradas de anestésicos locales en un pequeño porcentaje de casos, se observa el desarrollo de bradicardia, que se detiene bien con sulfato de atropina. Los casos de fibrilación ventricular y paro cardíaco son extremadamente raros. Contraindicaciones Las contraindicaciones son las siguientes. 1. Histeria. 2. Tendencia a agravarse. 3. Complicaciones neurológicas: hemiplejía y hemiparesia del área de anestesia propuesta, enfermedades de la médula espinal, esclerosis múltiple, enfermedades de los nervios periféricos. 4. Infección de la piel en la zona del punto de inyección de la aguja. 5. Septicemia. 6. Tendencia al sangrado e hipovolemia severa después de una pérdida masiva de sangre. 7. Anemia perniciosa (contraindicación relativa). 7. Anestesia epidural Su esencia radica en el bloqueo de los nervios espinales y sus raíces con un anestésico introducido en el espacio epidural. La técnica de conducción y la zona de anestesia se indican en la conferencia No. 2. Dosis y duración de la analgesia 1. La lidocaína se inyecta en un volumen de 4 ml (2%), la duración de la anestesia es de 4 horas. 2. La marcaína se administra a una dosis de 6-10 ml (0,5%), la duración de la anestesia es de 6-8 horas. 3. Naropin se administra a una dosis de 4-6 ml (1%), la duración de la anestesia es de 4-6 horas. Con este tipo de anestesia, la hemodinámica sufre, hay una fuerte disminución de la presión arterial. Por lo tanto, cuando se usa este tipo de anestesia, es necesario un control constante de la presión del paciente y, si es necesario, su corrección. 8. Anestesia lumbar Este tipo de anestesia se logra inyectando un anestésico en el canal espinal. La técnica de punción lumbar se describe en la conferencia No. 2. Las características son que el nivel de punción es más alto (T12-L1, L1-L2) y después de retirar el mandril de la aguja, se inyecta inmediatamente un anestésico. El volumen de anestésico es de 3-5 ml. Naropin se administra en una concentración de 0,5%, lidocaína, en 2%, marcaína, en 0,5%. La duración de la anestesia es de 4 a 6 horas, este tipo de anestesia también causa hipotensión severa. Con un alto nivel de anestesia (T12-L1) puede causar problemas respiratorios. La complicación más común es el dolor de cabeza. 9. Bloqueo vagosimpático cervical según A. V. Vishnevsky El paciente se coloca boca arriba sobre la mesa, de modo que la mano del lado del bloqueo propuesto cuelgue sobre el borde de la mesa. El músculo esternocleidomastoideo debe estar relajado. Se coloca un rodillo debajo de la cintura escapular, la cabeza se retrae en la dirección opuesta; en esta posición, los contornos anatómicos del cuello están bien definidos. El campo se trata con lubricación con alcohol y yodo. El médico se para del lado del bloqueo del mismo nombre. El sitio de inyección es el ángulo formado por la intersección del borde posterior del músculo esternocleidomastoideo con una vena. El dedo índice de la mano izquierda se coloca en el borde posterior del músculo esternocleidomastoideo, por encima del lugar donde se cruza con la vena yugular externa. Presionando fuertemente con un dedo en este lugar, intentan mover el haz neurovascular hacia la línea media. En este caso, el dedo palpa fácilmente la superficie anterior de las vértebras cervicales. La inyección de la aguja y su avance deben hacerse lentamente, hacia arriba y hacia adentro, siempre enfocándose en la superficie anterior de la columna. La aguja se mueve a lo largo de la solución de novocaína al 2% enviada en pequeñas porciones (3-0,25 cm), lo que garantiza la seguridad de la inyección. La jeringa durante la inyección se retira repetidamente de la aguja con el fin de controlar (sangre). Habiendo llevado la aguja a la vértebra, sienten cómo se apoya contra ella. Luego, la presión sobre la aguja se debilita, por lo que se aleja de 1 a 2 mm, después de lo cual se inyectan de 40 a 60 ml de una solución que, extendiéndose en un infiltrado progresivo a lo largo de la aponeurosis prevertebral, cubre el vago, simpático. , y a menudo nervios frénicos, que interrumpen (bloquean) la transmisión de irritaciones desde la región pleuropulmonar. La eficacia del bloqueo vagosimpático se evidencia por la aparición del síntoma de Horner (estrechamiento de la pupila, estrechamiento de la fisura palpebral y retracción del globo ocular). El ritmo respiratorio y el pulso se vuelven menos frecuentes, la dificultad para respirar y la cianosis disminuyen, y el estado general mejora. Para evitar que la aguja entre en los vasos del cuello, el músculo esternocleidomastoideo con el haz neurovascular subyacente debe moverse con suficiente fuerza con el dedo índice hacia la línea media. Es importante dirigir la aguja hacia arriba y hacia adentro, ya que moverla en dirección horizontal amenaza con introducir una solución debajo de la aponeurosis prevertebral y la posterior complicación en forma de un síndrome de dolor que no se detiene durante el día. Lección N° 14. Valoración de la gravedad del paciente y seguimiento Valoración del estado somático del paciente. 1 punto: pacientes cuya enfermedad está localizada y, por regla general, no causa trastornos sistémicos, es decir, personas prácticamente sanas. 2 puntos: esto incluye pacientes con trastornos no expresados que interrumpen moderadamente la actividad vital del cuerpo sin cambios pronunciados en la homeostasis. 3 puntos: pacientes con trastornos sistémicos vitales que interrumpen significativamente el funcionamiento del cuerpo, pero que no conducen a una discapacidad. 4 puntos: pacientes con trastornos sistémicos graves que representan un alto peligro para la vida humana y conducen a la discapacidad. 5 puntos: pacientes cuya condición se considera crítica, el riesgo de muerte dentro de las 24 horas es alto. El volumen y la naturaleza de la intervención quirúrgica: 1 punto - operaciones pequeñas para: extirpación de tumores superficiales y localizados, apertura de pequeños abscesos, amputación de dedos de manos y pies, ligadura y extirpación de hemorroides, apendicectomía y herniotomía sin complicaciones. 2 puntos: operaciones de gravedad moderada: extirpación de tumores malignos localizados superficialmente que requieren una intervención prolongada; apertura de abscesos localizados en cavidades; amputación y desarticulación de las extremidades superiores e inferiores; operaciones en buques periféricos; apendicectomía y herniotomía complicadas que requieren una intervención extensa; toracotomía y laparotomía de prueba; otros similares en complejidad y alcance de intervención. 3 puntos: intervenciones quirúrgicas extensas: operaciones radicales en los órganos abdominales (excepto las enumeradas anteriormente); operaciones radicales en los órganos de la cavidad torácica; amputaciones de extremidades extendidas, como la amputación transiliosacra; cirugía cerebral. 4 puntos: operaciones en el corazón, grandes vasos y otras intervenciones complejas realizadas en condiciones especiales (circulación artificial, hipotermia, etc.). Las intervenciones quirúrgicas de emergencia se evalúan, así como las programadas, según la condición física y el volumen de la operación, pero se incluyen en un grupo separado o se denotan además de la figura con el índice "C". Nota El riesgo operatorio y anestésico se designa de la siguiente manera: el numerador indica la gravedad de la condición inicial en puntos, el denominador indica el volumen de la operación, también en puntos. Clasificación del estado objetivo del paciente, elaborada por la Sociedad Americana de Anestesiólogos (ASA). 1. No hay trastornos sistémicos. 2. Trastornos sistémicos leves sin deterioro funcional. 3. Enfermedades sistémicas moderadas y graves con disfunción. 4. Enfermedad sistémica grave que constantemente representa una amenaza para la vida y conduce a la falla de las funciones. 5. Estado terminal, alto riesgo de muerte durante el día, independientemente de la operación. 6. Muerte encefálica, donación de órganos para trasplante. Si la intervención se lleva a cabo con carácter de emergencia, la evaluación del estado se complementa con la letra "E". La valoración del estado del paciente y la posible letalidad de cada caso se muestran en la tabla 7. Tabla 7 Valoración del estado del paciente y mortalidad perioperatoria
El monitoreo (Tabla 7) es el control de funciones y procesos, la identificación de sus desviaciones peligrosas para prevenir complicaciones, en particular, durante la anestesia y los cuidados intensivos. El seguimiento se lleva a cabo para controlar: 1) para las funciones del paciente (electrocardiografía, oximetría de pulso, capnografía, etc.); 2) acciones terapéuticas (control del bloqueo neuromuscular); 3) ambiente (composición del gas de la mezcla inhalada); 4) funcionamiento de los medios técnicos (ventilador, etc.). El seguimiento de funciones por grado de complejidad puede ser realizado por: 1) monitoreo continuo de parámetros; 2) control con señalización cuando un parámetro falla más allá de los límites establecidos; 3) monitoreo continuo con notificación cuando el parámetro supera los límites establecidos, y adicionalmente una pista para la solución; 4) lo mismo con la implementación de medidas para normalizar la función. La relevancia del seguimiento se debe a: 1) la complejidad y duración cada vez mayores de las intervenciones quirúrgicas; 2) un aumento en la gravedad de los trastornos funcionales en los pacientes; 3) la complicación de los medios técnicos utilizados en medicina crítica. Importancia del seguimiento: 1) diagnóstico oportuno de trastornos y prevención de complicaciones graves, incluido el paro cardíaco y respiratorio; 2) tácticas más adecuadas de cuidados intensivos y alta eficiencia de tratamiento. Indicaciones de seguimiento: 1) monitoreo mínimo - siempre obligatorio durante la anestesia y cuidados intensivos; 2) monitoreo en profundidad (métodos no invasivos e invasivos) en caso de violaciones significativas de las funciones del cuerpo, especialmente cuando un paciente desarrolla insuficiencia orgánica múltiple; 3) monitoreo preventivo: a riesgo de desarrollar una condición crítica. Normas de seguimiento. En 1978, la Junta Holandesa de Salud introdujo el primer estándar de monitoreo de quirófano, que enumeraba el equipo necesario para el monitoreo. En 1985, a sugerencia de las compañías de seguros, se propuso el estándar de monitoreo de Harvard para anestesiología, que proporciona parámetros para monitorear a los pacientes durante la anestesia durante la cirugía y el modo de tal monitoreo. Su introducción en la práctica redujo el riesgo de complicaciones anestésicas y la hizo más segura para el paciente. En Rusia, en 1997, el sistema MORF estableció normas para el control mínimo de la anestesia, la reanimación y los cuidados intensivos (Nº 161/DM-2 del 24 de febrero de 1997 "Sobre medidas para garantizar la seguridad de los pacientes durante la anestesia, la reanimación y los cuidados intensivos" ). Los datos se muestran en la tabla 8, tabla 9. Tabla 8 anestesia
Tabla 9 Realización de reanimación y cuidados intensivos.
Para llevar a cabo cuidados intensivos efectivos, es necesario monitorear los sistemas cardiovascular, respiratorio y nervioso, las funciones del hígado, los riñones, el tracto gastrointestinal, la hematopoyesis, la hemostasia, así como la energía, agua-electrólito, ácido-base y onco-osmótico balance. Igualmente importante es el seguimiento intensivo de las intervenciones terapéuticas en curso y sus resultados. El control del estado microbiológico externo e interno, así como el uso de criterios de pronóstico y evaluación de resultados, juegan un papel importante. En primer lugar, es necesario utilizar una evaluación clínica del estado del paciente y métodos de monitorización no invasivos. El seguimiento clínico, es decir, la observación de signos y síntomas clínicos, datos cualitativos, no es menos importante que los indicadores cuantitativos obtenidos mediante tecnología sofisticada. Supervisión de la función del sistema Monitoreo del sistema circulatorio El monitoreo de la circulación permite la detección oportuna de arritmias cardíacas e isquemia miocárdica mediante el uso de electrocardiografía. Las arritmias cardíacas pueden identificarse por la onda P y el complejo ORS en el electrocardiomonitor en las derivaciones V1 y V2 de la derivación estándar de las extremidades o sus modificaciones. La isquemia miocárdica se puede identificar por la depresión resultante del segmento ST en el ECG: 1) en la derivación torácica V5, así como en una de sus modificaciones: isquemia del tabique de la pared lateral izquierda; 2) derivación estándar 2 de las extremidades: isquemia de la zona basal del miocardio en la cuenca de la arteria coronaria derecha. La depresión (elevación) del ST descendente es un indicador de isquemia inducida por estrés. El control de la hemodinámica se lleva a cabo mediante: 1) mediciones de la presión arterial; 2) mediciones de CVP en combinación con pruebas de estrés volumétrico (esta es información sobre el llenado vascular); 3) la determinación de la presión de la arteria pulmonar y la presión de enclavamiento (PWP) utilizando un catéter de arteria pulmonar flotante es un método más preciso para evaluar el volumen intravascular que la PVC y también puede servir como una medida de la precarga del ventrículo izquierdo; 4) determinación del gasto cardíaco mediante una técnica de termodilución, el método de Fick (CO = VCO2 /CaCO2), varias modificaciones de la técnica Doppler (ecocardiografía Doppler esofágica), ultrasonido del corazón. Monitoreo de la respiración El monitoreo respiratorio se realiza de acuerdo a los síntomas clínicos y datos de capnografía, pulsioximetría, espirometría volumétrica y gasometría periódica. Durante la ventilación mecánica, la presión en el sistema "ventilador - paciente" y la concentración de oxígeno en la mezcla inhalada (FiO2). Signos clínicos de insuficiencia respiratoria: frecuencia (más de 24-30 por minuto para adultos) respiración superficial, participación en la respiración de músculos adicionales (esternocleidomastoideo, abdominal y otros, que se manifiesta por retracción de los espacios intercostales, hinchazón de las alas de la nariz, posición semisentada forzada), sudoración, cianosis, un cambio en la frecuencia cardíaca (primero aumento, y luego puede haber arritmia) y presión arterial (aumento, y con hipoxia severa - disminución), un cambio en la conciencia de euforia a coma. La capnografía permite la detección oportuna de trastornos de la ventilación: hipoventilación (aumento de CO2 en el aire exhalado final - FetCO2 > 6,4%), hiperventilación (FetCO2 < 4,9%), ventilación desigual (ángulo de inclinación de la meseta del capnograma alveolar - 5°). Durante la ventilación mecánica, si no hay capnógrafo, el volumen de ventilación está controlado por el volumen minuto de respiración (Vist.), medido con un espirómetro volumétrico, que se instala en la vía espiratoria. Además, se monitorea el volumen inspiratorio minuto (Vappar.), el cual es necesario para calcular la concentración de oxígeno en la mezcla de gases inhalados y determinar la estanqueidad de este sistema - "ventilador-paciente". El control de estanqueidad también se logra mediante la presión en el sistema "device-sick", medida por medio de un monovacuómetro. La oximetría de pulso permite la detección oportuna de problemas de oxigenación en los pulmones, hipoxemia (SaO2 <94%. Además, según la naturaleza del pletismograma, se puede juzgar el estado de la microcirculación y el gasto cardíaco. Un estudio adicional de los gases en sangre ayuda a evaluar el grado de alteración del intercambio de gases en los pulmones (por la magnitud del gradiente alveolo-arterial de la tensión de oxígeno). Algunos monitores pueden proporcionar una evaluación de la biomecánica de la respiración durante la ventilación mecánica en función de la distensibilidad de los pulmones y el pecho (C, normalmente 60-100 ml) y la resistencia (resistencia) de las vías respiratorias (R, normalmente 2-3 cm). Monitorización de funciones neurológicas El control de las funciones neurológicas se lleva a cabo evaluando la conciencia en la escala de Glasgow (basada en la reacción de apertura de los ojos, respuestas motoras y verbales a un estímulo creciente: 15 puntos - normal, 3 puntos - muerte cerebral). Además, se determinan la presión intracraneal y el flujo sanguíneo cerebral (por ejemplo, utilizando un monitor Doppler transcraneal). La función renal se controla más comúnmente midiendo la producción de orina por hora, que normalmente es > 0,5 ml/kg/h. Conferencia número 15. Ventilación pulmonar artificial La ventilación pulmonar artificial (ALV) proporciona intercambio de gases entre el aire circundante (o una determinada mezcla de gases) y los alvéolos de los pulmones, se utiliza como medio de reanimación en caso de un cese repentino de la respiración, como componente de la anestesia y como medio de cuidados intensivos para insuficiencia respiratoria aguda, así como algunas enfermedades de los sistemas nervioso y muscular. Los métodos modernos de ventilación pulmonar artificial (ALV) se pueden dividir en simples y hardware. En situaciones de emergencia (apnea, con ritmo anormal, respiración agónica, con aumento de la hipoxemia y (o) hipercapnia, y trastornos metabólicos severos, se suele utilizar un método simple de ventilación mecánica). Los métodos espiratorios de IVL (respiración artificial) de boca a boca y de boca a nariz son sencillos. Los métodos de hardware se utilizan si es necesario para la ventilación mecánica a largo plazo (desde una hora hasta varios meses e incluso años). El respirador Phase-50 tiene un gran potencial. Para la práctica pediátrica, se produce el aparato "Vita-1". El respirador se conecta a las vías respiratorias del paciente a través de un tubo endotraqueal o una cánula de traqueotomía. La ventilación del hardware se lleva a cabo en el modo de frecuencia normal, que oscila entre 12 y 20 ciclos por 1 min. En la práctica, existen ventilaciones mecánicas en modo de alta frecuencia (más de 60 ciclos por 1 min), en las que el volumen corriente disminuye notablemente (hasta 150 ml o menos), disminuye la presión positiva en los pulmones al final de la inspiración, así como mejora la presión intratorácica y el flujo sanguíneo al corazón. Además, en modo de alta frecuencia, se facilita la adaptación del paciente al respirador. Hay tres métodos de ventilación de alta frecuencia: volumétrica, oscilatoria y jet. El volumen generalmente se lleva a cabo con una frecuencia respiratoria de 80-100 por 1 min, IVL oscilatorio - 600-3600 por 1 min, lo que garantiza la vibración de un flujo de gas continuo o intermitente. La ventilación de chorro de alta frecuencia más difundida con una frecuencia respiratoria de 100-300 por minuto, en la que se inyecta un chorro de oxígeno a una presión de 1-2 atm en las vías respiratorias a través de una aguja o catéter con un diámetro de 2-4 milímetro La ventilación a chorro se lleva a cabo a través de un tubo endotraqueal o traqueotomía (al mismo tiempo, se aspira aire atmosférico hacia el tracto respiratorio) y a través de un catéter que se inserta en la tráquea a través del conducto nasal o por vía percutánea (punción). Este último es importante en situaciones donde no existen condiciones para la intubación traqueal. La ventilación artificial de los pulmones se puede llevar a cabo en modo automático, pero esto es aceptable en los casos en que la respiración espontánea del paciente está completamente ausente o suprimida por fármacos farmacológicos (relajantes musculares). También se realiza ventilación asistida, pero en este caso se preserva la respiración independiente del paciente. El gas se suministra después de que el paciente haga un débil intento de inhalar, o el paciente se sincroniza con un modo de funcionamiento del aparato seleccionado individualmente. También hay un modo de ventilación obligatoria intermitente (PMV) que se aplica durante la transición gradual de la ventilación mecánica a la respiración espontánea. En este caso, el paciente respira por sí mismo, pero además, se suministra un flujo continuo de la mezcla de gases a las vías respiratorias. En este contexto, con una frecuencia determinada (de 10 a 1 vez por minuto), el dispositivo realiza una respiración artificial, coincidiendo (PVL sincronizada) o no coincidiendo (PVL no sincronizada) con la inspiración independiente del paciente. La reducción gradual de las respiraciones artificiales permite preparar al paciente para la respiración espontánea. Los circuitos de respiración se muestran en la Tabla 10. Tabla 10 Circuitos respiratorios
La ventilación manual con una bolsa o máscara está fácilmente disponible y, a menudo, es suficiente para inflar adecuadamente los pulmones. Su éxito, por regla general, está determinado por la selección correcta del tamaño de la máscara y la experiencia del operador, y no por la gravedad de la patología pulmonar. Показания 1. Reanimación y preparación del paciente en un corto periodo de tiempo para su posterior intubación. 2. Ventilación periódica con bolsa y mascarilla para evitar atelectasias postextubación. 3. Restricciones a la ventilación con bolsa y mascarilla. Equipo Se utiliza una bolsa de respiración convencional y una máscara con un manómetro instalado o una bolsa de respiración autoinflable con cámara de oxígeno. Técnica de 1. Es necesario colocar la máscara firmemente sobre la cara del paciente, dando a la cabeza del paciente una posición mediana con el mentón fijado con un dedo. La máscara no debe estar sobre los ojos. 2. Frecuencia respiratoria - generalmente 30-50 por 1 min. 3. Presión inspiratoria: generalmente 20-30 cm de agua. Arte. 4. Mayor presión (30-60 cm de columna de agua) es aceptable durante la reanimación primaria en la actividad laboral de una mujer. Evaluación de efectividad 1. Retorno de la frecuencia cardíaca a números normales y desaparición de la cianosis central. 2. La excursión del tórax debe ser buena, la respiración se realiza igualmente bien en ambos lados. 3. El estudio de la composición gaseosa de la sangre suele ser necesario y se realiza durante la reanimación prolongada. Complicaciones 1. Neumotórax. 2. Hinchazón. 3. Síndrome de hipoventilación o episodios de apnea. 4. Irritación de la piel del rostro. 5. Desprendimiento de retina (cuando se aplica una máscara a los ojos y se crea una presión máxima alta a largo plazo). 6. La ventilación con mascarilla y bolsa puede empeorar el estado del paciente si éste se resiste activamente al procedimiento. Herrajes IVL Показания 1. Apnea. 2. Coma en el período agudo, incluso sin signos de insuficiencia respiratoria. 3. Convulsiones no controladas por la terapia anticonvulsiva estándar. 4. Shock de cualquier etiología. 5. Aumento de la dinámica del síndrome de depresión del SNC en el síndrome de hiperventilación. 6. Con una lesión espinal de nacimiento en recién nacidos: la aparición de respiración forzada y sibilancias crepitantes generalizadas en el contexto de dificultad para respirar. 7. OR2 Sangre capilar inferior a 50 mm Hg. Arte. durante la respiración espontánea con una mezcla con FiO2 0,6 o más. 8. OSR2 sangre capilar más de 60 mm Hg. Arte. o menos de 35 mm Hg. Arte. con respiración espontánea. Equipos: "PHASE-5", "BP-2001", "Infant-Star 100 o 200", "Sechrist 100 o 200", "Babylog 1", "Stephan", etc. Principios de tratamiento 1. La oxigenación en pulmones rígidos se puede lograr aumentando la concentración de oxígeno inspirado, aumentando la presión inspiratoria, aumentando la PEEP, prolongando el tiempo inspiratorio, aumentando la presión de meseta. 2. Ventilación (eliminación de CO2) puede mejorarse mediante un aumento en el volumen corriente, un aumento en la frecuencia y una prolongación del tiempo espiratorio. 3. La selección de los parámetros de ventilación (frecuencia, presión inspiratoria, meseta inspiratoria, relación inspiratoria-espiratoria, PEEP) variará según la naturaleza de la enfermedad subyacente y la respuesta del paciente a la terapia. Propósitos de IVL 1. Oxígeno: alcanzar pO2 50-100 mmHg Arte. 2. Mantener pCO2 dentro de 35-45 mm Hg. Arte. 3. Excepciones: en algunas situaciones, indicadores pO2 y pCO2 puede diferir de lo anterior: 1) en patología pulmonar crónica, valores de pCO más elevados2 portátil; 2) con defectos cardíacos graves, se toleran números de pO más pequeños2; 3) dependiendo del abordaje terapéutico en caso de hipertensión pulmonar se toleran valores de pCO mayores o menores2. 4. Siempre se deben documentar las indicaciones y los parámetros de ventilación. Técnica de 1. Parámetros iniciales de IVL: presión inspiratoria 20-24 cm de agua. Arte.; PEER de 4-6 cm de agua. Arte.; frecuencia respiratoria 16-24 por 1 min, tiempo de inhalación 0,4-0,6 s, DO de 6 a 10 l / min, MOV (volumen de ventilación por minuto) 450-600 ml / min. 2. Sincronización con un respirador. Por regla general, los pacientes están sincronizados con el respirador. Pero la excitación puede afectar la sincronización, en tales casos, puede ser necesaria una terapia con medicamentos (morfina, promedol, hidroxibutirato de sodio, relajantes musculares). Encuesta 1. Un componente importante de la encuesta son las pruebas repetidas de gases en sangre. 2. Examen físico. Control de la adecuación del IVL. Al realizar la ventilación de emergencia con un método simple, basta con observar el color de la piel y los movimientos del tórax del paciente. La pared torácica debe expandirse con cada inhalación y caer con cada exhalación, pero si la región epigástrica se eleva, entonces el aire soplado ingresa al esófago y al estómago. La razón es a menudo la posición incorrecta de la cabeza del paciente. Al realizar ventilación mecánica a largo plazo, es necesario juzgar su idoneidad. Si la respiración espontánea del paciente no es suprimida por preparaciones farmacológicas, entonces uno de los principales signos de la idoneidad de la IVL realizada es la buena adaptación del paciente al respirador. En presencia de una conciencia clara, el paciente no debe tener una sensación de falta de aire, incomodidad. Los sonidos respiratorios en los pulmones deben ser iguales en ambos lados y la piel debe tener un color normal. Complicaciones 1. Las complicaciones más comunes de la ventilación mecánica son: ruptura de los alvéolos con desarrollo de enfisema intersticial, neumotórax y neumomediastinitis. 2. Otras complicaciones pueden ser: contaminación e infección bacteriana, obturación del tubo endotraqueal o extubación, intubación unipulmonar, neumopericarditis con taponamiento cardíaco, disminución del retorno venoso y disminución del gasto cardíaco, cronicidad del proceso en los pulmones, estenosis y obstrucción del la tráquea En el contexto de la ventilación mecánica, es posible usar una serie de analgésicos, que deben proporcionar un nivel y una profundidad de anestesia suficientes en dosis, cuya introducción en condiciones de respiración espontánea iría acompañada de hipoxemia. Al mantener un buen suministro de oxígeno a la sangre, la ventilación mecánica contribuye a que el cuerpo haga frente a la lesión quirúrgica. En muchas operaciones en los órganos del tórax (pulmones, esófago), se utiliza la intubación bronquial separada, lo que permite desconectar la ventilación de un pulmón durante las intervenciones quirúrgicas para facilitar el trabajo del cirujano. Esta intubación también evita que el contenido del pulmón operado se filtre al pulmón sano. Durante las operaciones de laringe y vías respiratorias se utiliza ventilación transcatéter de alta frecuencia, que facilita la exploración del campo quirúrgico y permite mantener un adecuado intercambio gaseoso con la tráquea y los bronquios abiertos. En condiciones de anestesia general y relajación muscular, el paciente no es capaz de responder a la hipoxia e hipoventilación resultantes, por lo tanto, es importante controlar el contenido de gases en sangre (monitorización continua de la presión parcial de oxígeno y la presión parcial de dióxido de carbono) por medios percutáneos. mediante sensores especiales. En caso de muerte clínica o agonía, la ventilación mecánica es un componente obligatorio de la reanimación. Es posible dejar de realizar IVL solo después de que la conciencia se restablezca por completo y se complete la respiración espontánea. En el complejo de cuidados intensivos, la ventilación mecánica es el método más eficaz para el tratamiento de la insuficiencia respiratoria aguda. Se lleva a cabo a través de un tubo que se introduce en la tráquea a través de las fosas nasales inferiores o traqueotomía. De particular importancia es el cuidado de las vías respiratorias, su drenaje adecuado. La ventilación mecánica auxiliar se utiliza en sesiones de 30-40 minutos para el tratamiento de pacientes con insuficiencia respiratoria crónica. IVL se usa en pacientes en estado de coma (trauma, cirugía cerebral), así como con daño periférico en los músculos respiratorios (polirradiculoneuritis, lesión de la médula espinal, esclerosis lateral amiotrófica). ALV también se usa ampliamente en el tratamiento de pacientes con trauma torácico, diversas intoxicaciones, accidentes cerebrovasculares, tétanos y botulismo. Conferencia No. 16. Terapia de infusión La terapia de infusión es una inyección por goteo o infusión por vía intravenosa o debajo de la piel de medicamentos y fluidos biológicos para normalizar el equilibrio hidroelectrolítico, ácido-base del cuerpo, así como para la diuresis forzada (en combinación con diuréticos). Indicaciones para la terapia de infusión: todo tipo de shock, pérdida de sangre, hipovolemia, pérdida de líquidos, electrolitos y proteínas como resultado de vómitos indomables, diarrea intensa, negativa a tomar líquidos, quemaduras, enfermedad renal; violaciones del contenido de iones básicos (sodio, potasio, cloro, etc.), acidosis, alcalosis y envenenamiento. Los principales signos de deshidratación del cuerpo: retracción de los globos oculares en las órbitas, córnea opaca, piel seca e inelástica, palpitaciones características, oliguria, la orina se vuelve concentrada y de color amarillo oscuro, el estado general es deprimido. Las contraindicaciones para la terapia de infusión son insuficiencia cardiovascular aguda, edema pulmonar y anuria. Las soluciones cristaloides pueden compensar la deficiencia de agua y electrolitos. Aplicar solución de cloruro de sodio al 0,85 %, soluciones de Ringer y Ringer-Locke, solución de cloruro de sodio al 5 %, soluciones de glucosa al 5-40 % y otras soluciones. Se administran por vía intravenosa y subcutánea, por chorro (con deshidratación severa) y por goteo, en un volumen de 10-50 ml/kg o más. Estas soluciones no causan complicaciones, salvo sobredosis. Los objetivos de la terapia de infusión son: restauración de BCC, eliminación de la hipovolemia, aseguramiento de un gasto cardíaco adecuado, mantenimiento y restauración de la osmolaridad plasmática normal, aseguramiento de una microcirculación adecuada, prevención de la agregación de células sanguíneas, normalización de la función de transporte de oxígeno de la sangre. Las soluciones coloidales son soluciones de sustancias macromoleculares. Contribuyen a la retención de líquidos en el lecho vascular. Se usan hemodez, poliglucina, reopoliglyukina, reogluman. Con su introducción, son posibles las complicaciones, que se manifiestan en forma de una reacción alérgica o pirogénica. Vías de administración: por vía intravenosa, con menos frecuencia por vía subcutánea y por goteo. La dosis diaria no supera los 30-40 ml/kg. Tienen una cualidad desintoxicante. Como fuente de nutrición parenteral, se utilizan en caso de negativa prolongada a comer o incapacidad para alimentarse por la boca. Se utilizan hidrolisinas de sangre y caseína (alvezin-neo, poliamina, lipofundina, etc.). Contienen aminoácidos, lípidos y glucosa. A veces hay una reacción alérgica a la introducción. Tasa y volumen de infusión. Todas las infusiones en términos de velocidad de infusión volumétrica se pueden dividir en dos categorías: que requieren y que no requieren una corrección rápida de la deficiencia de BCC. El principal problema pueden ser los pacientes que necesitan una rápida eliminación de la hipovolemia. es decir, la tasa de infusión y su volumen deben asegurar el desempeño del corazón para suministrar adecuadamente la perfusión regional de órganos y tejidos sin una centralización significativa de la circulación sanguínea. En pacientes con un corazón inicialmente sano, tres puntos de referencia clínicos son más informativos: PA media > 60 mm Hg. Arte.; Presión venosa central - PVC > 2 cm de agua. Arte.; diuresis 50 ml/h. En casos dudosos, se realiza una prueba con una carga en volumen: se vierten 15-20 ml de una solución cristaloide durante 400-500 minutos y se observa la dinámica de CVP y diuresis. Un aumento significativo de la CVP sin un aumento de la diuresis puede indicar insuficiencia cardíaca, lo que sugiere la necesidad de métodos más complejos e informativos para evaluar la hemodinámica. Mantener ambos valores bajos sugiere hipovolemia, luego se mantiene una tasa de infusión alta con evaluación repetida paso a paso. Un aumento de la diuresis indica oliguria prerrenal (hipoperfusión de los riñones de origen hipovolémico). La terapia de infusión en pacientes con insuficiencia circulatoria requiere un conocimiento claro de la hemodinámica, monitoreo de monitor grande y especial. Los dextranos son sustitutos del plasma coloidal, lo que los hace altamente efectivos en la recuperación rápida de BCC. Los dextranos tienen propiedades protectoras específicas contra las enfermedades isquémicas y la reperfusión, cuyo riesgo siempre está presente durante las intervenciones quirúrgicas mayores. Los aspectos negativos de los dextranos incluyen el riesgo de hemorragia por disgregación plaquetaria (especialmente característica de la reopoliglucina), cuando se hace necesario el uso de dosis importantes del fármaco (> 20 ml/kg), y un cambio temporal en las propiedades antigénicas de la sangre. Los dextranos son peligrosos debido a su capacidad para causar una "quemadura" del epitelio de los túbulos de los riñones y, por lo tanto, están contraindicados en la isquemia renal y la insuficiencia renal. A menudo provocan reacciones anafilácticas, que pueden ser bastante graves. De particular interés es una solución de albúmina humana, ya que es un coloide natural de un sustituto del plasma. En muchas condiciones críticas acompañadas de daño en el endotelio (principalmente en todo tipo de enfermedades inflamatorias sistémicas), la albúmina es capaz de pasar al espacio intercelular del lecho extravascular, atrayendo agua y empeorando el edema del tejido intersticial, principalmente los pulmones. El plasma fresco congelado es un producto tomado de un solo donante. El FFP se separa de la sangre completa y se congela inmediatamente dentro de las 6 horas posteriores a la extracción de sangre. Almacenado a 30°C en bolsas de plástico durante 1 año. Dada la labilidad de los factores de coagulación, el FFP debe infundirse dentro de las primeras 2 horas después de la descongelación rápida a 37°C. La transfusión de plasma fresco congelado (PFC) da un alto riesgo de contraer infecciones peligrosas, como VIH, hepatitis B y C, etc. La frecuencia de reacciones anafilácticas y pirogénicas durante la transfusión de PFC es muy alta, por lo que la compatibilidad según el sistema ABO deberia ser tomado en un cuenta. Y para las mujeres jóvenes, se debe considerar la compatibilidad Rh. Actualmente, la única indicación absoluta para el uso de FFP es la prevención y el tratamiento del sangrado coagulopático. FFP realiza dos funciones importantes a la vez: hemostático y mantenimiento de la presión oncótica. La FFP también se transfunde con hipocoagulación, con sobredosis de anticoagulantes indirectos, con plasmaféresis terapéutica, con DIC aguda y con enfermedades hereditarias asociadas con una deficiencia de factores de coagulación de la sangre. Los indicadores de una terapia adecuada son una conciencia clara del paciente, piel cálida, hemodinámica estable, ausencia de taquicardia severa y dificultad para respirar, diuresis suficiente, dentro de 30-40 ml/h. 1. Transfusión de sangre Complicaciones de la transfusión de sangre: trastornos postransfusionales del sistema de coagulación de la sangre, reacciones pirogénicas graves con presencia de síndrome de hipertermia y descompensación cardiovascular, reacciones anafilácticas, hemólisis eritrocitaria, insuficiencia renal aguda, etc. La base de la mayoría de las complicaciones es la reacción de rechazo por parte del cuerpo del tejido extraño. No existen indicaciones para la transfusión de sangre entera enlatada, porque el riesgo de reacciones y complicaciones post transfusionales es importante, pero lo más peligroso es el alto riesgo de infección del receptor. En caso de pérdida aguda de sangre durante la intervención quirúrgica y reposición adecuada de la deficiencia de BCC, incluso una fuerte disminución de la hemoglobina y el hematocrito no amenaza la vida del paciente, ya que el consumo de oxígeno bajo anestesia se reduce significativamente, la oxigenación adicional es aceptable, la hemodilución ayuda prevenir la aparición de microtrombosis y la movilización de eritrocitos del depósito, aumentar la velocidad del flujo sanguíneo, etc. Las "reservas" de glóbulos rojos que tiene una persona por naturaleza superan significativamente las necesidades reales, especialmente en un estado de reposo, en el que el paciente está en este momento. Recomendaciones para la prescripción de transfusión de sangre y eritrocitos de donante durante la cirugía. 1. La transfusión de masa de eritrocitos se realiza después de la restauración del BCC. 2. En presencia de patología grave concomitante, que puede conducir a la muerte (por ejemplo, la anemia grave es mal tolerada en la enfermedad coronaria grave). 3. En presencia de los siguientes indicadores de sangre roja del paciente: 70-80 g / l para hemoglobina y 25% para hematocrito, y la cantidad de glóbulos rojos es de 2,5 millones. Las indicaciones para la transfusión de sangre son: sangrado y corrección de la hemostasia. Tipos de eritrocitos: sangre entera, masa de eritrocitos, EMOLT (masa de eritrocitos separada de leucocitos, plaquetas con solución salina). La sangre se administra por vía intravenosa por goteo, utilizando un sistema desechable a razón de 60-100 gotas por minuto, en un volumen de 30-50 ml/kg. Antes de la transfusión de sangre, es necesario determinar el tipo de sangre y el factor Rh del receptor y del donante, realizar una prueba de compatibilidad y se realiza una prueba biológica de compatibilidad al lado de la cama del paciente. Cuando ocurre una reacción anafiláctica, se detiene la transfusión y comienzan las medidas para eliminar el shock. El concentrado de plaquetas estándar es una suspensión de plaquetas dos veces centrifugadas. El recuento mínimo de plaquetas es 0,5 x 1012 por litro, leucocitos: 0,2 x 109 por litro. Las características hemostáticas y la supervivencia son más pronunciadas en las próximas 12 a 24 horas de preparación, pero el medicamento se puede usar dentro de los 3 a 5 días posteriores al momento de la extracción de sangre. El concentrado de plaquetas se usa para la trombocitopenia (leucemia, aplasia de la médula ósea), trombopatía con síndrome hemorrágico. 2. Nutrición parenteral En enfermedades graves acompañadas de graves alteraciones de la homeostasis, es necesario dotar al organismo de energía y materia plástica. Por lo tanto, cuando la nutrición por la boca está alterada o es completamente imposible por alguna razón, es necesario transferir al paciente a nutrición parenteral. En condiciones críticas de diversas etiologías, los cambios más significativos ocurren en el metabolismo de las proteínas: se observa una proteólisis intensa, especialmente en los músculos estriados. Dependiendo de la gravedad del proceso en curso, las proteínas corporales se catabolizan en una cantidad de 75 a 150 g por día (las pérdidas diarias de proteínas se muestran en la Tabla 11). Esto conduce a una deficiencia de aminoácidos esenciales, que se utilizan como fuente de energía en el proceso de gluconeogénesis, lo que da como resultado un balance de nitrógeno negativo. Tabla 11 Pérdida diaria de proteínas en condiciones críticas
La pérdida de nitrógeno conduce a una disminución del peso corporal, ya que: 1 g de nitrógeno \u6,25d 25 g de proteína (aminoácidos) \uXNUMXd XNUMX g de tejido muscular. Dentro de un día desde el inicio de una condición crítica, sin una terapia adecuada con la introducción de una cantidad suficiente de nutrientes esenciales, sus propias reservas de carbohidratos se agotan y el cuerpo recibe energía de proteínas y grasas. En este sentido, no solo se llevan a cabo cambios cuantitativos, sino también cualitativos en los procesos metabólicos. Las principales indicaciones de la nutrición parenteral son: 1) anomalías en el desarrollo del tracto gastrointestinal (atresia esofágica, estenosis pilórica y otras, período pre y postoperatorio); 2) quemaduras y lesiones de la cavidad bucal y faringe; 3) quemaduras corporales extensas; 4) peritonitis; 5) íleo paralítico; 6) fístulas intestinales altas; 7) vómitos indomables; 8) coma; 9) enfermedades graves acompañadas de un aumento de los procesos catabólicos y trastornos metabólicos descompensados (sepsis, formas graves de neumonía); 10) atrofia y distrofia; 11) anorexia por neurosis. La nutrición parenteral debe llevarse a cabo en condiciones de compensación de trastornos volémicos, hidroelectrolíticos, eliminación de trastornos de la microcirculación, hipoxemia y acidosis metabólica. El principio básico de la nutrición parenteral es proporcionar al organismo una cantidad adecuada de energía y proteínas. Para fines de nutrición parenteral, se utilizan las siguientes soluciones. Hidratos de carbono: El fármaco más aceptable utilizado a cualquier edad es la glucosa. La proporción de carbohidratos en la dieta diaria debe ser de al menos 50-60%. Para una utilización completa, se requiere mantener la velocidad de administración, la glucosa debe suministrarse con ingredientes - insulina 1 unidad por 4 g, potasio, coenzimas involucradas en la utilización de energía: fosfato de piridoxal, cocarboxilasa, ácido lipoico y ATP - 0,5-1 mg/kg por día por vía intravenosa. Cuando se administra correctamente, la glucosa altamente concentrada no provoca diuresis osmótica ni un aumento significativo de los niveles de azúcar en sangre. Para la nutrición con nitrógeno, se utilizan hidrolizados de proteínas de alta calidad (aminosol, aminona) o soluciones de aminoácidos cristalinos. Estos medicamentos combinan con éxito aminoácidos esenciales y no esenciales, son poco tóxicos y rara vez causan una reacción alérgica. Las dosis de las preparaciones de proteínas administradas dependen del grado de violación del metabolismo de las proteínas. En los trastornos compensados, la dosis de proteína administrada es de 1 g/kg de peso corporal al día. La descompensación del metabolismo de las proteínas, que se manifiesta por hipoproteinemia, disminución de la relación albúmina-globulina, aumento de la urea en la orina diaria, requiere la introducción de dosis aumentadas de proteínas (3-4 g/kg por día) y terapia anticatabólica. Esto incluye hormonas anabólicas (retabolil, nerabolil - 25 mg por vía intramuscular 1 vez en 5-7 días), construyendo un programa de nutrición parenteral en el modo de hiperalimentación (140-150 kcal / kg de peso corporal por día), inhibidores de la proteasa (kontrykal, trasylol 1000 U/kg por día durante 5-7 días). Para una adecuada asimilación del material plástico, cada gramo de nitrógeno introducido debe aportar 200-220 kcal. Las soluciones de aminoácidos no deben administrarse con soluciones concentradas de glucosa, ya que forman mezclas tóxicas. Contraindicaciones relativas a la introducción de aminoácidos: insuficiencia renal y hepática, shock e hipoxia. Las emulsiones grasas que contienen ácidos grasos poliinsaturados se utilizan para corregir el metabolismo de las grasas y aumentar el contenido calórico de la nutrición parenteral. La grasa es el producto más alto en calorías, sin embargo, para su utilización, es necesario mantener dosis óptimas y la velocidad de administración. Las emulsiones grasas no deben administrarse junto con soluciones concentradas de glucosa poliiónica, ni antes ni después de las mismas. Contraindicaciones para la introducción de emulsiones grasas: insuficiencia hepática, lipemia, hipoxemia, estados de shock, síndrome trombohemorrágico, trastornos de la microcirculación, edema cerebral, diátesis hemorrágica. Los datos requeridos de los ingredientes principales para la nutrición parenteral se dan en la Tabla 12 y la Tabla 13. Tabla 12 Dosis, índices, contenido calórico de los principales ingredientes para nutrición parenteral
Al prescribir nutrición parenteral, es necesario introducir dosis óptimas de vitaminas que están involucradas en muchos procesos metabólicos, siendo las coenzimas en las reacciones de utilización de energía. Tabla 13 Dosis de vitaminas (en mg por 100 kcal) requeridas durante la nutrición parenteral
El programa de nutrición parenteral, llevado a cabo en cualquier modo, debe elaborarse en términos de una proporción equilibrada de ingredientes. La proporción óptima de proteínas, grasas, carbohidratos es 1: 1,8: 5,6. Para la descomposición e inclusión de proteínas, grasas y carbohidratos en el proceso de síntesis, es necesaria una cierta cantidad de agua. La relación entre la necesidad de agua y el contenido calórico de los alimentos es de 1 ml H2O - 1 kcal (1: 1). Cálculo de la necesidad de consumo de energía en reposo (ERP) según Harris-Benedict: Hombres - EZP = 66,5 + 13,7 x peso, kg + 5 x altura, cm - 6,8 x edad (años). Mujeres - EZP = 66,5 + 9,6 x peso, kg + 1,8 x altura, cm - 4,7 x edad (años). El valor EZP, determinado por la fórmula de Harris-Benedict, promedia 25 kcal/kg por día. Después del cálculo, se seleccionan el factor de actividad física (PFA) del paciente, el factor de actividad metabólica (FMA) basado en el estado clínico y el factor de temperatura (TF), con la ayuda de la cual se determina el requerimiento energético (E) de un determinado se determinará el paciente. Los coeficientes para el cálculo de FFA, FMA y TF se muestran en la Tabla 14. Tabla 14 Coeficiente para el cálculo de FFA, FMA y TF
Para determinar el PE diario, el valor EZP se multiplica por FFA, FMA y TF. 3. Terapia de desintoxicación En intoxicaciones graves, es necesaria una terapia de desintoxicación activa, dirigida a unir y eliminar las toxinas del cuerpo. Para este propósito, las soluciones de polivinilpirrolidona (neocompensan, gemodez) y gelatinol se usan con mayor frecuencia, adsorbiendo y neutralizando las toxinas, que luego son excretadas por los riñones. Estas soluciones se administran gota a gota en una cantidad de 5-10 ml/kg de peso del paciente, añadiéndoles vitamina C y solución de cloruro potásico en una cantidad mínima de 1 mmol/kg de peso corporal. Mafusol, que es un antihipoxante y antioxidante eficaz, también tiene una propiedad desintoxicante pronunciada. Además, mejora la microcirculación y las propiedades reológicas de la sangre, lo que también contribuye al efecto de desintoxicación. Con varios envenenamientos, uno de los métodos más efectivos de desintoxicación es la diuresis forzada. Los líquidos intravenosos con el fin de forzar la diuresis se prescriben para grados severos de envenenamiento y para los más leves, cuando el paciente se niega a beber. Las contraindicaciones para la diuresis forzada son: insuficiencia cardiovascular aguda e insuficiencia renal aguda (anuria). Llevar a cabo la diuresis forzada requiere una contabilidad estricta del volumen y la composición cuantitativa del líquido inyectado, la designación oportuna de diuréticos, un control clínico y bioquímico claro. Como solución principal para la carga de agua se propone: glucosa 14,5 g; cloruro de sodio 1,2 g; bicarbonato de sodio 2,0 g; cloruro de potasio 2,2 g; agua destilada hasta 1000 ml. Esta solución es isotónica, contiene la cantidad requerida de bicarbonato de sodio, la concentración de potasio en ella no excede la permisible y la relación de la concentración osmótica de glucosa y sales es 2: 1. En la etapa inicial de la diuresis forzada, también es recomendable introducir soluciones de sustitución del plasma y cualquier desintoxicación: albúmina 8-10 ml/kg, hemodez o neocompensan 15-20 ml/kg, mafusol 8-10 ml/kg, refortan o infucol 6-8 ml/kg kg, reopoliglyukin 15-20 ml/kg. La cantidad total de soluciones inyectadas debe exceder aproximadamente 1,5 veces el requerimiento diario. Autor: Kolesnikova M.A.
▪ Teoría del aprendizaje. Notas de lectura ▪ Historia del nuevo tiempo. Cuna
Máquina para aclarar flores en jardines.
02.05.2024 Microscopio infrarrojo avanzado
02.05.2024 Trampa de aire para insectos.
01.05.2024
▪ Discos DVD+RW para grabación de vídeo ▪ Descubierto el mecanismo del envejecimiento del sistema inmunitario ▪ Nuevos sensores de corriente de dos etapas
▪ sección del sitio Baterías, cargadores. Selección de artículos ▪ artículo Aralia en forma de corazón. Leyendas, cultivo, métodos de aplicación. ▪ artículo Moneda de cría. Secreto de enfoque
Hogar | Biblioteca | Artículos | Mapa del sitio | Revisiones del sitio www.diagrama.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

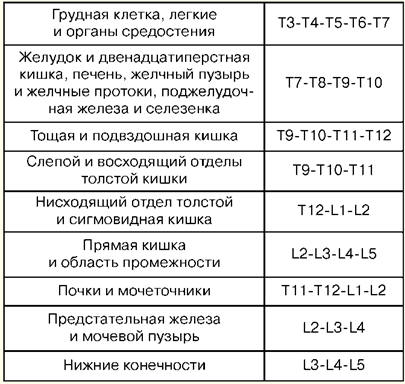











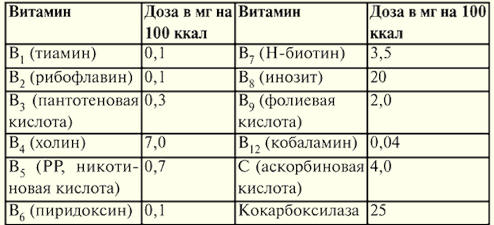

 Ver otros artículos sección
Ver otros artículos sección 